第二节化学电源
四2.1化学电源ppt课件

其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 2H2-4e-+4OH-=4H2O 。
可编辑ppt
9
2、甲烷碱性燃料电池: 电解质溶液:KOH 负极:CH4- 8e-+10OH- =CO32- +7H2O 正极: 2O2 + 4H2O + 8e-= 8OH总反应:CH4+2O2+2KOH=K2CO3+3H2O
可编辑ppt
10
1、电池是人类生产和生活中的重要能量来源, 各式各样电池的发明是化学对人类的一项重大贡
献,下列有关电池的叙述不正确的是( B )
A.手机上用的锂离子电池属于二次电池 B.甲醇燃料电池中甲醇参与正极反应 C.碱性锌锰电池中,锌电极是负极 D.太阳能电池的主要材料是高纯度的硅
可编辑ppt
6
三、燃料电池:
正负两极相同,均为Pt或C,仅起导电作用。 负极均为燃料反应,正极均为O2反应,总反 应是燃料的燃烧反应(不写点燃条件)。
燃料电池是一种连续 地将燃料和氧化剂的化 学能直接转换成电能的 化学电池。
1、氢氧燃料电池:
可编辑ppt
7
1、氢氧燃料电池:
电解液呈中性:
负极:2H2 - 4e- = 4H+ 正极:O2 + 2H2O + 4e-= 4OH总反应:2H2是以平行排列的铅、铅锑合金栅 板为主架,栅格中交替地填充着负极和正极的 铅和二氧化铅,电解质为H2SO4溶液。
可编辑ppt
H2SO4
第二节 化学电源

3.燃料电池
氢氧燃料电池,烃、肼、甲醇、氨、煤气燃料 电池……
酸性氢氧燃料电池 1、正负极材料
正极室:通氧气 (氧化剂) (燃料) 负极室:通氢气 电解质:H2SO4溶液 使用铂电极
2、工作机制
总反应:2H2 + O2 = 2H2O
负极: 2H2 - 4e- = 2H+
正极:
O2 + 4H+ +4e- = 2H2O
铅蓄电池充电的反应则是上述反应的逆过程
①充电过程
接电源负极 还原反应 阴极:PbSO4 (s) +2e- =Pb(s) + SO42- (aq) 接电源正极 氧化反应 阳极: 2PbSO4 (s)+2H2O(l) -2e- = PbO2(s) + H+(aq) + SO42-(aq) 充电过程总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq) 铅蓄电池的充放电过程:
作业:完成《全优课堂》75—77页
普通干电池
第二节 化学电源 手机电池 钮扣电池
普宁市华侨中学 庄秀文 黄钢标 摄像机 专用电池 “神六”用 太阳能电池
笔记本电脑 专用电池
课程标准导航
1.了解化学电源的种类及其工作原理,知道化 学电源在生产、生活和国防中的实际应用。 2.认识化学能与电能相互转化的实际意义及 其重要作用。
3.掌握一次电池、二次电池、燃料电池的反
电解质:KOH
碱性锌锰电池构造示意图
工作机制
负极:Zn + 2OH- -2e- =Zn(OH)2 氧化反应
氢氧化氧锰 正极:2MnO2 + 2H2O+2e-=2MnOOH+2OH还原反应
第二节 化学电源

2、目前化学电池主要分哪几大类?
一次电池: 电池中的反应物质 普通干电池
进行一次氧化还原反应并放电 碱性锌锰电池
之后,就不能再次利用。
锌银纽扣电池
化 学
二次电池: 又称充电电池或蓄
铅蓄电池
电 电池。放电后经充电可使电 锌银蓄电池
池 池中的活性物质获得再生, 镍镉电池
• 电池总反应: Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2
普通锌锰电池
锌筒
石墨棒 NH4Cl、ZnCl2 和 H2O等 MnO2和C
普通锌锰干电池的结构
2、碱性锌锰电池:(-) Zn│KOH│MnO2 (+) 负极(Zn):Zn + 2OH- - 2e- = Zn(OH)2 正极(MnO2):2MnO2+2H2O+2e- = 2MnOOH+2OH电池总反应:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2
2、燃料电池的特点
①燃料从负极通入,助燃剂氧气从正极通入。 ②电极材料一般不参加化学反应,只起传导电子的作用。
3、燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充; ②反应产物不断排出; ③能量转化率高(超过80%),普通的只有30%,有利
于节约能源。 缺点:附属设备较多、体积较大、 优点:能量转换率高、运行噪音低,清洁。
第二节 化学电源
[学与问]在日常生活和学习中,你用过哪 些电池,你知道电池的其它应用吗?
化学电池 将化学能转换成电能的装置
电池
太阳能电池 将太阳能转换成电能的装置
选修四第四章 第二节 化学电源

第四章 第二节 化学电源一、化学电源:化学电池是将________能变成_____能的装置,它包括_____电池,____电池和_____电池等几类。
1.一次电池(1)碱性锌锰电池,电解质是KOH ,其电极反应:负极(Zn ):正极(MnO 2):总反应:(2)银锌钮扣电池(2)锌银电池的负极是Zn ,正极是Ag 2O ,电解质是KOH ,其电极总反应如下:Zn +Ag 2O +H 2O = Zn (OH )2+2Ag负极:Zn +2OH --2e - =Zn (OH )2正极:Ag 2O +H 2O +2e - =2Ag +2OH -银锌电池跟铅蓄电池一样,在使用(放电)一段时间后就要充电,充电过程表示如下: 阳极:2Ag +2OH --2e - =Ag 2O +H 2O阴极:Zn (OH )2+2e - =Zn +2OH -总反应式:Zn +Ag 2O +H 2Zn (OH )2+2Ag (3)锂离子电池:(5) 锂电池(非水有机溶剂电解液)负极:2Li-2e -=2Li +,正极:I 2+2e -=2I -, 总反应:2Li+I 2=2LiI2.二次电池:(1)铅蓄电池放电,电极反应为:负极:Pb +SO 42--2e -=PbSO 4↓ 正极:PbO 2+4H ++SO 42-+2e -=PbSO 4↓+2H 2O 充电,其电极反应为:阳极:PbSO 4+2H 2O -2e - =PbO 2+4H ++SO 42- 阴极:PbSO 4+2e -=Pb +SO 42- 蓄电池放电和充电的总反应式:PbO 2+Pb +2H 2SO 44↓+2H 2O3.燃料电池:燃料电池燃料电池是一种持续地将燃料和氧化剂的化学能直接转换成电能的化学电池。
它与一般的化学电源不同,一般化学电池的活性物质储存在电池内部,故而限制了电池的容量,而燃料电池的电极本身不包括活性物质,只是一个催化转化元件。
如:氢氧燃料电池。
第二节 化学电源
3、镉镍电池
负极材料:Cd;
正极材料:涂有NiO2,
电解质:KOH溶液。 反应式如下: NiO2+Cd+2H2O
放电
充电
Ni(OH)2+ Cd(OH)2
例:镍—镉可充电电池可发生如下反应:
Cd(OH)2+2Ni(OH)2 A. Cd
C. Cd(OH)2
充电 Cd+2NiO(OH)+2H O 2 放电
书写电极反应式应注意以下几点:
1.电极反应是一种离子反应,遵循书写离 子反应的所有规则(如“拆”、“平”);
2.将两极反应的电子得失数配平后,相加 得到总反应,总反应减去一极反应即得到 另一极反应;
3.负极失电子所得氧化产物和正极得电子 所得还原产物,与溶液的酸碱性有关(如 +4价的C在酸性溶液中以CO2形式存在, 在碱性溶液中以CO32-形式存在);
2、银锌蓄电池
练习:银-锌蓄电池广泛用作各种电子仪器的 电源,它的充电和放电过程可以表示为:
充电
2Ag+Zn(OH)2 A.Ag
放电
Ag2O+Zn+H2O C.Ag2O D.Zn
D 此电池放电时,负极上发生反应的物质是( )
B.Zn(OH)2
电极反应: 负极:Zn-2e-+2OH-=Zn(OH)2 正极:Ag2O+2e-+H2O=2Ag+2OH-
(一)一次电池 一次电池又称不可充电电池
1、普通干电池
(Zn):Zn – 2e- = Zn2+ 负极 正极 (MnO2和C): 电池反应:
优点:制作简单、价格便宜。 缺点:放电 时间短,电压下降快,易气涨或漏液。
2、碱性锌-锰干电池 电池反应: Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 [思考]该电池的正负极材料和电解质? 负极--Zn Zn + 2OH- - 2e- = Zn(OH)2 正极—MnO2 2MnO2+2H2O+2e-=2MnOOH+2OH电解质: KOH
第二节 化学电源

负极
正极
书写电极反应式应注意以下几点 1.将两极反应的电子得失数配平后,相加得到总反应,总反应 减去一极反应即得到另一极反应; 2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶 液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在 碱性溶液中以CO32-形式存在); 3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性 或中性溶液中它与水结合成OH-;
负极: Al+ 4OH-—3e- =Al O2- +2H2O
正极:2H2O + 2 e- = H2+ 2OH-
总:2Al+ 2OH- +2H2O =2Al O2- + 3H2 负极: Cu —2e- = Cu 2+
正极: 2H+ +NO3- + e- = NO2 + H2O
总:Cu + 4H+ +2NO3-=2NO2 + Cu 2+ + 2H2O
小,单位:W/kg ,W/L 储存时间:电池的可储存时间的长短
一、一次电池
放电之后不能充电(内部的氧化还原反应不可逆) 1.锌锰电池
普通锌锰电池
锌筒 石墨棒 NH4Cl、ZnCl2 和 H2O等 MnO2和C
碱性电池
普通锌-锰干电池的结构
锌锰电池工作原理 (1)普通锌锰干电池:活性物质为NH4Cl和淀粉糊,做电 解质,还填有MnO2 和炭黑。电极反应式:
5.熔融盐燃料电池具有高的发电效率,因而受到重视,可用 Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阳极燃气, 空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃 料电池,完成有关的电池反应式: 负极反应式:2CO+2CO32- = 4CO2+4e正极反应式:2CO2+O2+4e- = 2CO32总电池反应: 2CO+O2 = 2CO2
第二节 化学电源
第二节化学电源一、化学电池化学电池是利用原电池原理,将化学能转化为电能的装置。
二、常用电池1.一次电池【针对训练】1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O===ZnO+Mn(OH)2下列说法中,错误的是( )A.电池工作时,锌失去电子B.电池正极的电极反应式为MnO2+2H2O+2e-===Mn(OH)2+2OH-C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g2.某新型可充电电池,能长时间保持稳定的放电电压。
该电池的总反应式为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是( )A.放电时负极反应式为Zn-2e-+2OH-===Zn(OH)2放电充电B .放电时正极反应式为FeO 2-4+4H 2O +3e -===Fe(OH)3+5OH -C .放电时每转移3 mol 电子,正极有1 mol K 2FeO 4被氧化D .充电时阳极附近的溶液的碱性减弱3.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO 4,干燥后再安装,充电后即可使用,发生的反应是2PbSO 4+2H 2O PbO 2+Pb +2H 2SO 4 下列对铅蓄电池的说法错误的是( ) A .需要定期补充硫酸B .工作时铅是负极,PbO 2是正极C .工作时负极上发生的反应是Pb -2e -+SO 2-4===PbSO 4 D .工作时电解质的密度减小4.固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O 2-)在其间通过。
该电池的工作原理如下图所示,其中多孔电极a 、b 均不参与电极反应。
下列判断正确的是( )A .有O 2参加反应的a 极为电池的负极B .b 极的电极反应式为H 2-2e -+O 2-===H 2O C .a 极对应的电极反应式为O 2+2H 2O +4e -===4OH -D .该电池的总反应式为2H 2+O 2=====高温2H 2O5.有位科学家说:“甲烷是21世纪的新燃料。
第4章 第2节化学电源
如果题目给定的是总反应式,可分析此反应中的氧化反应或还 原反应(即分析有关元素的化合价变化情况),再选择一个简单变化情 况去写电极反应式,另一极的电极反应式可用总反应式减去已写出 的电极反应式得出。 以 2H2+O2 2H2O 为例,当电解质溶液为 KOH
溶液时的电极反应式的书写步骤如下: (1)根据总反应方程式分析有关元素化合价的变化情况,确定 2 mol H2 失去 4 mol 电子,初步确定负极反应式为 2H2-4e4H+。
5.用 NO 生产硝酸,可以有效消除污染,其 工作原理如图所示。下列说法正确的是 ( D )。 A.a 极是该电池的正极 B.电流经导线由 a 极流向 b 极 C.b 极发生氧化反应 D.a 极的电极反应式为 NO+2H2O-3eNO3 +4H+
6.某种燃料电池的负极反应式为 S + 4H2O - 8e 通过,下列有关该电池的说法中正确的是( B.质子由正极移向负极 C.该电池的总反应式为 S +2O2
电源是能够实际应用的原电池,作为化学电源的电池有一次电池、 可充电电池和燃料电池等。一次电池只能放电不能充电,使用后即 弃去,因此可能造成环境污染。可充电电池也称为二次电池,可以反 复充电和放电,是电池发展的一个重要方向。
1.了解几种常见化学电源(一次电池、二次电池、燃料电池)的工 作原理。 2.正确书写有关电池的电极反应式和电池总反应。 3.了解化学电源的广泛应用及废旧电池的危害。
c.工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物
,酸性电解质。 2H ; ; 。
+
①一次
②二次
③燃料
④较高
⑤多
⑥大
⑦长
第二节 化学电源
金
Zn(-)
属
外
Ag2O(+) 壳
浸有KOH(aq)的隔板
总反应:Ag2O+Zn=ZnO+2Ag 负极:Zn+2OH--2e-=ZnO+H2O 正极:Ag2O+H2O+2e-=2Ag+2OH-
3:锂电池 8Li+3SOCl2=6LiCl+Li2SO3+2S
负极:Li—2e-=Li+
锂是密度最小的金属。锂电池是金属锂作 负极,它是一种高能电池,它具有比能量高、 电压高、工作温度宽和可储存时间长的优点。 ——导电介质一般不能用水或酸溶液
面世,其结构示意图如下。甲醇在催化剂作用下 提供质子(H+)和电子,电子经外电路、质子经内
电路到达另一电极后与氧气反应,电池总反应为: 2AC.H右3O电H极+为3O电2=池2C正O2+极4,H2O。
b处通入的物质是 O2 。 B.左电极为电池 负 极,
a处通入的物质是 CH3OH 。
C.负极反应式为:2CH3OH-12e-+2H2O=2CO2+12H+。
3、锂电池
锂亚硫酰氯电池(Li-SOCl2):8Li+3SOCl2=6LiCl+Li2SO3+2S 负极:8Li-8e-=8Li+ ;正极: 3SOCl2+8e-=6Cl-+SO32-+2S。
用途:质轻、高能(比能量高)、高工作效率、高稳定电压、工 作温度宽、高使用寿命,广泛应用于军事和航空领域。
第二节 化学电源
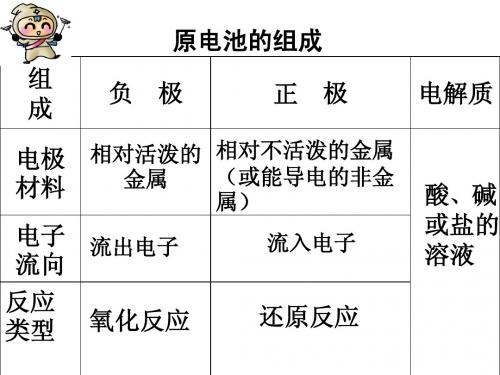
复习提问:1、什么叫原电池
答案:借助氧化还原反应,把化学 能转化为电能的装置。
2、原电池负极参加反应的物质是什么?负极发
生什么反应?
答:还原剂在负极失去电子,发生氧化反 应
4.2 化学电源
第二节化学电源1.碱性锌锰电池的负极是Zn,正极是MnO2,电解质溶液是KOH。
2.铅蓄电池是最常见的二次电池,正极是PbO2,负极是Pb,电解质溶液是H2SO4溶液。
3.氢氧燃料电池两类型:(1)酸性电解质时:负极反应式:2H2-4e-===4H+;正极反应式:O2+4H++4e-===2H2O。
(2)碱性电解质时:负极反应式:2H2+4OH--4e-===4H2O;正极反应式:2H2O+O2+4e-===4OH-。
化学电池[自学教材·填要点]1.概念将化学能变成电能的装置。
2.分类3.电池优劣的判断标准(1)单位质量或单位体积所输出的电能的大小(比能量),或者输出的功率的大小(比功率)。
(2)电池储存时间长短。
[师生互动·解疑难](1)化学电池能量转化率高,供能稳定可靠。
(2)可制成各种形状和大小,不同容量和电压的电池及电池组,使用方便。
(3)电池中的镍、镉、锰、铅等金属离子会对土壤、水源造成污染,应集中回收处理。
1.下列说法中,不.正确的是()A.化学电池是将化学能转变成电能的装置B.化学电池的种类包括一次电池、二次电池和燃料电池等C.化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护D.废旧电池可以随意丢弃一次电池——碱性锌锰电池[自学教材·填要点]1.构造2.组成正极材料:MnO2;负极材料:Zn;电解质:KOH。
3.工作原理负极:Zn-2e-+2OH-===Zn(OH)2;正极:2MnO2+2H2O+2e-===2MnOOH+2OH-;总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
[师生互动·解疑难](1)碱性锌锰干电池克服了普通锌锰干电池的缺点,单位质量所输出的电能多且储存时间长,适用于大电流和连续放电。
(2)纽扣式锌银电池的负极是Zn,正极是Ag2O,电解质是KOH。
(3)锂电池的负极是Li,正极是MnO2、CuO、FeS2等,锂电池的比能量高,电压高,可储存时间长。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节化学电源
【学习目标】
1.掌握常见化学电源的种类及其工作原理。
2.小组合作探究新型电池的工作原理并能书写电极反应式和电池反应方程式。
【学习重、难点】
常见化学电源的工作原理
【自学探究】
阅读教材79-83 页,思考下列问题
①目前化学电池主要分为哪几个大类?在性能等方面它们各有什么特点?产生电能
的基本原理是什么?
②化学电池与其他能源相比有哪些优点?
③判断电池的优劣标准主要是什么?
【知识小结】
化学电池
①概念:
②分类:
③优点:
④电池优劣的判断标准:
一.一次电池
碱性锌锰干电池的负极是_____,正极是_____,电解质是_____,
其电极反应式是:正极_________________________;
负极______________________________;
电池反应是____________________________________。
【练习一】
1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌-锰碱性电池以氢氧化钾溶液为电解质,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
下列说法错误的是()
A.电池工作时,锌失去电子
B.电池正极的电极反应式:2MnO2(s)+H2O(l)+2e—→Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g 2.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没
有铅污染。
其电池反应为:2Zn+O2===2ZnO,原料为锌粒、电解质和空气,则下列
叙述正确的是 ( )
A.锌为正极,空气进入负极反应
B.负极反应为:Zn-2e-===Zn2+
C.正极发生氧化反应
D.电解质肯定不是强酸
二.二次电池
铅蓄电池可放电亦可充电,在正极版上有一层棕褐色的________,负极板是海绵状的________ ,两极均浸入________溶液中。
(1) 放电时可看作是_______池,
负极反应式:_____________________________;
正极反应式:______________________________;
总反应式:。
(2) 放电进行到硫酸的浓度较低时需充电,充电时可以看作是电解池,电极反应式为:
阴极:PbSO4+2e- →Pb+SO42-;
阳极:PbSO4+2H2O-2e-→PbO2+SO42-+ 4H+
总反应式:。
(3) 电池总反应方程式:。
【练习二】
1.汽车启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+ Pb+2H2SO4 =2PbSO4↓+2H2O,根据次反应判断下列叙述中正确的是 ( )
A.PbO2 是电池的负极
B.负极的电极反应式为:Pb+SO42- -2e-→PbSO4↓
C.PbO2 得电子,被氧化
D.电池放电时,溶液酸性增强
放电
2.锂电池反应原理如下:FePO4+Li
LiFePO4,内部为能够导电的固体电解质。
充电
下列有关该电池说法正确的是 ( ) A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动
C.放电时,Li发生还原反应
D.放电时电池正极反应为:
三.燃料电池
氢氧燃料电池
(1)若以H2SO4溶液为电解质溶液
负极:;正极:
总反应方程式:
(2)若以KOH为电解质溶液
负极:;正极:
总反应方程式:
【规律】1.总反应式=___________________________________
2.常见燃料电池,燃料均是从负极通入,助燃物质从正极通入,电极作用:导电。
【练习三】
1.阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解质溶液为KOH溶液,反应保持在较高温度,使水分蒸发,则下列叙述正确的是()A.此电池能发出蓝色光焰B.H2为正极,O2为负极
C.工作时,电解质溶液的pH不断减小
D.电极反应式:负极2H2+4OH—→4H2O+4e—正极O2+2H2O+4e—→4OH—2.有一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化鋯(ZrO2)晶体,在熔融状态下能传导O2—。
下列对该燃料电池说法正确的是()
A.在熔融电解质中,O2—由负极移向正极
B.电池的总反应是:2C4H10+13O2 = 8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+2H2O+4e—→4OH—
D.通入丁烷的一极是正极,电极反应为:C4H10+13O2+26e—→4CO2+5H2O
【课堂反馈】
1.下列有关电池的说法不正确的是() A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.氢氧燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
2.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。
关于该电池的下列说法不正确的是()
A.水既是氧化剂又是溶剂B.放电时正极上有氢气生成
C.放电时OH-向正极移动D.总反应为:2Li +2H2O===2LiOH+H2↑3.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是()
A.a电极是负极
B.b电极的电极反应为:4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置4.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为C2H6+18OH--14e-===2CO2-3+12H2O,7H2O+7/2O2+14e-===14OH-,有关此电池的推断正确的是()
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中CO2-3向正极移动
5.下图2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另外一极与氧气反应,电池总反应为2CH3OH+3O2→2CO2+4H2O下
列说法正确的是()
A.左电极为电池的阴极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应式:CH3OH+H2O→ CO2+6H++6e—
D.正极反应式:O2+2H2O+4e—→ 4OH-
6.1991年我国首创以铝、空气、海水电池为能源的新型海水标志灯已经研制成功。
该灯以海水为电解质溶液,靠空气中氧使铝不断氧化产生电流。
只要把灯放入海水中数分钟就发出耀眼的闪光,其能量比干电池高20到50倍。
运用所学的化学知识,推测该新型电池两极上可能发生的电极反应。
负极____________________________;正极____________________________。
7.以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。
电池反应方程式为____________________________________;
放电时,CO32—移向电池的_________(填“正”或“负”)极。
8.镉镍可充电电池在现代生活中有着广泛的应用,它的充、放电反应如下:
Cd+2NiOOH+2H2O 放电
充电
Cd(OH)2+2Ni(OH)2
请回答下列问题:
(1)反应式中左边物质的总能量________(“大于”“小于”或“等于”)右边物质的总能量。
(2)放电时负极发生反应的物质是________,正极的电极反应式为:__________________。
(3)镉镍废旧电池必须进行回收并集中处理,最主要的原因是:______________________。
