工业盐酸的总酸度、灼烧残渣、游离的测定
工业用盐酸的测定

工业用合成盐酸1.3.1工业用合成盐酸中总酸度的测定—滴定法本方法规定了用滴定法测定工业用合成盐酸的总酸度,适用于各级工业用合成盐酸。
1)方法原理试样溶液以溴甲酚绿为指示剂,用氢氧化钠标准溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H ++OH -→H 2O2)试剂和材料2.1)本方法使用蒸馏水或相应纯度的水。
2.2)氢氧化钠标准滴定溶液:c(NaOH)= 1.000mol/L ,按GB601配制及标定。
2.3)溴甲酚绿(HG 3—1220):1g/L 乙醇溶液,按GB603配制。
3)仪器3.1)一般实验室仪器;3.1)锥形瓶:100mL (具磨口塞); 4)样品4.1)实验室样品4.1)按本标准第5.3条、5.4条和5.5条的规定采样。
5)试样 试样与实验室样品相同。
6)分析步骤从试样中吸取约2.5mL 盐酸,置于内装15mL 水并已称量(准确至0.0002g)的碘量瓶中,混匀并称量,准确至0.0002g 。
向试样中加2~3滴溴甲酚绿。
用氢氧化钠标准溶液滴定至溶液由黄色变为蓝色为终点。
7)分析结果的表述盐酸的总酸度(以HCL 计)百分含量(X 1)按下式计算:10003646.01⨯⨯=mcV X式中:V — 氢氧化钠标准滴定溶液的体积,mL ;c — 氢氧化钠标准滴定溶液之物质的量浓度,mol/L ; m — 试样质量,g ;0.03646—氯化氢的毫摩尔质量的数值,g/mmol 。
8)允许差两次平行测定结果之差不大于0.2%,取其算术平均值作为报告结果。
1.3.2 工业用合成盐酸中铁含量的测定—邻菲啰啉分光光度法本方法规定了用邻菲啰啉分光光度法测定工业用合成盐酸中铁含量,适用于各级工业用合成盐酸。
1)方法原理用盐酸羟胺将盐酸中三价铁离子还原成二价铁离子,在PH值为4.5的条件下,二价铁离子与邻菲啰啉反应生成桔红色络合物,在该络合物最大吸收值处(波长510nm)用分光光度计测定吸光度。
工业盐酸质量标准及特征概述
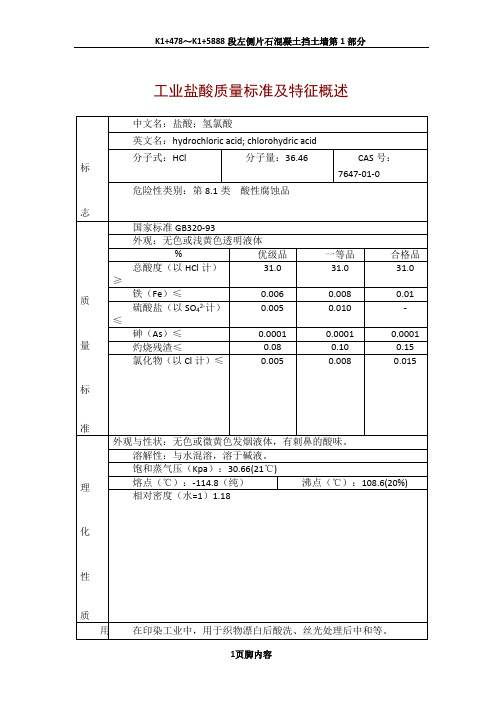
工业盐酸质量标准及特征概述
食品级盐酸
一、性状:
无色或淡黄色透明液体,是一种强酸,常温下挥发刺激性气体,能与很多金属作用。
二、质量指标GB/T1897-1995
项目指标%
总酸度(以HCl计) ≥31.0
铁含量≤0.001
硫酸盐(以SO4计) ≤0.007
氧化物(以Cl2计) ≤0.003
还原物(以SO3计)≤0.007
灼烧残渣≤0.05
砷(AS)≤0.0001
重金属(以Pb计)≤0.0005
三、用途:
应用于医药、食品等行业。
四、包装:
贮罐或管道运输,容器外应有"食品添加剂-盐酸"标志。
五、贮运:
贮存和运输中应避免有毒物质的污染。
不是每个人都能成为,自己想要的样子,但每个人,都可以努力,成为自己想要的样子。
相信自己,你能作茧自缚,就能破茧成蝶。
GB320-2006工业用合成盐酸

工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求外观:工业用合成盐酸为无色或浅黄色透明液体。
工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。
将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
外观目视观察总酸度的测定滴定法原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H++OH-→HO2试剂氢氧化钠标准滴定溶液:c(NaOH)=1mol/L溴甲酚绿指示液:1g/L。
仪器一般的实验室仪器和以下仪器。
锥形瓶,100mL(具磨口塞)。
滴定管,50mL,有分度值。
分析步骤 试料量取约3ml 实验室样品,置于内装约15ml 水并已称量(精确到)的锥形瓶()中,混匀并称量(精确到)。
盐酸 游离酸度及总酸度的测定

游离酸度、总酸度及酸比
磷化液试样的的取样时间:1.刚收工或上班未加料时,
2.加料后磷化1~2根时。
1、游离酸度的测定
用移液管吸取10 ml试液于250ml锥形瓶中,加50ml蒸馏水,加2—3滴甲基橙指示剂(或溴酚蓝指示剂)。
用0.1mol/l氢氧化钠标准液滴定至溶液呈橙色(或用溴酚蓝指示剂滴定至由黄变蓝紫色)即为终点,记下的耗氢氧化钠标准液毫升数即为滴定的游离酸度点数。
游离酸度一般控制在4~8
2、总酸度的测定
用移液管吸取10 ml试液于250ml锥形瓶中,加50ml蒸馏水,加2—3滴酚酞指示剂。
用0.1mol/l氢氧化钠标准液滴定至粉红色即为终点,记下的耗氢氧化钠标准液毫升数即为滴定的总酸度点数。
总酸度一般控制在35~60
3.酸比的计算
总酸度(点数)
酸比= —————————一般控制在6~10之间
游离酸(点数)
4.标准液的配制
0.1mol/l氢氧化钠标准液:
用天平称取2克氢氧化钠,在烧杯中加蒸馏水溶解,转移入500ml的容量瓶中加水至刻度,摇匀后转移入玻璃瓶中待用。
甲基橙指示剂:1g·L-1水溶液
酚酞指示剂:(1) 0.1g指示剂溶于100mL60%乙醇中
(2) 1g酚酞溶于100mL90%乙醇中
溴酚蓝指示剂:0.1g指示剂溶于100mL20%乙醇中
盐酸的检测:
(稀释100倍后,用0.1N的氢氧化钠标准溶液滴定)
计算公式:N酸V酸=N碱V碱
加入氟化钠掩蔽高铁离子,可选用用甲基红,甲基橙,溴酚蓝,溴甲酚绿做指示剂,用标准氢氧化钠溶液测定,在pH4左右变色,亚铁离子不会有干扰,不可选用酚酞,那样终点的pH太高,亚铁离子有干扰。
GB320-2006工业用合成盐酸
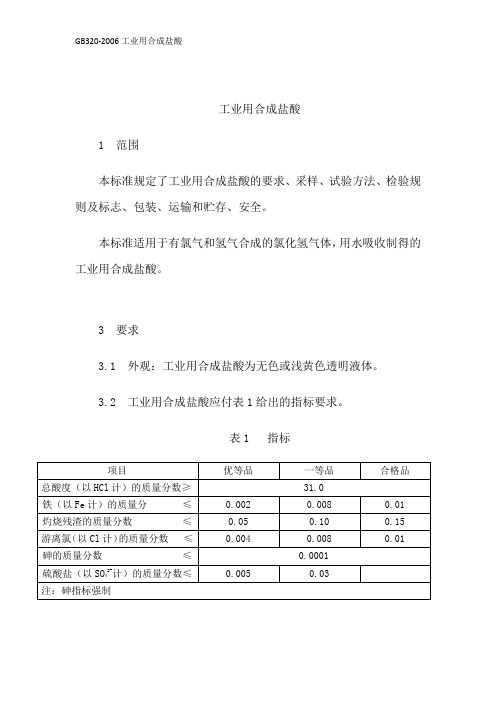
工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
4.2 工业用合成盐酸从槽车或贮槽xx采样时,宜用GB/T6680xx规定的适宜的耐酸采样器自上、xx、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
4.3 工业用合成盐酸从塑料桶或陶瓷坛xx采样时,按GB/T6678xx规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680xx规定的适宜耐酸采样器自上、xx、下三处采取等量的有代表性样品。
4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,xx。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析xx仅使用确认为分析纯试剂和GB/T6682xx规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
5.1 外观目视观察5.2 总酸度的测定滴定法5.2.1 原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H++OH-→H2O5.2.2 试剂5.2.2.1 氢氧化钠标准滴定溶液:c(NaOH)=1mol/L5.2.2.2 溴甲酚绿指示液:1g/L。
5.2.3 仪器一般的实验室仪器和以下仪器。
5.2.3.1 锥形瓶,100mL(具磨口塞)。
GB320_2006工业用合成盐酸
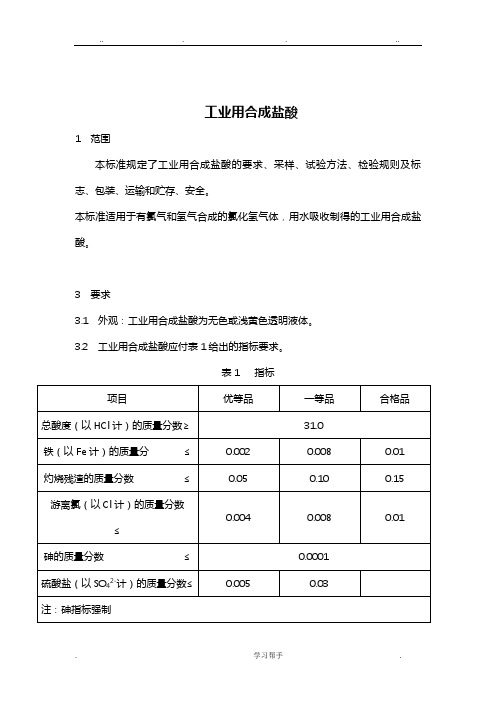
工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。
4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
5.1 外观目视观察5.2 总酸度的测定滴定法5.2.1 原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H++OH-→H2O5.2.2 试剂5.2.2.1 氢氧化钠标准滴定溶液:c(NaOH)=1mol/L5.2.2.2 溴甲酚绿指示液:1g/L。
5.2.3 仪器一般的实验室仪器和以下仪器。
5.2.3.1 锥形瓶,100mL(具磨口塞)。
盐酸检测标准

工业用合成盐酸检测标准1 范围本规范规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本规范适用于由氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
2 规范性引用文件下列文件中的条款通过本规范的引用而成为本规范的条款。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 190 危险货物包装标志GB/T 191 包装储运图示标志(GB/T 191_2000,eqv ISO780:1997)GB/T 601 化学试剂规范滴定溶液的制备GB/T 602 化学试剂杂质测定用规范溶液的制备(GB/T603-2002,ISO 6353-1982,NEO)GB/T 1250 极限数值的表示方法和判定方法GB/T 6678 化工产品采样总则(GB/T 6678—1986,neq ASTM E300:1983)GB/T 6680 液体化工产品采样通则(GB/T 6680_1986,neq BS5309:1976)GB/T 6682 分析实验室用水规格和试验方法(GB/T 6682—1992,eqv ISO 3696:1987)GB 320-2006 工业用合成盐酸3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应符合表 1 给出的指标要求。
表1 盐酸技术指标指标项目优等品一等品总酸度(以HCl 计)的质量分数,% ≥31铁(以Fe 计)的质量分数,% ≤0.002 ≤0.008灼烧残渣的质量分数,% ≤0.05 ≤0.10游离氯(以Cl 计)的质量分数,% ≤0.004 ≤0.008砷的质量分数,% ≤0.0001硫酸盐(以SO42-计)的质量分数,% ≤0.005 ≤0.03 注:砷指标强制。
4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
GB3202006工业用合成盐酸
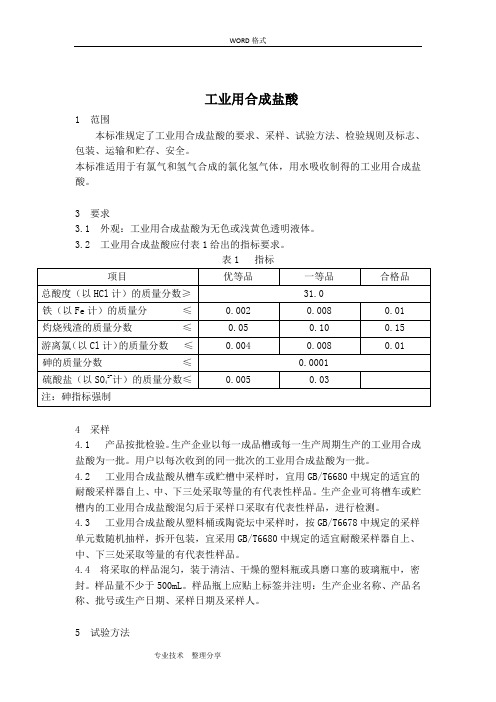
工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。
4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
5.1 外观目视观察5.2 总酸度的测定 滴定法 5.2.1 原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H ++OH -→H 2O5.2.2 试剂5.2.2.1 氢氧化钠标准滴定溶液:c (NaOH )=1mol/L 5.2.2.2 溴甲酚绿指示液:1g/L 。
5.2.3 仪器一般的实验室仪器和以下仪器。
5.2.3.1 锥形瓶,100mL (具磨口塞)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工业盐酸
一、工业盐酸总酸度的测定
(一)原理
试剂溶液以溴甲酚绿为指示剂,用氢氧化钠标准溶液滴定至溶液由黄色变为蓝色为终点。
固体氢氧化钠具有很强的吸湿性,易吸收二氧化碳和水分,且含杂质,故不能直接配制成标准溶液。
常用邻苯二甲酸氢钾或草酸标定。
反应式为固体氢氧化钠具有很强的吸湿性,易吸收二氧化碳和水分,且含杂质,故不能直接配制成标准溶液。
常用邻苯二甲酸氢钾或草酸标定。
反应式为::
KHC
8H
4
O
4
+NaOH=KNaC
8
H
4
O
4
+H
2
O
(二)试剂
0.1mol/LNaOH、溴甲酚绿、酚酞、工业盐酸、邻苯二甲酸氢钾。
(三)仪器
锥形瓶、滴定管、量筒、容量瓶、玻璃棒、胶头滴管、天平、称量瓶、移液管、
洗耳球。
(四)步骤
1、氢氧化钠的标定
用减量法精确称取于105℃--110℃电烘箱中干燥至恒重点邻苯二甲酸氢钾
基准试剂三份,每份0.4——0.6g,分别置于三个锥形瓶中,加三级水20—30mL
溶解,加两滴酚酞指示剂(10g/L)。
用欲标定氢氧化钠溶液滴定至溶液呈粉红色,
保持30秒不褪色,即为终点,记录消耗氢氧化钠标准溶液的体积分数。
NaoH的标定
1 2 3
邻苯二甲酸氢钾前g 14.7756 25.9470 21、1373 后g 14.3550 25.5233 20.6022 △m g 0.4206 0.4237 0.5551 V NaoH ml 20.80 20.91 27.16 C NaoH mol/L 0.09912 0、09932 0.09946 C NaoH 平均值 mol/L 0.09936
dr %0.13
2、滴定
量取约3mL实验室样品,置于内装约15mL水并已称量(精确到0.0001g)的
锥形瓶中混匀并称量(精确到0.0001g)。
向试料中加(2---3)滴溴甲酚绿指示
剂,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
总酸度的测定
1 2
盐酸前 g 118.7314 118.3679 后 g 118.3679 117.9415
△m g 0.3635 0.4264
V NaoH ml 29.07 34.05
%29.00 28.97
平均值%28.99
允差%0.03
二、工业盐酸中灼烧残渣的测定
(一)原理
蒸发好一份称好的试料,用硫酸处理,使盐类转变为硫酸盐,在(800±50)℃下灼烧后,称量。
(二)试剂
工业盐酸、硫酸
(三)仪器
电子天平、坩埚、马弗炉、电炉、烧杯、坩埚钳
(四)步骤
1.将瓷坩埚在马弗炉内,以(800±50)℃下灼烧15min,置于干燥器中冷
却至室温,称量,称准至0.0002g。
再用此瓷坩埚称取约50g式样,称准至0.01g。
记为m
2.在电路上小心的加热盛有试样的瓷坩埚,蒸发掉大部分试料(留取5~
10mL左右),冷却至室温,再加1mL硫酸加热至干。
3.再将瓷坩埚放入马弗炉中,温度控制在(800±50)℃,灼烧15分钟,。
取出瓷坩埚,放于干燥器中,冷却至室温,称重,精确到0.0002g。
记为m
1
灼烧残渣的测定
1 2
坩埚 g 84.1831 83.7069
坩埚+盐酸 g 139.4161 /
△M g 55.2330 83.7206
灼烧后 g 84.2111 85.7163
灼烧残渣%0.050 2.4
平均数% 1.225
允差% 2.35
三、工业盐酸中游离氯测定
(一)原理:溶液加入碘化钾试剂,析出碘,以淀粉为指示剂,用硫代硫酸钠标准溶液滴定游离出来的碘
(二)试剂:碘化钾150g/L,硫代硫酸钠标准滴定溶液C=0.1mol/L, 淀粉指示剂:10g/L , 盐酸
(三)仪器:滴定管、碘量瓶(带磨口塞的锥形瓶)
(四)步骤:1.硫代硫酸钠的标定
称取120℃干燥至恒重的基准重铬酸钾0.15g左右,称准至0.001g,置于
500ml 碘量瓶中,加水25ml 使溶解,加碘化钾10ml ,轻轻振摇使溶解,加20%硫酸20ml ,摇匀,水封,放暗处放置5--10分钟,加80ml 水稀释,用配置好的硫代硫酸钠滴定至黄棕色,加淀粉指示剂3ml ,继续滴定溶液有紫色变为亮绿色,记录硫代硫酸钠的体积,平行3次,用公式CV=6m/M 进行计算。
硫代硫酸钠的标定
1 2 3 重铬酸钾称量(前)g 25.9655 25.8325 22.7984 (后)g 26.8325 25.7194 22.6376 △M g 0.1130 0.1131 0.1608 硫代硫酸钠的体积ml 29.05 24.75 35.25 硫代硫酸浓度mol/L 1.1107
0.1103 0.1104
平均值mol / L
0.1105
相对平均偏差 % 0.15 2.滴定
取盐酸50ml ,置于装有100ml 水的锥形瓶中,在锥形瓶中加入10ml 碘化钾,在暗处静置2min ,加入2ml 淀粉指示剂,用硫代硫酸钠标准溶液滴至蓝色消失。
1 2 盐酸(前) g 126.0287 134.1710 (后) g 55.1951 55.8768 △M g 70.8336 78.3002 硫代硫酸钠体积 ml 0.50 0.60
ω %
0.0027 0.0025 ω平均值 %
0.0024 允差 % 0.0002
(一)工业盐酸总酸度的计算 1.NaoH 的标定 CV=m/M
L C /mol 09912.080.20*2044206.01==
C2=0.09932mol/L C3=0.09946mol/L
L C C C C /mol 09936.03
3
21=++=平均数
%13.0%10009936
.00001
.000004.000024.0C dr =⨯++==
平均数相对平均偏差
2.总酸度的测定
m
VcM m cM
V 10100*0
)1000/(=
=
ω
%
00.29%1003635
.0105
.3609936.007.291=⨯⨯⨯⨯=
ω
%
97.282=ω
(二)灼烧残渣的结果计算
%
100⨯=
试样
m m ϖ
%
35.2 1.2%2
2.4%
0.050%%
4.2%1007206
.832
%
050.0%1002357.55028.021==+==⨯==⨯=允差平均ϖωω
(三)工业盐酸游离氯的计算 1.硫代硫酸钠的标定 CV=6m/M
L C /mol 1107.0100005
.2924861330.01=⨯⨯⨯=
C2=0.1103mol/L C3=0.1104mol/L
L C C C C /mol 1105.03
3
21=++=平均数
%
15.0%1001105
.00001
.00002.00002.0C dr =⨯++==平均数相对平均偏差
2.游离氯含量计算
m
VcM
m cM
V 10100*0
)1000/(=
=
ω
0.0002%
0.0026%/2%0025.0%0027.0%
0025.03002.785.351105.06.0%
0027.08336.705.351105.05.021==+==⨯⨯==⨯⨯=允差)(平均值ωωω
五、注意事项
1、工业盐酸的取用需在通风橱内进行,取用时需戴手套。
2、在称量盐酸时需盖上塞子,因为浓盐酸具有挥发性,与空气接触形成酸雾,会腐蚀天平。
3、滴定时,指示剂不宜过多。
4、在使用马弗炉进行灼烧时,需先将坩埚烘干,以免使坩埚炸裂。
六、实验讨论
1.为什么在马弗炉中灼烧残渣实验时要在(800±50)℃进行???
答:因为在(800±50)℃的环境下,大多数物质都要分解,硫酸盐不会分解。
2.为什么工业盐酸在放入马弗炉前先将试料蒸发至5~10mL ?
答:因为工业盐酸蒸发要放出大量的烟,直接用马弗炉蒸发会对设备造成损害。
3.为什么灼烧残渣1.225%>0.15%,相差如此大?
答:分析:坩埚在取的时候,部分坩埚发生炸裂,可能是因为第一,可能坩埚质量
有问题,第二,开炉时没有缓慢冷却,第三:坩埚中有残留的硫酸。
