d区元素1
第十三章 d区和ds区元素

13.1 d区元素通性
(1)熔点、沸点高; 熔点最高的单质: 钨(W,3410±20℃) (2)硬度大; 硬度最大的金属: 铬(Cr),硬度仅次于金刚石. (3)密度大; 密度最大的单质: 锇(Os,22.48g· cm-3) (4)导电性、导热性、延展性好.
上一内容 下一内容 回主目录
返回
上一内容
下一内容
回主目录
返回
13.2 铬的主要化合物
K2Cr2O7 + H2SO4(浓)→ K2SO4 + 2CrO3(暗红色针状结晶) + H2O 在酸性介质中要将Cr3+氧化只有采用强氧化剂, 如K2S2O8: 3+ 22Cr +3S2O8 +7H2O→Cr2O72-+6SO42-+14H+ 氧化值为+3和+6的Cr在酸碱性介质中的相互 转化关系为: OH-,氧化剂 [Cr(OH)4]CrO42OH- H+
过氧化铬很不稳定,在乙醚或 戊醇中较稳定: Cr(Ⅲ)、Cr(Ⅵ)化合物均有毒, 且后者毒性更大.
上一内容 下一内容 回主目录
返回
13.2 铬的主要化合物
Cr3+的鉴定也可以有不同的方法,但是它们 都是在过量OH-的条件下用H2O2将Cr3+氧 化为CrO42-,然后加入不同的试剂: 方法:
(Ni2+/Ni) = -0.25V (Pd2+/Pd) = +0.92V (Pt2+/Pt) = +1.2V(估计值)
(Zn2+/Zn) = -0.763V (Cd2+/Cd) = -0.403V (Hg2+/Hg) = +0.854V
第十六章+d+区元素

Cr2O3 (铬绿)
绿色
CrCl3·6H2O
紫色
KCr(SO4)2·12H2O 暗紫色
198
975 398 2330 83 89
Cr2O3 (铬绿)
受热时的变化 250℃分解为
Cr2O3与O2 熔融不分解
熔融不分解
不分解
失去结晶水
失去结晶水
水溶液中铬的各种离子
颜色
Cr2O
27
橙红
CrO
24
黄
Cr3+(aq) 紫
NH3 冷却
(NH4)2Cr2O7
K2Cr2O7 KCl,浓H2SO4 CrO2Cl2(氯化铬酰) 浓H2SO4, SO2 KCr(SO4)2·12H2O(铬钾矾)
浓HCl
CrCl3·H2O
K2Cr2O7 H2SO 4 (浓) K2SO 4 2CrO 3 (s) H2O
(暗红色,针状)
Cr(OH)
4
H2O Cr2O3 (绿)
(3)
Cr(H
2O)
3的水解
6
[Cr(H2O)6]3+ [Cr(OH)(H2O)5]2+ + H+ K 10-4
2[Cr(H2O)6]3+ [(H2O)4Cr(OH)2Cr (H2O)4]4+
+ 2H+ +2H2O K 10-2.7
2Cr3 3S2 6H2O Cr(OH)3(s) 3H2S(g) 2Cr3 3CO32- 3H2O 2Cr(OH)3(s) 3CO2 (g)
MnSO4和MnCl2。 除MnO2外,余者均易溶于水,相应 含锰离子分别为:MnO4,MnO24和Mn 2。
d区元素一(相关知识点)
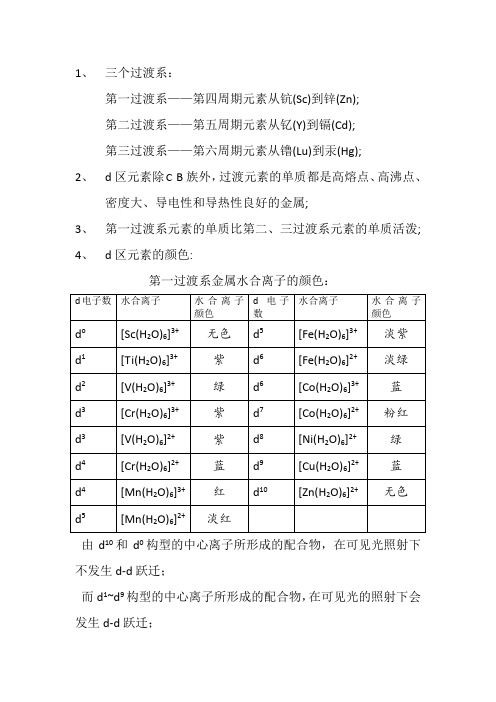
1、三个过渡系:第一过渡系——第四周期元素从钪(Sc)到锌(Zn);第二过渡系——第五周期元素从钇(Y)到镉(Cd);第三过渡系——第六周期元素从镥(Lu)到汞(Hg);2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、密度大、导电性和导热性良好的金属;3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼;4、d区元素的颜色:第一过渡系金属水合离子的颜色:由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;(2)加热TiO 22nH O 可得到白色粉末状的TiO 2:3002222CTiO nH O TiO nH O −−−→+;(3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;(4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法:通常用TiO 2、碳和氯气在800C~900C 时进行反应:800~900224222C CTiO C Cl TiCl CO ++−−−−→+ ;用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下:2TiCl 4+H 2=2TiCl 3+2HCl ;(8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在;(9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:TiO2++H2O2=[TiO](H2O2)]2+(橘黄色) ;(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):2TiO2++Zn+4H+=2Ti3++Zn2++2H2O ;(11)向含有Ti3+的溶液中加入碳酸时:2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:4Ti3++2H2O+O2=4TiO2++4H+;(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;6、(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;浓硫酸和氢氟酸仅在加热条件下与钒发生作用;(4)加热时。
第十六章d区元素一

第十六章d区元素(一)[教学要求]1.了解过渡元素的原子结构特征和通性。
2.了解钛、钒及其重要化合物的性质。
3.了解铬单质的性质。
掌握Cr(Ⅲ)、Cr(Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。
*了解钼、钨的重要化合物。
4.掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质。
5.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律。
掌握Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律。
熟悉铁、钴、镍的重要配合物。
[教学重点]1.过渡元素的价电子构型特点及其与元素通性的关系。
2.Ti、V、Cr、Mn、Fe、Co、Ni的单质及化合物的性质。
[教学难点]第四周期d区金属元素氧化态、最高氧化态氧化物及其水合氧化物的酸碱性、氧化还原稳定性、水合离子以及含氧酸根颜色等变化规律。
[教学时数]10学时[主要内容]1.第一过渡系元素的基本性质。
2.Ti、TiO2、H4TiO4、TiCl4、TiCl3的性质。
3.V、V2O5、钒酸盐和多钒酸盐的性质。
4.Cr的性质,Cr(III)、Cr(VI)化合物的性质。
5.Mn的性质,Mn(II)、Mn(IV)、Mn(VI)、Mn(VII)化合物的性质。
6.Fe、Co、Ni的单质及化合物的性质和用途。
[教学内容]§16.1 d区元素概述16.1.1 d区元素概述1.d区元素在周期表中的位置d区元素(d区金属):周期表中具有部分填充d壳层电子的元素.第一过渡系:周期表中第四周期的d区(3d)元素包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni.第二过渡系:周期表中第五周期的d区(4d)元素包括Zr、Nb、Mo、Tc、Ru、Rh、Pd.第三过渡系:周期表中第六周期的d区(5d)元素包括Hf、Ta、W、Re、Os、Ir、Pt.第四过渡系:周期表中锕(89号)到112号元素。
镧系元素:镧(57号)和镥( 71号)之间的15种元素。
d区元素的应用原理

D区元素的应用原理1. 什么是D区元素D区元素是指周期表中的第三行(即d区)的元素,也被称为过渡元素。
这些元素具有一些特殊的性质,使其在许多领域中具有广泛的应用。
2. D区元素的特性D区元素有以下几个特性:•较高的熔点和沸点:D区元素通常具有较高的熔点和沸点,这是由于它们之间的金属键相对较强导致的。
•多种氧化态:D区元素可以形成多种不同的氧化态,这是由于其外层d电子的不稳定性决定的。
例如,铁可以形成+2和+3的氧化态,铜可以形成+1和+2的氧化态。
•良好的催化作用:D区元素常常具有良好的催化作用,能够加速化学反应的速度。
这是由于其d电子可以提供额外的反应中心。
•磁性:D区元素通常具有磁性,这是由于其d电子的自旋和轨道角动量相互作用导致的。
铁、镍和钴是常见的具有磁性的D区元素。
3. D区元素的应用D区元素由于其特殊的性质,被广泛应用于各个领域。
以下是D区元素在不同领域中的主要应用:3.1 冶金工业•钢铁生产:铁是冶金工业中最重要的D区元素,它被用于制造钢铁。
由于铁具有较高的熔点和良好的硬度,使得钢铁在建筑、交通、机械等领域得到广泛应用。
•合金制备:D区元素常常与其他金属元素形成合金,以改善金属的性能。
例如,铜和锌形成的黄铜具有良好的可加工性和耐腐蚀性。
3.2 化学催化剂D区元素在化学催化剂中具有广泛应用。
催化剂是能够加速化学反应速率但不参与反应的物质。
以下是几个常见的D区元素催化剂及其应用场景:•铁催化剂:在氨基酸合成、氨合成等反应中广泛应用。
•钯催化剂:用于氢化反应、烯烃的部分氢化等。
•铂催化剂:在有机合成反应中具有广泛应用,如氢化、氧化、加成等。
3.3 电子行业•电池制造:D区元素的氧化态变化使其非常适合作为电池的正负极材料。
例如,锂作为锂离子电池的正极材料,具有高储能密度和较长的循环寿命。
•电子器件制造:D区元素在半导体领域中具有重要应用。
例如,硅是最常用的半导体材料之一,它具有稳定的半导体性能,在电子芯片和光电器件制造中得到广泛应用。
无机化学大连理工第十六章-d区元素(一)-习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
湖南理工学院无机化学习题库第16章d 区元素(一)
第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
d区金属
后果
(1) Y3+半径88pm落在Er3+88.1pm附近,Y进入稀土元素。 Sc半径接近Lu3+,常与Y3+共生,Sc也成为稀土元素。 (2) Zr与Hf、Nb与Ta、Mo与W三对元素半径十分接近、化 学性质十分相近,常伴生在一起,难以分离。 Zr(IV) Nb(V) Mo(VI)
80pm
Hf(IV) 79pm
度大,是宇航、航海、化工设备等的
理想材料。
• 强度好: Al的2-3倍,Mg的5倍 耐热合金用于飞机发动机 • 刚性大 : 约为钢的一半,比AlMg大 钛能与骨骼肌肉生长在一 • 质轻: 4.54g/ml钢的一半 起,称为“生物金属”。 时 间 强度/重量比: 1957 1968 1948 1952 金属中最大 1978 1990 2000 • • 抗腐蚀: 960 2000 钛关节 104005 21000 420000 年产量/T 3 与不锈钢相同,对海水与铂同 45053
所以第五和第六周期的同副族 元素及其化合物,性质相似, 结构相似,以致给分离工作带 来了困难。
ý É ª Ø Ó ë ¶ ¹ ¶ Ô Ë Ô ×°¾ 200 190 180 170 160 150 140 130 120 110 100 20 30
六
五 四
同 族 从 上 到 下 原 子 半 径 略 增 加
Cr -0.90 稀 HCl H2 SO4 Cu +0.339 HNO3 , 浓 热 H2 SO4
Mn -1.18 稀 HCl H2 SO4 等 Zn -0.762 稀 HCl H2 SO4 等
可溶该 金属的 酸 元素
各种酸 Fe -0.409 稀 HCl H2 SO4 等
M
2
d,f区元素
12.1.1 d区元素的特殊性
d区元素显示出许多区别于主族元素的性质:
• 熔沸点高、硬度密度大的金属大都集中在这一区 • 同一周期从左到右,元素化学性质的变化远不如s区p区
显著。
• 不少元素形成有颜色的化合物 • 许多元素形成多种氧化态从而导致丰富的氧化还原行为 • 形成配合物的能力比较强 ,参与工业催化过程和酶催
化过程的能力强
12.2 钒
• 钒的价电子层结构为3d34s2,5个电子都有成键作用,所以 • 在酸性介质中,钒的元素电势图为
A / V
VO2+ 主要氧化态为+5,但也存在+4,+3,+2。
-0.25 -1.2 1.0 VO2+ 0.36 V3+ V2+ V -0.25
所以V2+、V3+具有还原性,VO2+是稳定的,而VO2+具有氧化 性。 不同的氧化态的钒具有不同的颜色。例如: VO2+(黄色)可 被Fe2+、H2C2O4等还原为VO2+(蓝色)
[Cr(H2O)6]Cl3 紫色
[Cr(H2O)5Cl]Cl2· H2O 浅绿 [Cr(H2O)4Cl2]Cl· 2H2O 深绿
2. Cr(VI)的化合物
Cr(VI)的化合物通常是由自然界存在的铬铁矿Fe(CrO2)2,
借助于碱熔法制得的,即把铬铁矿和Na2CO3混合,并在空 气中煅烧。用水浸取煅烧后的熔体,Na2CrO4进入水中,浓 缩,得黄色晶体Na2CrO4;酸化得红色晶体。 4Fe(CrO2)2 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
电子分别填充在3d 亚层4d 亚层和5d 亚层上.
第十四章 d区元素
2 铬(Ⅵ)的化合物
(1) 三氧化铬CrO3: 俗名铬酐,它对热不稳定,强氧化剂。 K2Cr2O7 + H2SO4(浓) = K2SO4 + 2CrO3 + H2O
(橙红色)
CrO3 + H2O = H2CrO4 (黄色) 4CrO3 = 2Cr2O3 + 3O2
△
CrO3 + 2NaOH = Na2CrO4 (黄色) + H2O
3d14s2
钛 (Ti)
3d24s2
钒 (V)
3d34s2
铬 (Cr)
3d54s1
锰 (Mn)
3d54s2
铁 (Fe)
3d64s2
钴 (Co)
3d74s2
镍 (Ni)
3d84s2
大→小 6.54 1.20 6.82 1.32 -1.63 6.74 1.45 -1.18 6.77 1.56 -0.91 7.44 1.60 -1.18 7.87 1.64 -0.44 7.86 1.70 -0.28 7.64 1.75 -0.25
△
2FeSO4 = Fe2O3 + SO2 + SO3
△
4FeSO4 + 2H2O + O2 = 4Fe(OH)SO4(黄褐色)
b 莫尔盐 (NH4)2SO4.FeSO4.6H2O 比FeSO4稳定,易保存,是常用的还原剂。 MnO4- + 5Fe2+ + 8H+ Mn2+ + 5Fe3+ + 4H2O
二 d 区元素的化合物 (一) 铬(Cr)的化合物
Cr 3d54s1 常见氧化态:+2,+3(最稳定),+6 1 铬(Ⅲ)的化合物 (1) 氢氧化铬 Cr(OH)3难溶于水,具有两性。 Cr(OH)3 + 3H+ Cr3+ + 3H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
KCl,浓H2SO4
K2Cr2O7
浓H2SO4, SO2 浓HCl
KCr(SO4)2· 2O(铬钾矾) 12H
CrCl3· 2O H
(暗红色,针状)
K2Cr2O7 + H2SO 4 (浓) K2SO 4 + 2CrO3 (s) + H2O
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化 •H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
②不稳定性
(见光)遇酸
4MnO + 4H (微酸) 4MnO2 + 3O2 + 2H2O
4 +
浓碱 24MnO4 + 4OH 4MnO4 + O2 + 2H2O 加热 2KMnO4 220CK2MnO4 + MnO2 (s) + O2
锰(Ⅵ)的化合物 K2MnO4暗绿色晶体,在强碱性溶液存在。 在酸性、中性溶液中歧化
24
(4) K2Cr2O7的氧化性
2 + 3SO3 - + 8H+ Cr2 O 27
+ 2Cr3+ + 4H2 O 3SO 3S + 2Cr + 7H2 O
3+
24
Cr2 O + 3H2S + 8H
27
27
+
+ 6Fe2 + + 14H+ Cr2 O
K 2 Cr2 O7 (s) + 14HCl(浓)
3MnO2- + 4H+ MnO2 + 2MnO- + 2H2 O 4 4 3MnO + 2CO2 MnO2 + 2MnO + 2CO
24 4 23
锰(Ⅳ)的化合物:MnO2 •强氧化剂 E (MnO2 /Mn ) = 1.229V
A 2+
MnO2 + 4HCl(浓) Cl 2 + MnCl2 + 2H2 O 2MnO2 + 2H 2SO 4 (浓) 2MnSO 4 + O 2 + 2H2 O
24
4 27 3+
3+
28
Ag
+
+ 2Cr O7 + SO2 + 14H 2 4
E (CrO / Cr(OH) ) = -0.12V 碱性条件: 4
+ 3H2 O2 + 2OH2Cr(OH)
2CrO + 8H2 O
24
碱性条件下易被氧化。
Cr + Zn(s) + Zn2+ 2Cr ( 蓝色 )
Cr2+(aq) Cr3+(aq)
+ 2Cr3+ + 7H2 O 6Fe
3Cl2 + 2CrCl3 + 2KCl + 7H2 O
3+
铬(Ⅲ)的化合物 Cr2O3 △ Δ 制备:4Cr + 3O2 2Cr2O3
(NH4 ) 2 Cr2O7 Cr2O3 + N 2 + 4H2O
性质:Cr2O3 + 6H Cr + 3H2O
鉴定Mn2+常用NaBiO3,介质用HNO3
3Mn + 2MnO + 2H 2 O 5MnO2 + 4H
2+ 4 +
(深肉色) MnS nH2 O
H+ 或 (NH4 ) 2 S HAc小ຫໍສະໝຸດ :(白色) Mn(OH)2
O2
(H ) (H ) 2 NaBiO3 SO 3 - , X -
Mn (肉色)+ +
HCr2 O 7 2 H + + Cr2 O 7 -
K a2 = 0.85
K a1 = 9.55 K a2 = 3.2×10-7
H 2 CrO4 HCrO
4
H + HCrO H + CrO
+ 24
+
4
•pH的影响
2+ 2H+ 2CrO 2HCrO4 Cr2 O7 + H2 O (黄) (橙) pH<2:Cr2O72-为主,pH>6:CrO42-为主。
28
2+
OH , O 2
HCl(浓), H 2SO 4 (浓)
-
MnO2 (黑褐)
S2 O
H 2 S, H 2 O 2 Fe 2+ Sn
2+
P bO2 H 5 IO6
KClO3 + KOH OH-(浓)+SO32H+或CO2 (歧化)
H+
或
CO2
(歧化)
MnO-4 紫色
MnO24 暗绿
§4 铁 钴 镍
2Fe 2 O3 + 8Na 2 CrO4 + 8CO2
② 2Na 2 CrO4 + H 2SO 4
Na 2 Cr2 O7 + Na 2SO 4 +H 2 O
(2) 以K2Cr2O7为原料制备其他含铬化合物
浓H2SO4
CrO3(铬酐) 冷却 (NH4)2Cr2O7 CrO2Cl2(氯化铬酰)
NH3
橙红色 绿色
975
398 2330
CrCl3· 2O 6H
紫色
83
89
失去结晶水
失去结晶水
KCr(SO4)2· 2O 暗紫色 12H
水溶液中铬的各种离子
Cr2+(aq)
颜色
存在的pH <2 >6 酸性 强碱
Cr3+(aq)
Cr2O
27
橙红
黄 CrO Cr3+(aq) 紫
24
Cr(OH) 亮绿
4
Cr2+(aq) 蓝
2Cr2O7(橙红)
OH H+ Ag2CrO4(s,砖红) BaCrO4(s,柠檬黄) PbCrO4(s,黄)
H2 O2 H+ 乙醚 Ag+ Ba2+ CrO(O2)2 Pb2+ (蓝)
Ag+ Ba2+ Pb2+
§3 锰
② △ 530℃
MnO2 xH2O(软锰矿) KClO3 ①
H2
KOH
H2 Mn3 O 4 MnO
H+ H+ Fe2+
Cr2O3(s,绿) △
△
Cr2+
(NH4)2Cr2O7(橙黄) OH Cr(OH)4(亮绿) H2O2 Cl2 Br2 ClO2CrO4(黄)
O2 Zn 氨水或适量OH 3+
Cr
过量OH Cr(OH)3 H+ (灰绿)
S2O2- SO2- H2S 8 3, I -(Cl-)
Sn2+,
Ⅷ族 Fe Ru Os Co Rh Ir Ni Pd Pt 铁系
铂系
铁系元素的相关矿物: •赤铁矿:Fe2O3;磁铁矿:Fe3O4; •菱铁矿:FeCO3;黄铁矿:FeS2;
•辉钴矿:CoAsS;
•镍黄铁矿:NiS· FeS;
铁、钴、镍的单质
1. 与稀酸反应 + 2+ M + 2H (稀) M (aq) + H2
H+
H 2O2 2 2CrO(O2 ) 2 Cr2 O 7 戊醇(乙醚)
蓝色
Cr2O + 4H2O2 + 2H 2CrO(O )2 + 5H2O 2
乙醚 CrO(O 2 ) 2 CrO(O 2 ) 2 (C 2 H 5 ) 2 O
27
+
小结:
H
+Cr
O2,△
+
△ Δ
△
3+
3H2O + Cr2O3 + 2OH- Cr(OH)4 Cr(OH)3 (适量)OH- (灰绿) OH - (亮绿色) Cr 3+ Cr(OH)4 Cr(OH)3 (s) + + H H ∆ H2O + Cr2O3 (绿)
Cr(Ⅲ)的还原性与氧化性
酸性条件:E (Cr O / Cr ) = 1.33V 2 2Cr + 3S2O + 7 H2 O
酸性
铬(Ⅵ)的化合物 (1) Cr(Ⅵ) 化合物的制备:碱熔法 Fe(CrO2)2(s) Na2CO3 (s) Na2CrO4(aq)
1000 ~1300℃
①
Na2CrO4(s) Fe2O3 (s)
KCl
H2O 浸取
H2SO4 酸化 ②
Na2Cr2O7 (aq)
Na2Cr2O7 K2Cr2O7
① 4Fe(CrO2 ) 2 + 8Na 2 CO3 + 7O 2
2+ 3+
Cr(Ⅲ)的配位性 配位数为6,Cr3+采用d2sp3杂化轨道成键。 如:水合异构体
[Cr(H2O)]Cl3 6 紫色
[CrCl(H2O)]Cl 2 H 2O 5 蓝绿色
[CrCl2 (H2O)]Cl 2H 2O 4 绿色
Cr(Ⅲ), Cr(Ⅵ)的鉴定
Cr
3+
H 2O2 OH 2 Cr(OH)4 CrO4
2+
+ 2OH Mn(OH) 2 (s,白)
-
无O2
2Mn(OH) + O2 2MnO(OH) (s, 棕黄色) 2 2
Mn(OH) Mn2O3 xH2O MnO2 yH2O 2
