元素周期表中的放射性元素
元素周期表中的放射性元素

元素周期表中的放射性元素元素周期表是化学中极为重要的基础性工具,其呈现了元素的种类、性质和周期规律。
其中,放射性元素是周期表中的一类极其重要的元素,它们可以分为天然放射性元素和人造放射性元素两类,它们的性质和用途极为广泛。
首先,我们来看天然放射性元素,它们的存在可以追溯到宇宙诞生的时期。
原始恒星在爆炸之后会释放大量的中子,这些中子会与原子核结合形成半衰期比较长的天然放射性核素。
地球表面的天然放射性元素主要包括铀、钍、钾等元素。
其中,铀的同位素U-238的半衰期是45亿年左右。
钍的同位素Th-232的半衰期更长,可达140亿年。
钾的同位素K-40同样具有放射性,它的半衰期为13.6亿年。
天然放射性元素的存在对地球内部热量的形成和地壳岩石的形成都有极大的影响。
天然放射性元素的放射性活动会导致不良的辐射损害,如放射性污染。
然而,天然放射性元素同样能应用于医学、地质等领域。
例如放射性碳(C-14)常被用于测定化石的年龄,铀、钍和铀-铅等放射性元素常被用于测量岩石年龄和矿物组成。
接下来,我们来看人造放射性元素。
人造放射性元素从根本上说是人工产生的放射性核素,其大多源自于核反应堆或其他核设施中。
人造放射性元素的特点是半衰期往往较短,而半衰期长短决定了人造放射性元素的放射性活动。
人造放射性元素的应用范围非常广泛,例如在医学上可以用于诊断和治疗癌症、心血管疾病等疾病。
同时,它们还可以用于射线消毒、杀菌等领域。
然而,人造放射性元素同样可以对人类和环境带来灾难性后果,如福岛核事故等核污染事件。
总而言之,放射性元素是元素周期表中的一类重要元素,在能源、医疗、科学和工业等多个领域都有着广泛的应用和重要意义。
虽然它们的存在可能会对人类和环境带来负面影响,但是科学合理利用放射性元素,对于进一步推动人类文明的进步,仍然是非常必要的。
元素周期表中的放射性元素

元素周期表中的放射性元素元素周期表是化学领域中一张至关重要的表格,它将元素按照原子序数、元素符号和原子量等属性进行了整理与归类。
其中,放射性元素是周期表中一类特殊的元素,具有放射性衰变的特性。
本文将介绍元素周期表中的放射性元素的性质、应用以及其对环境和人类的影响。
一、放射性元素的定义和分类放射性元素是指具有不稳定原子核,能够自发地通过衰变释放放射线的元素。
根据放射性衰变方式的不同,放射性元素可以分为三类:α衰变、β衰变和γ射线。
1. α衰变:在α衰变中,放射性元素的原子核释放出α粒子(由两个质子和两个中子组成)。
这种衰变会导致原子序数减2,而原子量减4。
常见的放射性元素如镭(Ra)和铀(U)就属于α衰变系列。
2. β衰变:β衰变分为β-衰变和β+衰变两类。
β-衰变时,放射性元素的原子核从一个中子转变为一个质子,并释放出一个电子和一个反中微子。
β+衰变则相反,原子核中的一个质子转变为一个中子,释放出一个正电子和一个中微子。
这种衰变会导致原子序数增加或减少1。
例如,碳-14(C-14)和钴-60(Co-60)是常见的β衰变放射性元素。
3. γ射线:γ射线是高能电磁波,不带任何电荷或质量。
放射性元素衰变产生的高能激发态会通过γ射线释放能量。
γ射线不改变原子序数和原子量,只起到能量释放和原子核稳定化的作用。
二、放射性元素的性质与应用1. 放射性元素的物理性质:放射性元素具有较高的原子质量和较长的半衰期。
半衰期是指元素的原子核数目减半所需要的时间。
放射性元素的半衰期与其衰变方式和能级有关,范围从纳秒到亿年不等。
2. 放射性元素的化学性质:放射性元素的化学性质与其非放射性同位素相似,所以在化学反应中表现出了相似的特性。
它们可以形成化合物,并参与各种化学过程。
3. 医学应用:放射性同位素在医学领域有着广泛的应用。
例如,放射性同位素碘-131(I-131)可以用于治疗甲状腺疾病和甲状腺恶性肿瘤。
其他放射性同位素如锶-89(Sr-89)和钇-90(Y-90)可以用于骨癌治疗。
钚

钋polonium元素符号Po,放射性元素,原子序数84,210Po是半衰期最长的天然同位素,238U放射系的一员,在元素周期表中属ⅥA族。
复杂立方晶体,常见化合价为+2、+4、+6和-2。
钋是1898年居里夫人从铀矿残渣中发现的,并以她的祖国Polonia(波兰)命名。
金属钋比同族元素碲有更强的金属性,熔点254℃,沸点962℃,密度9.32克/厘米3。
物理性质与铊、铅、铋相似,化学性质与碲相似。
铀矿石中每一吨铀只含钋约100微克,因此由铀矿、镭或其衰变产品只能得到痕量的钋。
毫克量的钋可用中子辐照铋制得。
分离痕量钋使用溶剂萃取或离子交换法,但用辐照铋分离钋,则不能使用有机物,必须用碲载带法或铅(铋、银)置换法。
钋是一种强α射线源,210Po与铍混合可制得中子源。
210Po用作人造卫星的能源。
一种化学元素。
化学符号Po ,原子序数84 ,属周期系ⅥA族,是天然放射性元素,半衰期最长的同位素是钋209 。
1898年M.居里和P.居里在处理沥青铀矿时发现钋,为纪念M.居里的祖国波兰(Poland),命名为polonium 。
钋在地壳中的含量为3×10-14%,在达到放射性平衡的矿石中,钋与铀的重量比为7.6×10-11∶1 ,每吨铀矿中约含100微克钋。
已发现钋同位素的质量数为192~218。
、钋是银白色金属,熔点254℃ ,沸点962℃ ,低温时为简单立方晶格( a 型),36℃时转变为简单菱形体晶格(β型)。
β型钋的密度为9.4克/厘米3 ,250℃时钋与氧作用,生成二氧化钋。
钋还可与氢发生反应,形成钋化氢(H2Po)。
钋也容易和酸作用。
钋的氧化态为-2、+2、+4、+6,以+4价的化合物最稳定。
从铀矿中提取钋,先用盐酸处理提铀后的铀矿残余物,然后用硫化氢处理,铋和钋的硫化物同时沉淀,再用分级沉淀法分离,钋富集在溶液中,用银置换,便得到金属钋。
钋210 的比活度高,产生的 a 射线与轻元素作用能产生中子,钋210可制成不同能量、体积小而中子强度高的中子源。
元素周期表中的稀有元素与放射性元素

元素周期表中的稀有元素与放射性元素元素周期表是化学领域中的一张重要图表,它将所有已知的化学元素按照原子序数和化学性质进行了分类和排列。
在这张表中,我们可以看到一些特殊的元素,如稀有元素和放射性元素。
本文将探讨这些元素的特性和应用。
稀有元素是指元素周期表中的18号族元素,也被称为稀有气体。
这些元素包括氦、氖、氩、氪、氙和氡。
它们在自然界中以单质的形式存在,具有稳定的电子结构和低反应性。
稀有气体在工业和科学领域有着广泛的应用。
例如,氦广泛用于气球和激光技术中,氖被用于霓虹灯和激光器,氩被用于气体保护焊和充电灯,氪和氙则被用于光学薄膜和激光器。
此外,稀有气体还被用于气象学研究、核磁共振成像和医学诊断。
除了稀有元素,元素周期表中还有一些放射性元素。
放射性元素是指具有放射性衰变性质的元素,它们的原子核不稳定,会自发地发射出粒子或电磁辐射以达到更稳定的状态。
放射性元素包括镭、铀、钚等。
放射性元素的放射性衰变可以用于放射治疗和核能发电。
例如,镭曾被用于治疗癌症,铀被用于核武器和核电站,钚则被用于核燃料和核爆炸装置。
然而,放射性元素也带来了一定的危险性。
放射性辐射对人体和环境都具有一定的伤害。
因此,在使用和处理放射性元素时,必须采取严格的安全措施。
核电站和核设施需要严格的安全监管,以防止辐射泄漏和核事故发生。
此外,核废料的处理和储存也是一个全球性的难题,需要找到安全可靠的方法来处理这些高放射性废料。
除了稀有元素和放射性元素,元素周期表中还有其他许多有趣的元素。
例如,金属铁是地球上最常见的元素之一,它在建筑、制造和能源领域有着广泛的应用。
碳是生命的基础,它存在于有机物中,如葡萄糖、脂肪和蛋白质。
硅是半导体材料,被广泛应用于电子器件和太阳能电池。
元素周期表中的每一个元素都有其独特的性质和应用。
通过研究这些元素,我们可以更好地理解物质的本质和化学反应的规律。
同时,我们也需要认识到元素的应用是需要谨慎和负责任的,特别是对于稀有元素和放射性元素。
元素周期表中的放射性元素

元素周期表中的放射性元素放射性元素是指具有不稳定原子核的元素,它们能够自发地放射出粒子或电磁辐射,通过放射性衰变逐渐转变为稳定的同位素。
在元素周期表中,放射性元素主要分布在镭(Ra)元素及其之后的区域,包括镭元素本身以及钍(Th)、铀(U)、镎(Np)等元素。
本文将对这些放射性元素的特性及应用进行探讨。
一、镭(Ra)镭是放射性元素中非常重要的一种,它的原子序数为88,化学符号为Ra。
镭是一种银白色且有金属光泽的元素,具有放射性。
它的最稳定同位素为铀系列衰变链产物钍-234,其半衰期为245,500年。
由于镭具有较强的放射性,因此在工业和医疗领域被广泛应用。
镭放射线可以用于治疗癌症、灭菌和检测金属的裂纹,但同时也要注意对镭的合理使用,以避免产生不良影响。
二、钍(Th)钍是元素周期表中的一种放射性元素,原子序数为90,化学符号为Th。
钍是一种银白色的金属元素,具有放射性。
它的最稳定同位素是钍-232,其半衰期超过140亿年。
钍具有较高的密度和熔点,因此在核反应堆和用于制备光学玻璃的钍掺杂铌酸锂晶体等领域有广泛应用。
此外,钍还可用于生产核武器和核燃料。
三、铀(U)铀是元素周期表中的重要放射性元素,原子序数为92,化学符号为U。
铀是一种银灰色的金属元素,也具有放射性。
铀的最稳定同位素为铀-238,其半衰期约为45亿年。
铀广泛应用于核能领域,作为核燃料用于核反应堆的燃料棒中。
此外,铀还可以用于制造核武器、放射性同位素示踪、放射治疗等。
四、镎(Np)镎是元素周期表中的一种放射性元素,原子序数为93,化学符号为Np。
镎是一种银白色的金属元素,具有放射性。
镎的最稳定同位素是镎-237,其半衰期为2.14万年。
镎主要应用于核能产业中,包括制备核燃料、研究核反应性能等。
此外,在实验室中,镎也被用作一些物理和化学实验的研究材料。
总结:元素周期表中的放射性元素包括镭、钍、铀、镎等。
这些放射性元素在医疗、工业和核能等领域起着重要作用。
化学元素周期表(118元素)
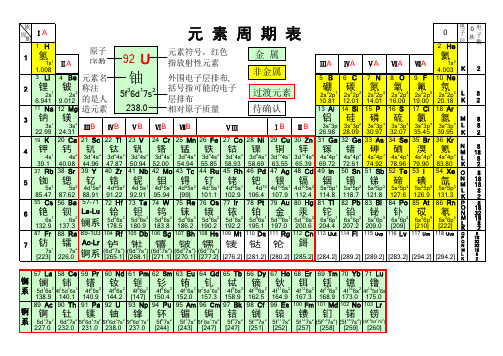
M L K
18 8 2
57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu
镧镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥
系 5d16s2 4f15d16s2 4f36s2 4f46s2 4f56s2 4f66s2 4f76s2 4f75d16s2 4f96s2 4f106s2 4f116s2 4f126s2 4f136s2 4f146s2 4f145d16s
37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe O 8
5
铷 5s1 85.47
锶 5s2 87.62
钇
4d15s2 88.91
锆
4d25s2 91.22
6s26p1 204.4
6s26p2 6s26p3 207.2 209.0
6s26p4 [209]
6s26p5 [210]
6s26p6 [222]
M L K
188 1382 8 2
钫 镭 * * * * * * * * 鎶 7
87 Fr
88 Ra 89-103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg 112 Cn 113 Uut 114 Fl
铅铋
84 Po 85 At
钋砹
86 Rn
氡
OP N
镧系 6s1
6s2
132.9 137.3
元素周期表(全面版)
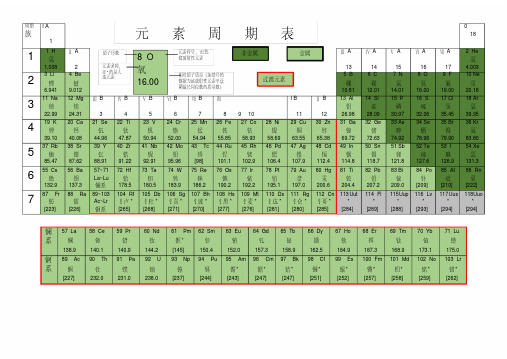
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
元素周期表中的放射性元素与稳定元素

元素周期表中的放射性元素与稳定元素元素周期表是化学领域中最基础的工具之一,它将元素按照原子序数、原子结构和元素性质进行了有序排列。
在元素周期表中,有一类元素被称为放射性元素,它们与稳定元素在原子性质上存在明显的差异。
本文将深入探讨元素周期表中的放射性元素与稳定元素的特点和应用。
一、放射性元素的特点放射性元素是指具有放射性衰变性质的元素,其原子核不稳定并能通过自发衰变释放辐射。
根据元素的放射性质,可以将放射性元素分为三种类型:α放射性、β放射性和γ放射性。
1. α放射性元素α放射性元素在放射性衰变过程中会释放出α粒子,即两个质子和两个中子组成的氦离子。
这种粒子具有较大的质量和较低的穿透能力,往往被一层纸或几厘米的空气阻挡。
常见的α放射性元素有铀(U)、钍(Th)等。
2. β放射性元素β放射性元素在放射性衰变过程中会释放出β粒子,即在原子核内一个中子转变成一个质子或一个质子转变成一个中子,释放出高速电子。
β粒子具有较小的质量和较高的穿透能力,可被金属薄片或厚木板所阻挡。
常见的β放射性元素有锶(Sr)、碘(I)等。
3. γ放射性元素γ放射性元素在放射性衰变过程中会释放出γ射线,即高能电磁辐射,具有极强的穿透能力。
γ射线可穿透金属、混凝土等物质,对人体组织有较强的穿透和杀伤能力。
常见的γ放射性元素有钴(Co)、铯(Cs)等。
二、稳定元素的特点相对于放射性元素,稳定元素的原子核相对较稳定,不会自发衰变释放出辐射。
稳定元素具有以下特点:1. 电子结构稳定稳定元素的电子结构处于较为稳定的状态,外层电子数满足八个电子规则或者稳定规则,不容易与其他原子形成化学键。
2. 不参与放射性衰变稳定元素的原子核稳定,不发生自发衰变释放辐射的过程。
三、放射性元素与稳定元素的应用放射性元素和稳定元素在生活和工业中有着广泛的应用。
1. 放射性元素的应用放射性元素在医学、工业、能源等领域具有重要应用价值。
放射性同位素可用于医学影像学、肿瘤治疗等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表中的放射性元素元素周期表是化学中非常重要的工具,它按照元素的原子序数和化学性质将元素排列整齐。
在元素周期表中,有一类元素被称为放射性元素。
本文将探讨放射性元素的特点和重要性。
放射性元素是指其原子核不稳定,会通过衰变释放出放射线以转变为其他元素的元素。
根据其衰变方式的不同,放射性元素分为三类:α放射性、β放射性和γ放射性。
首先,我们来研究α放射性。
α粒子是由两个中子和两个质子组成的高速粒子,它们在释放时可以穿透纸张和皮肤。
在元素周期表中,最早被发现的α放射性元素是氡(Rn)。
氡是稀有气体中最密集的元素,它是一种无色、无味、无臭的放射性气体,可用于放射治疗和核能研究。
此外,铀(U)和镤(Po)也是常见的α放射性元素。
接下来,我们了解β放射性元素。
β粒子是电子或正电子,通过β衰变放出。
相比α粒子,β粒子的穿透能力更强,它们可以穿过一些金属和塑料材料。
β放射性元素的例子包括碳(C)、锶(Sr)和锡(Sn)。
其中,碳-14是非常重要的放射性同位素,它被广泛应用于放射性碳测年法,用于研究古代生物和考古文物的年代。
最后,我们讨论γ放射性元素。
γ射线是高能电磁波,具有非常强的穿透能力,可以穿透人体组织和厚实的金属屏蔽。
γ射线的应用十分广泛,如医疗诊断、癌症治疗和工业无损检测。
铯(Cs)和钴(Co)是常见的γ放射性元素。
钴-60广泛用于放射疗法,对治疗癌症起到重要作用。
放射性元素具有广泛的应用和重要性。
它们在医学、能源和科学研究中发挥着重要作用。
然而,由于放射性元素具有辐射性,应用和处理时必须谨慎。
科学家们需要遵守相关安全规定,以确保人员的安全和环境的保护。
总结起来,元素周期表中的放射性元素对人类社会的发展有着重要影响。
它们的发现和应用推动了科学的进步,并在医学、能源和工业领域发挥着巨大作用。
然而,我们也要意识到放射性元素的危害性,必须遵循相关安全规定,以保护人员和环境的安全。
通过深入了解放射性元素,我们可以更好地利用它们的优点并减少潜在风险。
