2020-2021学年高二化学期末重难点专项6-化学反应的方向(原卷版)
2020-2021学年高二上学期第二次月考化学练习题 (43)(有解析)

2020-2021学年高二上学期第二次月考化学练习题 (43)一、单选题(本大题共18小题,共54.0分)1. 对于化学反应方向的确定,下列说法正确的是( )A. 放热的反应,一定能自发进行B. 加入合适催化剂,能改变某反应的△HC. 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向D. 能够自发进行的反应就一定能够发生并完成2. 下列各组金属均有导线相连,并插入稀H 2SO 4液体中,其中铁被腐蚀由快到慢的顺序是①Fe −Fe ②Cu −Fe ③Fe −Zn ( )A. ②>①>③B. ②>③>①C. ③>①>②D. ①>②>③3. 下列可设计成原电池的化学反应是 ( )A. H 2O(l)+CaO(s)=Ca(OH)2(s)B. Ba(OH)2·8H 2O +2NH 4Cl =BaCl 2+2NH 3↑+10H 2OC. 2KClO 3MnO 2̲̲̲̲̲̲̲̲▵2KCl +3O 2↑ D.4. 已知:2H 2(g)+O 2(g)=2H 2O(l)△H =−571.6kJ/mol ,下列叙述正确的是( )A. 2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJB. 2 mol H 2(g)和1 mol O 2(g)反应生成2 mol H 2O(l),吸收热量571.6 kJC. 2 mol H 2O(l)分解为2 mol H 2(g)和1 mol O 2(g),吸收热量571.6 kJD. 2 mol H 2(g)和1 mol O 2(g)反应生成2 mol H 2O(g),放出热量571.6 kJ5. 铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下: Pb(s)+PbO 2(s)+2H 2SO 4(aq)⇌放电充电2PbSO 4(s)+2H 2O(l)则下列说法 不.正确的是( ) A. 充电时,PbSO 4在两极上除去B. 放电时,电解质溶液的质量减少C. 放电时,PbSO 4只在负极生成D. 充电时,阳极的电极反应式为:PbSO 4+2H 2O −2e −= PbO 2+4H ++SO 42−6.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷与氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O.有关此电池的推断正确的是()A. 负极反应为:14H2O+7O2+28e−=28OH−B. 放电一段时间后,负极周围的 pH 升高C. 每消耗 1 mol C2H6,则电路上转移的电子数为 14 molD. 放电过程中KOH的物质的量浓度基本不变7.已知下列热化学方程式:O2(g)=H2O(g)△H1=a kJ⋅mol−1②2H2(g)+O2(g)=2H2O(g)△H2=b kJ⋅①H2(g)+12mol−1O2(g)=H2O(l)△H3=c kJ⋅mol−1④2H2(g)+O2(g)=2H2O(l)△H4=d kJ⋅③H2(g)+12mol−1下列关系式中正确的是()A. a<c<0B. b>d>0C. 2a=b<0D. 2c=d>08.LiOH和钴氧化物可用于制备锂离子电池正极材料。
高二化学化学反应的方向

星斗山,距县城七十余公里,一路上满目苍翠。农田、庭院、茶园、苗圃——大多种着等待移栽到别处的水杉幼苗。从满山的原始林中,也能时时看见水杉,更多的却是它的近亲柳杉,还有连香、 女贞、樟、楠、柏、松……
终点,是一个植物繁育园。园中全是水杉,树身上挂了牌子。我拍下存档的这一株,就明确写着:“14号无性系。原生母树编号:1909。生于桂花村猫鼻梁上段。”翻译成大白话,就是编号为1909 的原生母树,并不在此处,而是在桂花村猫鼻梁上段。利川人说话,口音与基本词汇都与四川相同,这个猫鼻梁定是指一段山脊,形状像猫的鼻梁。无性系是一个生物学的专用术语。用种子繁殖是有性 繁殖,无性繁殖就是从植株截取枝条来扦插,培养成新的植物。无性繁殖的好处是保持母本特性完全,有性繁殖则容易产生变异。利川保护水杉,是讲科学的,这个并不容易。我见过野生珍稀植物保护, 因为不讲科学而帮了倒忙的事情,而且不止一例。
足球导航网 动车时代,乘火车穿过四川盆地,穿过盆地东缘绿意盎然的群山,四个小时,利川到了。一个海拔一千多米的秀美的山间盆地。主人赛宝一般介绍当地美食、文化与风景名胜。我行期短促,迫不及
待要问水杉。水好、茶好、歌好、酒好,但我是为
第11讲化学反应的方向(原卷版)-2024年新高二化学暑假讲义+习题(人教版2019选择性必修1)

第11讲化学反应的方向1.知道化学反应是有方向的;知道化学反应的方向与反应的焓变和熵变的关系。
2.能结合具体事例说明反应自发进行的方向性。
一、自发过程和自发反应1.自发过程自然界有一些过程是自发进行的,而且是有的。
例如,水总是自发地从高处流向低处,而相反的过程却不能自发进行。
2.自发反应有些化学反应也是自发进行的,而且具有。
3.自发过程的判断(1)根据条件判断:不是看是否需要条件,而是看是否需要持续施加外力(如加热等)。
(2)根据其逆向过程是否自发判断:若逆向过程自发,则正向过程一定;若逆向过程不自发,则正向过程一定。
二、化学反应进行方向的判据1.焓变与反应的方向(1)放热反应过程中体系能量,因此具有进行的倾向,科学家提出用(能量变化)来判断反应进行的方向,这就是(能量判据)。
(2)焓变与化学反应进行方向的关系①多数放热反应是进行的。
例如燃烧反应、中和反应等。
①有些吸热反应也可以进行,如:2N2O5(g)===4NO2(g)+O2(g)ΔH=+109.8 kJ·mol-1。
结论:只用焓判据判断反应是否自发进行不全面。
2.熵变与反应的方向(1)熵、熵变的概念(2)熵值大小①体系的熵值:体系的越大,体系的熵值就。
①同一物质的熵值:S(g)>S(l)>S(s),同一条件下,不同物质的熵值不同。
(3)熵判据:体系有自发地向混乱度(即)的方向转变的倾向,因此可用来判断反应进行的方向。
(4)熵变与化学反应进行方向的关系①许多熵增的反应是的(多是气体分子数目增多的反应),如Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g);2KClO3(s)===2KCl(s)+3O2(g)①有些熵减的反应也可以进行,如:2NO(g)+2CO(g)===N2(g)+2CO2(g);4Fe(OH)2(s)+O2(g)+2H2O(l)===4Fe(OH)3(s)结论:只用熵判据判断反应是否自发不全面。
3.自由能与化学反应的方向(1)自由能符号为 ,单位为kJ·mol -1。
高二化学化学反应进行的方向试题答案及解析

高二化学化学反应进行的方向试题答案及解析1.下列说法不正确的是()A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行B.NH4HCO3(s)NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率【答案】C【解析】ΔH<0、ΔS>0,则ΔH-TΔS<0,任何温度下反应都能自发进行,A正确,B正确;用焓变和熵变判断反应的自发性,都有例外,故都不能单独作为反应自发性的判据,而应用复合判据,C错误;使用催化剂能改变反应的活化能,因此能改变化学反应进行的速率,D正确。
【考点】反应的自发性2.在溶液中,CaCl2+CO2+H2O=CaCO3↓+2HCl在任何条件下都不能发生,原因是该反应的()A.△H >0ΔS>0B.△H<0ΔS<0C.△H<0 ΔS>0D.△H >0ΔS<0【答案】A【解析】CaCl2+CO2+H2O=CaCO3↓+2HCl在任何条件下都不能发生,是因为该反应是体系是混乱程度减小的吸热反应,即△H >0 ΔS>0,ΔG=△H-TΔS>0,故选项是A。
【考点】考查反应的自发性的知识。
3.下列关于化学反应的自发性叙述中正确的是 ( )A.焓变小于0而熵变大于0的反应肯定是自发的B.焓变和熵变都小于0的反应肯定是自发的C.焓变和熵变都大于0的反应肯定是自发的D.熵变小于0而焓变大于0的反应肯定是自发的【答案】A【解析】根据ΔH-TΔS判断,当焓变小于0而熵变大于0时,ΔH-TΔS一定小于0,故反应肯定能自发进行,A正确;故选A。
【考点】反应是否能自发进行的判断依据4.下列有关说法正确的是()A.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小【答案】A【解析】A、根据△G=△H—T·△S可知,△G<0时反应自发。
人教版高中化学选修42.4化学反应进行的方向练习题word版试题含解析
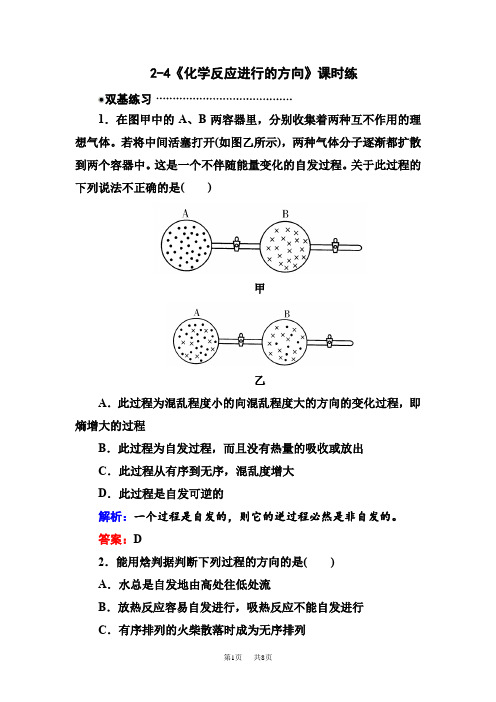
2-4《化学反应进行的方向》课时练双基练习1.在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。
若将中间活塞打开(如图乙所示),两种气体分子逐渐都扩散到两个容器中。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是()甲乙A.此过程为混乱程度小的向混乱程度大的方向的变化过程,即熵增大的过程B.此过程为自发过程,而且没有热量的吸收或放出C.此过程从有序到无序,混乱度增大D.此过程是自发可逆的解析:一个过程是自发的,则它的逆过程必然是非自发的。
答案:D2.能用焓判据判断下列过程的方向的是()A.水总是自发地由高处往低处流B.放热反应容易自发进行,吸热反应不能自发进行C.有序排列的火柴散落时成为无序排列D.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大解析:水总是自发地由高处往低处流,有趋向于最低能量状态的倾向。
有些吸热反应也可以自发进行,例如,在25℃和1.01×105Pa 时,2N2O5(g)===4NO2(g)+O2(g)ΔH=+56.7kJ/mol,(NH4)2CO3===NH4HCO3(s)+NH3(g)ΔH=+74.9kJ/mol,不难看出,上述两个反应都是吸热反应,又都是熵增加的反应,显然只根据焓变来判断反应进行的方向是不全面的。
有序排列的火柴散落时成为无序排列,有趋向于最大混乱度的倾向,属于熵判据。
扑克牌的无序排列也属于熵判据。
答案:A3.在298 K时,NaCl在水中的溶解度为26 g。
如将1 mol NaCl 溶解在1 L水中,此溶解过程中体系的ΔH-TΔS和熵如何变化() A.ΔH-TΔS>0,ΔS<0B.ΔH-TΔS<0,ΔS>0C.ΔH-TΔS>0,ΔS>0D.ΔH-TΔS<0,ΔS<0解析:NaCl(s)溶解于水中是自发进行的过程,故ΔH-TΔS<0;NaCl(s)===NaCl(aq),体系的混乱度增大,ΔS>0。
答案:B4.(潮州高二检测)水的三态的熵值的大小关系正确的是(S m表示1 mol物质的熵值)()A.S m(s)>S m(l)>S m(g) B.S m(l)>S m(s)>S m(g)C.S m(g)>S m(l)>S m(s) D.S m(s)=S m(l)=S m(g)解析:同一种物质处于气态时熵值最大,液态次之,固态时熵值最小。
2020-2021学年高二化学期末重难点专项9-滴定实验 (原卷版)

2020-2021学年高二上化学期末复习高频考点专项专项9 滴定实验复习要点1.掌握酸碱中和滴定概念和原理。
2.了解指示剂选择方法。
3.掌握中和滴定实验的操作步骤和误差分析。
核心梳理梳理点一、酸碱中和滴定1.滴定原理(1)反应实质:H ++OH -===H 2O 。
(2)定量关系:中和反应中酸提供的H +与碱提供的OH -的物质的量相等,n(H +)=n(OH -),即c(H +)·V 酸=c(OH -)·V 碱则c(H +)=c (OH -)·V 碱V 酸或c(OH -)=c (H +)·V 酸V 碱。
2.实验关键(1)准确测定参加反应酸、碱的体积。
(2)准确判断滴定终点。
3.实验用品(1)试剂:标准溶液、待测溶液、指示剂、蒸馏水。
(2)仪器:酸式滴定管,碱式滴定管、滴定管夹、铁架台、烧杯、锥形瓶。
4.滴定管 (1)构造(2)使用方法①检查仪器:使用前先检查滴定管活塞是否漏水。
②润洗仪器:在加入反应液之前,洁净的滴定管要用所要盛装的溶液润洗2~3次。
③加入反应液:分别将反应液加入到相应滴定管中,使液面位于滴定管刻度“0”以上2~3_mL处。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,然后调节滴定管液面,使其处于某一刻度,并记录读数。
5.实验操作(1)准备工作:滴定前仪器的检查、洗涤、装液。
滴定管:①查漏,②洗涤,③润洗,④装液,⑤固定,⑥排气,⑦调液面,⑧记录。
锥形瓶:①洗涤,②装液,③加指示剂。
(2)滴定操作(3)数据处理按上述操作重复2~3次,求出用去标准溶液体积的平均值,最后求得待测溶液的浓度。
6.要点分析(1)滴定管在装反应液之前,是否需要用待装液润洗?锥形瓶在装待测液前,是否需要用待测液润洗?答案:滴定管在装反应液之前,需要用待装液润洗;锥形瓶在装待测液前,不能用待测液润洗。
(2)中和滴定原理是酸的物质的量与碱的物质的量相等时,二者恰好反应吗?答案:不是。
2020年高二化学鲁科版选修4课后练习卷:2.1 化学反应的方向

化学反应的方向1.下列说法正确的是( )A.凡是放热反应都是自发的,凡是吸热反应都是非自发的B.自发反应熵一定增大,非自发反应熵一定减小或不变C.自发反应在适当条件下才能实现D.自发反应在任何条件下都能实现答案:C2.下列关于焓变与反应方向的叙述中正确的是( )A.化学反应的焓变与其反应的方向无关B.化学反应的焓变直接决定了反应的方向C.反应焓变为正值时不利于反应自发进行D.焓变为负值的反应都能自发进行答案:C3.下列对熵的理解不正确的是( )A.同种物质气态时熵值最大,固态时熵值最小B.体系越有序,熵值越小;越混乱,熵值越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25 ℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应答案:C4.在25 ℃、1.01×105 Pa下,反应2N2O5(g)4NO2(g)+O2(g) ΔH=56.7 kJ·mol-1能自发进行的合理解释是( )A.该反应是分解反应B.该反应的熵增效应大于焓变效应C.该反应是熵减反应D.该反应是放热反应答案:B5.碳铵(NH4HCO3)在室温下就能自发地分解产生氨气,下列有关说法中正确的是( ) A.碳铵分解是因为生成了易挥发的气体,使体系的熵增大B.碳铵分解是因为外界给予了能量C.碳铵分解是吸热反应,根据焓判据,不能自发分解D.碳酸盐都不稳定,都能自发分解答案:A6.以下自发反应可用焓判据来解释的是( )A.硝酸铵自发溶于水B.2N2O5(g)===4NO2(g)+O2(g)ΔH=+56.7 kJ·mol-1C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)ΔH=+74.9 kJ·mol-1D.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1答案:D7.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)===N2(g)+2CO2(g)。
2021学年度高二化学《化学反应进行的方向》习题精练(含解析)

化学反响进展的方向1.氧化性:Cl2>Br2>Fe3+>I2;复原性:I->Fe2+>Br->Cl-。
以下反响能正向自发进展的是( ) A.Br2+2Fe2+==2Fe3++2Br-B.2Fe3++2I-==2Fe2++I2C.I2+2Fe2+==2Fe3++2I-D.2Fe3++2Cl-==2Fe2++Cl2↑2.以下说法正确的选项是〔〕A.但凡放热反响都是自发的,但凡吸热反响都是非自发的B.自发反响的熵一定增大,非自发反响的熵一定减小C.常温下,反响C(s)+CO2(g)⇌2 CO(g)不能自发进展,那么该反响的△H>0D.反响2Mg(s)+CO2(g)= C(s)+2MgO(s)能自发进展,那么该反响的△H>03.在25℃、1.01×105 Pa时,反响2N2O5 (g)=4NO2 (g)+O2(g) ΔH=+57.7 kJ / mol能自发进展的原因是( ) A.是吸热反响B.是放热反响C.是熵减小的反响D.熵增效应大于能量效应4.在等温等压条件下,化学反响方向的判据为:ΔH-TΔS<0 反响能正向自发进展ΔH-TΔS=0 反响到达平衡状态ΔH-TΔS>0 反响不能自发进展设反响A==D+E ΔH-TΔS=(-4500+11T / K) J·mol-1,要防止反响发生,温度必须〔〕A.高于409 K B.低于136 K C.高于136 K而低于409 K D.低于409 K5.以下过程属于熵(S)增加的是( )A.一定条件下,水由气态变成液态B.高温高压条件下使石墨转变成金刚石C.4NO2(g)+O2(g)一定条件2N2O5(g)D.CaCO3(s) 高温CaO(s)+ CO2(g)6.以下关于冰融化为水的过程判断正确的选项是( )A.ΔH>0,ΔS<0 B.ΔH<0,ΔS>0C.ΔH>0,ΔS>0 D.ΔH<0,ΔS<07.以下说法中正确的选项是( )A.能自发进展的反响一定能迅速发生B.非自发进展的反响一定不可能发生C.能自发进展的反响实际可能没有发生D.常温下,2H2O 通电2H2↑+O2↑,即常温下水的分解反响是自发反响8.碳酸铵(NH4)2CO3在室温下就能自发地分解产生氨气,对其说法正确的选项是( ) A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大B.碳酸铵分解是因为外界给予了能量C.碳酸铵分解是吸热反响,根据能量判据不能自进展D.碳酸盐都不稳定,都能自发分解9.以下说法正确的选项是( )A.自发反响都是放热反响B.自发反响都是熵增大的反响C.自发反响一定能实现D.非自发反响在一定条件下也能实现10.以下过程的熵变的判断不正确的选项是( )A.溶解少量食盐于水中:ΔS>0B.碳和氧气反响生成CO (g):ΔS>0C.水蒸气变成液态水:ΔS>0D.CaCO3 (s)加热分解为CaO (s)和CO2 (g):ΔS>011.判断以下反响的熵值的变化,在每题后面的横线上填上“增大〞、“减小〞或“无明显变化〞。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021学年高二上化学期末复习高频考点专项
专项6 化学反应的方向
复习要点
1.了解自发过程和化学反应的自发性。
2.通过“有序”和“无序”的对比,理解熵和熵变的概念。
3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和熵变判断化学反应的方向。
核心梳理
梳理点一、自发反应与自发过程
1.自发过程与自发反应
2.自发过程的特点
(1)体系趋向于从高能状态转变为低能状态。
(2)体系趋向于从有序体系转变为无序体系。
【例1】下列说法正确的是( )
A.食物在常温下腐败是自发进行B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应D.原电池的反应是属于不是自发反应
【练习1】下列说法正确的是()
A.所有的化学反应都有能量变化
B.核能作为一种反应热,是理想的新能源
C.所有的放热反应都可以在常温常压下自发进行
D.需要加热的反应一定是吸热反应
梳理点二、化学反应进行方向的判断
1.焓判据
有些吸热反应也能自发进行,如2N2O5(g)===4NO2(g)+O2(g)ΔH>0,能自发进行。
2.熵判据
(1)熵:科学家用来量度体系混乱程度的物理量,用S表示。
(2)熵变:ΔS=S(生成物)-S(反应物)
(3)熵增原理:在与外界隔离的体系中,自发过程将导致体系的熵增大,即熵变大于零。
(4)熵判据:体系有自发地向熵增的方向转变的倾向,熵变是影响反应自发进行的一个因素,但不是惟一因素。
(5)熵变对化学反应方向的影响。
①熵增加的反应在一定条件下都可自发进行。
如2H2O2(aq)===2H2O(l)+O2(g)在常温下能自发进行。
①有些熵减小的反应也能自发进行。
如NH3(g)+HCl(g)===NH4Cl(s)。
3.复合判据
ΔG=ΔH-TΔS<0反应能自发进行;ΔG=ΔH-TΔS=0反应达到平衡状态;ΔG=ΔH-
TΔS
>0反应不能
自发进行。
温度与反应方向关系:
【例2】下列说法中正确的是( )
A.生成物的总能量大于反应物的总能量时,ΔH<0
B.已知反应H2(g)+I2(g)①2HI(g)的平衡常数为K,则2H2(g)+2I2(g)①4HI(g)的平衡常数为2K C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.反应NH3(g)+HCl(g)=NH4Cl(s)在低温下能自发进行,说明该反应的ΔH>0
【练习2】下列说法中错误的是()
A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的①H<0
B.加入合适的催化剂能降低反应活化能,从而改变反应的焓变
C.若①H<0,①S>0,化学反应在任何温度下都能自发进行
D.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的①H>0
变式强化
1.已知自由能①G=①H-T①S<0 时,反应自发进行。
将水蒸气通过红热的炭即可产生水煤气。
反应为:
C(s)+H2O(g)CO(g)+H2(g) ①H=+131.3kJ/mol,①S=+133.7J/(K·mol)。
下列说法正确的是()A.常温下不能自发进行B.常温下能自发进行
C.100①下能自发进行D.任何温度下都不能自发进行
2.下列说法正确的是
A.放热或熵减小均有利于反应的正向自发进行
B.ΔH>0,ΔS<0的反应在任何温度下均能正向自发进行
C.2H2O2(aq)==2H2O(l)+O2(g) ΔH=-189.3 kJ· mol−1,任何温度下均可正向自发进行
D.向水中加入NH4NO3固体,溶液温度降低,可说明铵盐水解是吸热的
3.一定温度和压强下,当①H-T①S<0时,反应能自发进行。
下列反应①H>0,①S>0的是()A.HCl(g)+NH3(g)=NH4Cl(s)
B.高温下能自发进行的反应:2N2O5(g)=4NO2(g)+O2(g)
C.2H2(g)+O2(g)=2H2O(l)
D.任何温度下均能自发进行的反应:COCl2(g)=CO(g)+Cl2(g)
4.某化学反应其ΔH=-125kJ·mol-1,ΔS=-8kJ·mol-1·K-1则此反应在下列哪种情况下可自发进行()A.仅在低温下自发进行B.仅在高温下自发进行
C.在任何温度下都不能自发进行D.在任何温度下都能自发进行
5.(1)对于化学反应CaCO 3(s)CaO(s)+CO2(g),ΔH(298K)=+178.2kJ⋅mol−1,ΔS(298K)=⁄,常温下该反应__________(填“能”或“不能”)自发进行,CaCO3分解反应要自发进行,温度+169.6J(mol⋅K)
T应高于__________K。
(2)对于反应2NO(g)+2CO(g) ① N2(g)+2CO2(g),在298K、101kPa下,ΔH=−113.0kJ⋅mol−1,ΔS=⁄,反应在常温下__________(填“能”或“不能”)自发进行。
−145.3J(mol⋅K)
6.工业上用赤铁矿生产铁,可以选择的还原剂有C和H2,根据所学的知识判断:
已知:Fe2O3(s)+3/2C(s)=2Fe(s)+3/2CO2(g) ΔH=+233.8kJ/mol ΔS=279J/(K∙mol)
Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g) ΔH=+98kJ/mol ΔS=144.2J/(K∙mol)
问:那一种还原剂可使反应自发进行的温度低?________(要求计算过程)(保留三位有效数字)。
