炔烃
4炔烃

炔烃1.炔烃:为分子中含有碳碳三键的碳氢化合物的总称,其官能团为碳-碳三键(C≡C),分子通式为CnH2n-2,是一种不饱合的碳氢化合物。
2.炔烃物理性质炔烃的熔沸点低,密度小,难溶于水,易溶于有机溶剂。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些.不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。
炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。
工业中乙炔被用来做焊接时的原料。
在正炔烃的同系列中,C2~C4的炔烃是气体,C5~C15的是液体,C15以上的是固体。
炔烃的熔点和沸点也随着碳原子数目的增加而增高。
(注:乙炔不纯时,含有H2S,PH3杂质气体,有臭味)3炔烃化学性质炔烃的化学活性比烯烃弱。
炔烃的官能团是--C≡C--,其化学性质与烯烃有不少相似之处,例如能发生加成、氧化和聚和反应等。
(1)氧化反应炔烃能使高锰酸钾和浓溴水褪色(2)加成反应①加氢:R-C≡C-R'+2H2→RCH2CH2R'CH3≡CCH3+H2→CH3-CH=CH-CH3(顺式)CH3≡CCH3+Na+NH3(l)→CH3-CH=CH-CH3(反式)②加卤素:R-C≡CH可生成相应的卤代烯和卤代烷③加卤化氢:R-C≡CH+HX→R-CX=CH2R-CX=CH2+HX→R-CX2-CH3(3)聚合反应炔会发生聚合反应:炔会发合成苯:3HC≡CH→(苯环)4.乙炔:俗称风煤、电石气,最简单的炔烃,是炔烃化合物系列中体积最小的一员,主要作工业用途,特别是烧焊金属方面。
乙炔在室温下是一种无色、极易燃的气体。
纯乙炔是无臭的,但工业用乙炔由于含有硫化氢、磷化氢等杂质,而有一股大蒜的气味。
分子式CH≡CH,化学式C2H2,电子式:H:C:::C:H ,C-C键中间是六个点,分两列,每列三个—H:C:::C:H ,分子空间构型为直线型非极性分子。
5.乙炔的物理性质纯乙炔为无色无味的易燃、有毒气体。
炔烃

炔烃(CnH2n-2)
一、炔烃的分子结构 ( 以乙炔为例 )
碳的杂化:
杂化 2s 2p sp 2p
sp3
sp2
sp
H
C
C
H
sp杂化的碳原子含有较多的S成分 (50%),电负性较sp2、sp3强。
二、异构和命名 *异构 :
官能团异构、碳链异构、位置异构。
*命名:
原则与烯烃相同,但分子中同时含叁键和双键时:
1、结构(以 CH2=CH - CH=CH2 为例)
H H
———
C
C H
H
———
———
C
C
H H
H H
———
形成大π键 ↓ π 电子离域 ↓
H H
0.135 C CH
0.135 CH C 0.148
键长趋于平均化
↓ 共轭体系
2、共轭效应
在1,3-丁二烯中四个p轨道相邻且平行,
互相交盖,π电子不再局限于两个碳原子之 间运动,而离域到整个体系,使键长平均化, 内能降低,这样产生的效应叫
碳相连的氢容易给出而具有酸性。
1、金属炔化物的生成
CH CH + Ag(NH3)2NO3 AgC CAg↓
CHBiblioteka CH +Cu(NH3)2 Cl
CuC
CCu ↓
Na CH CH NH3(l) CH CNa
Na NaC
190~220℃
CNa
注意:
H R R C C C C C C H H R AgC RC CAg CAg
CO2 + H2O
RC
CH
RCOOH + CO2 + H2O
炔烃

(S)-7-甲基环辛烯-3-炔 (S)-7-methylcycloocten-3-yne
4,8-壬二烯-1-炔
4,8-nonadien-1-yne
6.2
炔烃的结构
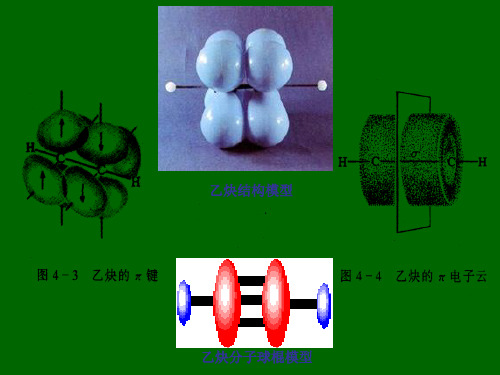
炔烃的结构特征是分子中含有“ C≡C ”,它与 “ C=C ”一样是由键和键构成,下面以乙炔为 例说明叁键的形成及结构,乙炔为一直线型分子, 全部四个原子在同一直线上,在乙炔分子中 0.1061nm
R
X2
R
C
CH
Cl2
X2
R
CHCl2
C X
CH X CHCl2
HC
CH
黑暗
CHCl
CHCl
黑暗
这一反应如在光照的情况下,反应剧烈并爆炸。 所以盛乙炔气、氯气的钢瓶要分开存放,以确保 安全。炔烃和溴也可以发生类似反应,反应现象 为Br2的红棕色褪去,故可用于炔烃的鉴别。
炔烃 26
有机化学
加 X2
HC
C2H5NH2
蓝色溶液
*2 反应体系不能有水,因为钠与水会发生反应。
*3 与制NaNH2的区别 Na + NH3 (液)
Fe3+
NaNH2
炔烃的加氢和还原
H2/Ni, or Pd, or Pt H2/ Pd-CaCO3 or Pd-BaSO4 orNiB
RCH2CH2R’
R H R H
C C
C C
R' (>90%) H R' H
R-CC-R’
硼氢化
RCOOH ~0oC
R H R H
C C
H R' H R'
(90%)
Na, NH3
(82%)
炔烃的课件

HgSO4 CH (CH ) C CH CH3(CH2)5C CH + HOH 3 2 5 3 H2SO4 O
加水反应方程式的意义: 加水反应方程式的意义:
①烯醇式结构是不稳定结构,不能稳定存在; 烯醇式结构是不稳定结构,不能稳定存在; ②有机化学反应中存在分子结构的重排现象; 有机化学反应中存在分子结构的重排现象; ③炔烃加水产物的写法---乙炔加水生成乙醛。 炔烃加水产物的写法---乙炔加水生成乙醛。 ---乙炔加水生成乙醛
CH3(CH2)3C 过氧化物 Br CH3(CH2)3CH CH2 CHBr HBr HBr 过氧化物 CH3(CH2)3CBr2CH3 CH3(CH2)3CH2CHBr2
CH3(CH2)3C
CH
ቤተ መጻሕፍቲ ባይዱ
HBr
炔烃与HX作用,在一定的条件下可以停留在一分子加成阶段。 乙炔与一分子氯化氢作用生成氯乙烯,这是工业上生产氯乙烯的方法之一。
方程式的书写注意根据条件确定产物。
Ni,C2H5OH CH3CH2CH2CH3 CH 3C CCH 3 + 2H 2 25 C,5MPa
5 % Pd-BaSO4 R CH2 C C CH2 R 25℃,喹啉, 0。MPa CH2 C C CH2 R R HH
CH3 Pd-CaCO3 HC C C CHCH2CH2OH + H2
CH + NaNH 2 CH + NaNH 2
HC R C
液氨 液氨
HC R
CNa + NH3 C CNa + NH3
(2)炔氢的微弱酸性使它能被某些金属离子所取代生成金 )
属炔化物。反应非常灵敏,可被用来鉴别乙炔和端炔。 属炔化物。反应非常灵敏,可被用来鉴别乙炔和端炔。用 此法可鉴定炔烃中是否含有炔氢。 此法可鉴定炔烃中是否含有炔氢。 CH CH + 2Ag(NH3)2NO3 AgC CAg + 2NH4NO3 + 2NH3 乙炔银(白色)
炔烃

炔烃1.基本性质 1.1概述1.定义 分子里有碳碳三键的不饱和链烃叫做炔烃。
2.通式 C n H 2n-2(n ≥2) ,炔烃与二烯烃、环烯烃为同分异构体(类别异构)。
3.乙炔(1)结构:分子式C2H2,结构式为H -C ≡C -H ,直线型分子,键角180°。
(2)物理性质:纯净的乙炔是无色、无臭气体,比空气轻,微溶于水,易溶于有机溶剂。
(3)乙炔的实验室制法: 4.炔烃通性(1)随着碳原子数的增加,熔沸点逐渐升高,相对密度逐渐增大。
(2)碳原子数小于或等于4的炔烃,在常温下均为气体,其他的炔烃为液体或固体。
(3)炔烃不溶于水,易溶于有机溶剂。
2.性质应用2.1乙炔的实验室制法 (1)化学反应原理CaC 2+2H 2O −−→HC ≡CH ↑+Ca(OH)2 说明:碳化钙(CaC 2)属于离子型碳化物,它遇水可水解,即碳化钙中的钙离子跟H 2O 中的OH -生成氢氧化钙,伴随产生的H+与碳化物中的碳负离子结合成相应的烃。
即CaC 2+2H -OH −−→HC ≡CH ↑+Ca(OH)2 同理:ZnC 2+2H -OH −−→HC ≡CH ↑+Z n (O H )2 Al 4C 3+12H -OH −−→3CH 4↑+Al(OH)2 (2)仪器装置设计从物质的状态、反应条件等方面看,以电石跟水反应制备乙炔气体的反应属于“固+液−−−→常温气”的类型,与实验室中以Zn 和H2SO4稀溶液制备H2的反应类型相同。
因此,制乙炔气体可采用“制氢简易装置”。
(3)实验操作步骤设计该实验与大多数制备实验相似,操作步骤为:连接各仪器为整套装置;检验装置的气密性;将化学药品加到各仪器中去;使反应物混合;收集气体。
(4)应注意的问题①由于CaC 2与H 2O 的反应太剧烈,即便是CaC 2与H 2O 蒸气接触,它们也能顺利地反应,反应又是放热的,所以实验中要获得平稳的乙炔气流,主要措施有:a.以饱和NaCl 溶液代替水;b.通过分液漏斗向广口瓶中加水(或饱和NaCl 溶液)时,要慢、要少。
有机化学-炔烃

b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
第4章炔烃
HCl
CuCl NH4Cl HCl
CH2 CH C CH2 Cl
2-氯-1,3-丁二烯
16
三聚 四聚
3 CH CH Ni(CO)2 [Ph3P]2 苯
4 CH
CH
50
C
Ni(CO)2 ,1.5~2.0MPa
环己四烯
生成聚乙炔
催化剂
nCH CH
—CH=CH— n
聚乙炔
17
三、氧化
与烯烃相似,炔烃也可被氧化剂氧化,往往可以使叁键断裂, 最后得到完全氧化的产物——羧酸或二氧化碳。例如:
3CH CH + 10KMnO4 + 2H2O
6CO2+ 10KOH + 10MnO2
R—C
C—R' KMnO4
过量
R—COOH + R'—COOH
RCCR’
KMnO4(冷,稀,H2O,PH7-5)
OO RC CR
KMnO4(H2O,过量)
RCOOH + R’COOH
(1) O3 (2) H2O, Zn
炔烃的物理性质和烷烃、烯烃相似。低级的炔烃在常温常 压下是气体,但沸点比相同原子数的烯烃略高些。随着碳原子 数的增多,它们的沸点也升高。
炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚、 苯、乙醚、四氯化碳等。
纯的乙炔是无色、无臭味的气体。 液态乙炔受到震动会发生爆炸,所以在乙炔钢瓶中既要填 入多孔性物质,如硅藻土、石棉等,又要加入丙酮作为溶剂, 这样储存、运输、使用可以避免危险。 乙炔与空气组成的爆炸气体的组成范围比其他烃类要大的 多。在生产、使用时必须注意。
RCOOH + R’COOH
18
炔烃

RC CR' + H 2
Lindlar Cat.
R H
R' C C H
C2H5 C C H H C2H5
(顺 烯 ) 顺 式 烃
C2H5C CC2H5 + H2
Pd/CaCO3 喹啉
用林德拉催化剂还原的特点是顺式加氢
CH2=CH-CH2CH2-C≡CH + H2 (1mol) ≡
Ni
CH3CH2CH2CH2-C≡CH ≡ 烯烃比炔烃更易氢化
(2) 与卤素加成
H C C Cl H Cl
HC≡CH ≡
Cl2 FeCl3
Cl2 FeCl3
CHCl2-CHCl2
反应能控制在这一步 反式加成生成 反式烯烃
CH 2 CH CH 2 C CH Br 2 - 20 oC,CCl 4 CH 2 Br CHCH 2 C Br ( 90% ) CH
碳sp杂化轨道的电负性大 杂化轨道的电负性, 于碳sp2杂化轨道的电负性, 所以炔中π电子控制较牢。 所以炔中π电子控制较牢。
CH3CH2
H
1−戊炔
1−pentyne pentyne
1 2 3 4 5 CH2 CHCH2C CH
1−戊烯−4−炔
1−penten−4−yne penten−
1 H2C 9
2 3 4 5 CHCH2CH2CH 8 7 6 5
6 7 8 CHCH2C 4 3 2
9 CH 1
4, 8−nonadien−1−yne 8−nonadien−
C3H7C CH
C2H5C CH
HC CNa
C2H5Br
C2H5C C Na
五 制备
1. 二卤代烷脱卤化氢 常用的试剂: KOH常用的试剂: NaNH2 , KOH-CH3CH2OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
两种正离子稳定性不同
Markovnikov 规则
CH3CH2CH2 C CH
CH3CH2CH2 C Br CH2
HBr
Br
HBr
CH3CH2CH2 C CH3 Br
炔烃加 HBr 也有过氧化物效应:
CH3CH2CH2CH2 C CH HBr ROOR
CH3CH2CH2CH2 C H
C H Br
(丙) 与水的加成
s-cis
s-single(单键) 由单键产生的顺反异构
(三)
电子离域与共轭体系
CH3CH2CH2CH2CH3 氢化热 226kJ/mol
CH3CH2CH2CH2CH3 氢化热 254kJ/mol
π,π-共轭
CH3CH CHCH CH2 + 2H2
HC CH
HC CH
HOOCCH3
乙酸锌—活性炭 CH2 CHOOCCH3 o 160-165 C 乙酸乙烯酯
(4 ) 氧化反应:
(a) 与烯烃相似,炔烃也可以被高锰酸钾溶液氧化。
较温和条件下氧化时,非端位炔烃生成 --二酮。
CH3 ( CH2 ) 7C C ( CH2 ) 7COOH KMnO 4 , H2O , 常温 pH 7.5 , 92%~96% CH3 ( CH2 ) 7C C ( CH2 ) 7COOH O O
CH3 CH CH CH2 CH CH2 1,4-己二烯
CH2 C CH CH2 CH3
CH3 CH3 CH2 C
H CH3 C C H H C C CH3
1,2-戊二烯
C CH2
H
2, 3-二甲基-丁二烯
顺,顺-2,4-己二烯 或(Z,Z)-2,4-己二烯
(2E, 4Z) -3-叔丁基-2,4-己二烯
在强烈条件下氧化时,非端位炔烃生成羧酸(盐),
端位炔烃生成羧酸(盐)、二氧化碳和水。
KMnO 4 C 4H 9 C CH C4 H 9_COOH + CO 2 +H 2O H 2O ,OH
可用于推测三键的位置和原化合物的结构。
(b)
O
C C
O3 C _ O O C
H 2O
O C
O C + H 2O2
COO H + HOOC
例如:
1
CH3CH2CH2C CCH3
O3 H2O
2
CH3CH2CH2COOH + CH3COOH
反应中分子的碳架也很少发生重排,故此反应可根
据产物的结构测定重键的位置和原化合物的结构。
叁键比双键难于氧化,双键和叁键同时存在时,双键首先被 氧化。
(5) 炔烃的活泼氢反应
3-戊烯 - 1-炔 4- 乙基 -1-庚烯 -5-炔
若双键和三键处于相同的位次供选择时, 优先给双键 最低编号。
HC C CH CH2 CH3C CCHCH2CH CHCH3 CH CH2
1-丁烯 -3- 炔
5- 乙烯基 -2- 辛烯 -6- 炔
(四) 炔烃的物理性质
û Æ Ã ³ Ò È ² ±È û ² 1-¶ È ¡ ² 1-Î È ì ² 2-Î È ì ² 3-¼ ù -1-¶ È ³» ¡ ² 1-¼ È º ² 1-· È ý ² 1-Ê °Ì È ® Ë ¼ ² Û ã È µ / C -81.8 -101.5 -122.5 -98 -101 -124 -80.9 22.5 Ð ã ²µ / C -83.4 -23.3 8.5 39.7 55.5 28(10kPa) 71.4 99.8 180(2kPa) ´ Ô Ü È 4 Ï ¶ à ¶ (d20 ) 0.618 0.671 0.668 0.695 0.713 0.685 0.719 0.733 0.870
HC CH 2Ag(NH3)2NO3
AgC CAg
乙炔银(白色)
2NH4NO3
2 NH3
CH3CH2C CH
Ag(NH3)2NO3
CH3CH2C CAg
NH4NO3
NH3
丁炔银
CuC CCu 2NH4Cl 2 NH3
HC CH
2Cu(NH3)2Cl
乙炔亚铜(棕红色)
CuC CCu
2HCl
HC CH CuCl 2
CH CH + H2O HgSO4 H2SO4
[H2C
CH] OH 乙烯醇
CH3 CH O 乙醛
重排 C C H O
C C H O
烯醇式(不稳定)
酮式(稳定)
炔烃水合
HgSO4 CH3(CH2)5C CH + HOH H SO 2 4
重排
CH3(CH2)5C CH2 OH
CH3(CH2)5C CH3 O
C2H5C CC2H5 + H2
Lindlar催化剂 C2H5 C C H
C2H5 H 97%
CH3CH2C C(CH2)3CH3
Na, 液NH3, -78 C
o
H
(CH2)3CH3 C C H 97%~99%
CH3CH2
( 2 ) 亲电加成
(甲) 与卤素加成 与溴和氯加成
CH3 C CH Br2 CH3 C CH Br Br Br2 CH3 Br Br C CH Br Br
1,3-丁二烯分子中,
碳碳单键键长0.147nm,
比乙烷碳碳单键键长0.154nm短,由此可见 1,3-丁
二烯分子中碳碳之间的键长趋于平均化。
CH2 CH CH CH2
1
2
3
4
C-1、C-2、C-3、C-4:
C H HC H H C C H H
2 sp
键所在平面
1, 3-丁二CH3CH2C CH AgNO3
CH3CH2C CAg
炔烃纯化
(六) 炔烃的来源和制法
电石法 CaO
CaC2
3C 2200-2300 C
o
CaC2
CO
2H2O
HC CH
Ca(OH)2
乙炔
天然气高温部分氧化
2 CH4 1500-1600 C 0.01-0.001s
o
HC CH
3 H2
炔烃的制备
- HC Me4N Cl 5 2
+
Cl C C C2H5
HAc, 25 C
o
H
炔烃活性次序:H3CC CCH3> H3CC CH > HC CH 卤化氢的活性次序:HI > HBr > HCl
炔烃与HX加成机理:
C C HX slow
+
C C H
X
-
+
X
C H
C
X
- fast
C H
C
烯基正碳离子
不太稳定,较难生成, 一般叁键的亲电加成 比双键慢。
o
Na, 190-220 C NaC CNa o or NaNH2, 液NH3, -33 C
o
CH3CH2CH2 C C CH2CH2CH3
NaNH2, 液NH3
CH3CH2C CH
-33 C
o
CH3CH2C CNa
CH3CH2Br 液NH3, -33 C
o
CH3CH2C CCH2CH3
(丙) 炔烃的鉴定 (过渡金属炔化物的生成)
(2)碳原子轨道的 sp 杂化
1sp 杂化轨道 = 1/2 s + 1/2p
一个sp 杂化轨道
二个sp 杂化轨道
未参与杂化的两个p轨道的对称轴互相垂直且都垂直 于sp杂化轨道对称轴所在直线。
(3)碳碳三键的组成
乙炔分子的σ键
乙炔分子中π键的形成
(二)炔烃的同分异构
含有四个或四个以上碳原子的炔烃不仅存在碳架异 构还存在官能团位次异构。
现象是溴的红棕色消失,用于检验炔烃及其他 含有碳碳重键的化合物。
(乙) 炔烃与卤化氢加成的加成比烯烃困难。
HC CH HCl, HgCl2 150-160 C
o
CH2 CHCl
HCl, HgCl2 150-160
CH3CHCl2
炔烃在相应卤离子存在下与 HX 加成通常得反式产物:
H5C2C CC2H5 HCl
( 1 ) 加氢
(甲) 催化氢化和还原
CH3C CCH3 + 2H2
Ni,C2H5OH 25 C,5MPa CH3CH2CH2CH3
CH3 CH3 Pd-CaCO3 H2C CHC CHCH2CH2OH HC C C CHCH2CH2OH + H2
喹啉 80%
用喹啉或醋酸铅处理的Pd-CaCO3一般称为Lindlar催化 剂.
(甲) 二卤代烷脱卤化氢
(CH3)3C CH CH2 Br Br (CH3)3COK 2HBr
(CH3)3C C 91%
CH
(乙) 炔烃的烷基化
HC CH NaNH2, 液NH3 -33 C
o
CH3CH2CH2CH2Br
HC CNa
液NH3, -33oC
HC C CH2CH2CH2CH3 80%
第六章
CH3(CH2)5CH CH OH 重排
H2O2 2 HO-/H2O
CH3(CH2)5CH2CHO
( 3 ) 亲核加成--炔烃易进行亲核加成
HC CH HOCH3 20%KOH/H2O 160-165 C ,2-2.5MPa
HCN CuCl CH2 CHCN
丙烯腈
o
CH2 CHOCH3
甲基乙烯基醚
(一) (二) (三) (四)
二烯烃和共轭体系
二烯烃的分类和命名 二烯烃的结构 电子离域与共轭体系 共轭烯烃的反应
(一) (1) (甲)
二烯烃的分类和命名
