大学有机化学炔烃
有机化学 第四章 炔烃
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
大学有机化学-炔烃

顺式聚乙炔
反式聚乙炔
问题:
→ CH3(CH2)2C≡CCH2CH3
KMnO4
(CH3(CH2)2COOH) + (CH3CH2COOH)
HOOCCH3
乙酸锌—活性炭 160-165 oC
CH2 CHOOCCH3 乙酸乙烯酯
炔烃亲核加成机理:
CH3C CH CH3O-
CH3 C CH-
OCH3
CH3OH
CH3O-
CH3 C CH2 OCH3
碳负离子稳定性与C+相反!
(四)硼氢化的氧化反应
H5C2C
CC2H5
B2H6, 0 oC 二甘醇二甲醚
H5C2
C2H5
CC
B
H
3
→ H2O2
NaOH RCH2CHO
(4)聚合反应 (a)低聚
乙烯基乙炔
CuCl NH4Cl 2HC CH
HC CH
CH2 CH C CH CuCl NH4Cl
(b)高聚
CH2 CH C C CH CH2
二乙烯基乙炔
n HC CH TiCl4 Al(C2H5)3
CH CH n 聚乙炔
内的最长的链作为主链,按最低序列原则给碳 碳双键或碳碳三键尽可能降低位次。
CH3CH CH C CH 3-戊烯 - 1-炔
CH3C CCHCH2CH CH2 C2H5
4- 乙基 -1-庚烯 -5-炔
若双键和三键处于相同的位次供选择时, 优先给双键 最低编号。
HC C CH CH2 CH3C CCHCH2CH CHCH3
RC≡CH+NaNH2 RC≡CNa+NH3
炔化钠时非常重要的有机合成中间体, 常利用与(RX)反应来合成炔烃同系物。例 如:
有机化学第5章 炔烃 二烯烃
Br
NaNH2的矿物油 , 150-160o C
NaNH2
KOH-C2H5OH
叁键移位
CH3CH2CCH
5.5.3 由金属炔化物制备炔烃
CH3CH2CCH
空气,CuCl , NH3 , CH3OH
CH3CH2CC-CCCH2CH3 二聚
R’X
RMgX NaNH2
CH3CH2C CMgX
CH3CH2C CNa
HC C乙炔基 ethynyl CH3C C1-丙炔基 1-propynyl HC CCH22-丙炔基 2-propynyl
•戊炔 的构造异构体: CH3CH2CH2C CH 1-戊炔 CH3CH2C CCH3 2-戊炔 (2) 炔烃的命名
• 系统命名:
CH3CHC CH CH3 3-甲基-1-丁炔
烯醇式
酮式
3 加卤素
*1 CH2=CH-CH2-CCH + Br2 (1mol)
CH2BrCHBr-CH2-CCH
Cl2 FeCl3
H Cl C C
Br2
?
Cl H
*2 HCCH
Cl2 FeCl3
CHCl2-CHCl2
反应能控制在这一步。
*3 加氯必须用催化剂,加溴不用。
4 硼氢化反应
R2BH
R-CCCu
HNO3
5.4.2 加成反应
1 加HX
*1 与不对称炔烃加成时,符合马氏规则。 *2 与HCl加成,常用汞盐和铜盐做催化剂。 *3 由于卤素的吸电子作用,反应能控制在一元阶段。 *4 反式加成。
CH3CH2CCCH2CH3 + HCl
催化剂
CH 3CH2 H C C Cl CH 2CH3
有机化学【炔烃 二烯烃】

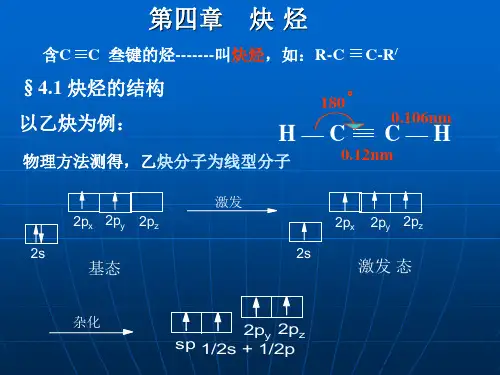
C-H键长 :
0.110nm (Csp3-Hs)
轨道形状:
碳的电负性: pka:
狭
长
逐
渐
变
成
宽
圆
随 S 成 份 的 增 大, 逐 渐 增 大 ~50 ~40 ~25
二、炔烃的异构和命名
炔烃从丁炔开始有构造异构现象。炔烃的 构造异构现象也是由于碳链不同和三键位置不 同所引起的,但由于在碳链分支的地方,不可 能有三键存在,所以炔烃的构造异构体和比碳 原子数目相同的烯烃少些。例如,丁烯有三个 构造异构体,而丁炔只有两个:
H
H
(2)碱金属和液氨还原
R-C C-R'
Na, NH3
R H C C
H R'
炔烃被还原成反式烯烃
此条件下双键不被还原
反应机理:
H 3C C C CH3 + Na
- Na
H 3C
C
C
CH3
H N H2 - NH 2
a ra d ic a l a n ion H H 3C C C CH3 a v in y lic r ad ica l H H 3C C C CH3 a v in y lic a n io n
具有活泼氢原子的炔烃和硝酸银的氨溶液或 氯化亚铜的氨溶液发生作用,迅速生成炔化银的 白色沉淀或炔化亚铜的红色沉淀。
Ag(NH3)2NO3 RC≡CH
Cu(NH3)2Cl RC≡CCu↓ RC≡CAg↓
例:
CH3-CCH
Ag (NH3)+2NO3
CH3 -CC Ag
Cu (NH3)+2Cl
与HCl加成,常用汞盐和铜盐做催化剂
HC≡CH+HCl
Cu2Cl2 或HgSO4
大学有机化学课件炔烃

炔烃加水也符合马氏规则
O
R–C–CH3
甲基酮
只有乙炔水合得乙醛; 端基炔水合得甲基酮; 非末端炔烃 两种酮的混合物。
3、硼氢化反应 (了解)
炔烃的硼氢化反应, 可以停留在含双键的阶段为顺式构型。
CCHHH3C3
CCCHC3
(BCHH3)32
BCCHH33COCOH CCHC3 H3C BC
3H
H3
O CH3CH2C–CH3
CH≡CNa + CH3CH2Br
Na
CH≡CH
HBr
CH2=CH2
H2 林德拉催化剂
CH≡CH
7、聚合反应 (略)
CH2 CH CH C CH
7 6 54 3 2 1
CH2=CH-CH-CH=CH–CH =CH2
C CH3
C CH
CH2
5-乙炔基-1, 3, 6-庚三烯 2-甲基-3-乙炔基-1,4-戊二烯
二、物理性质
1、炔烃分子短小、细窄, 在液态及固态中彼此很靠近, 分子间作用力强, 故熔点、沸点和密度较大。
反应、聚合反应, 但也有一定特殊性。 CH3–CH3 50
sp杂化控制电子的能力更强, 亲电加成反应稍慢于双键.
1、还原反应
1)催化加氢 (不同催化剂, 不同产物)
① 高活性催化剂 (Ni、Pt、Pd等) (生成烷烃)
H2
H2
R C CH 催化剂 R CH CH2 催化剂 RCH2CH3
CH3CCCH3 +H2 Pt CH3CH2CH2CH3
CH3 H
硼氢化的产物用酸处理, 可得顺式烯烃。
末端炔硼氢化的产物用碱性过氧化氢氧化生成醛。
R
H
RC≡CH
4第四章 炔烃 二烯烃
RCCR` KMnO4 RCOOH + R`COOH
H2O
(2) 缓慢氧化——二酮
OO
CH3(CH2)7CC(CH2)7COOH
KMnO4 H2O
CH3(CH2)7-C-C-(CH2)7COOH
pH=7.5
92%~96%
•利用炔烃的氧化反应,检验叁键的存在及位置
•这些反应产率较低,不宜制备羧酸或二酮.
有机化学 Organic Chemistry 第四章 炔烃 二烯烃
第四章 炔烃 二烯烃
(一) 炔烃
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式:
CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名**
(1)异构体——从丁炔开始有异构体.
•同烯烃一样,由于碳链不同和叁键位置不同所引起的.由 于在碳链分支的地方不可能有叁键的存在,所以炔烃的 异构体比同碳原子数的烯烃要少. •由于叁键碳上只可能连有一个取代基,因此炔烃不存在 顺反异构现象.
炔烃和烯烃一样,也能和卤化氢、卤素等起亲电加成反
应,但炔的加成速度比烯慢
(A) 和卤素的加成
Br2
RC CR
Br
+
RC CR
Br-
反式加成
Br
R
CC
R
Br
卤素的活性F2>Cl2>Br2>I2
Br Br Br2 R C C R
这一反应可用于炔烃的鉴别。
Br Br
控制条件也可停止在一分子加成产物上.
❖加氯必须用FeCl3作催化剂。
•含有双键的炔烃在命名时,一般 先命名烯再命名炔 .
碳链编号以表示双键与叁键位置的两个数字之和最小
为原则。在同等的情况下,要使双键的位次最小。
有机化学-炔烃
b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
炔烃大学教案
课时:2课时年级:高中教材:《有机化学》人教版教学目标:1. 知识目标:了解炔烃的定义、结构特点、命名规则及其在生活中的应用。
2. 能力目标:培养学生分析、归纳、总结的能力,提高学生的实验操作技能。
3. 情感目标:激发学生对有机化学的学习兴趣,培养学生严谨的科学态度。
教学重点:1. 炔烃的定义、结构特点、命名规则。
2. 炔烃的物理性质和化学性质。
3. 炔烃在生活中的应用。
教学难点:1. 炔烃的结构特点及其在化学性质上的体现。
2. 炔烃的命名规则。
教学过程:第一课时一、导入1. 提问:同学们,我们已经学习了烯烃,那么今天我们来学习炔烃,请大家谈谈对炔烃的了解。
2. 引导学生从烯烃的结构特点入手,引出炔烃。
二、新课讲授1. 炔烃的定义:炔烃是含有碳碳三键的烃类化合物。
2. 炔烃的结构特点:碳碳三键、单键交替排列。
3. 炔烃的命名规则:以碳碳三键的位置和取代基的名称为基础。
4. 炔烃的物理性质:无色、无味、易挥发。
5. 炔烃的化学性质:加成反应、氧化反应、聚合反应等。
三、课堂练习1. 判断下列化合物是否属于炔烃。
2. 命名下列炔烃。
3. 列举炔烃的两种化学性质。
四、小结1. 总结本节课所学内容,强调炔烃的定义、结构特点、命名规则及其化学性质。
2. 布置课后作业,巩固所学知识。
第二课时一、复习导入1. 回顾上节课所学内容,提问学生炔烃的定义、结构特点、命名规则等。
2. 引导学生思考炔烃在生活中的应用。
二、新课讲授1. 炔烃在生活中的应用:a. 合成橡胶:丁二烯、异戊二烯等。
b. 合成塑料:聚乙烯、聚丙烯等。
c. 合成药物:抗癌药物、心血管药物等。
2. 炔烃的实验操作:a. 炔烃的制备:通过卤代烃与金属钠反应制备。
b. 炔烃的检验:通过加成反应检验。
c. 炔烃的提纯:通过蒸馏提纯。
三、课堂练习1. 列举三种炔烃在生活中的应用。
2. 实验操作题:制备并检验乙炔。
四、小结1. 总结本节课所学内容,强调炔烃在生活中的应用及其实验操作。
大学有机化学第三章 烯烃和炔烃
CH3 → CH=CH2 + HX
CH3CH—CH3 X
马代规则是 不对称试剂与双键发生亲电性加成时, 试剂中正电性部分主要加到能形成较稳定正碳离子 的那个双键碳原子上。 + CH3CHCH3 δ+ δ-
CH3—CH=CH2 + H+
HX分子中的氢以H+ 质子形式发生反应,因此称为亲电试剂
CH3CH2CH2
CH3
顺反异构命名与Z .E命名规则不相同,不能混为一 谈,两者之间没有固定的关系
例如:
Cl Cl C=C CH3 H (Z)-1 , 2-二氯丙烯 顺-1 , 2-二氯丙烯 H C H ‖ C H H 大 Br
Cl
C=C
CH3
Cl 大
Cl C COOH ‖ C Br Cl
(E)-1 , 2-二氯-1-溴丙烯 顺--1 , 2-二氯-1-溴丙烯 CH3 C H ‖ C H H
次产物
因此 1.1.1-三氟-3-氯丙烷是主要产物
2. 加硫酸
R-CH=CH2 + HOSO2OH H3PO4 300℃ 7Mpa R-CHCH3 H2O RCH-CH3 OSO2OH OH (间接水化法制备醇) CH3CH2OH
CH2=CH2 + H2O
3. 加卤素
CH2 = CH2 + X2
CH2 = CH2 + Br2/CCl4 Br2/H2O CH2—CH2 X X CH2-CH2 Br Br
如遇到含多个双键化合物而主链编号有选择时,则编号应从 顺型双键的一端开始 4 1 如 3 2 CH3 H 6 5 CH2 C=C 7 C=C H H H CH3 顺· 反-2.5-庚二烯
四、物理性质 五. 化学性质
有机化学基础知识点炔烃的命名和结构
有机化学基础知识点炔烃的命名和结构炔烃是有机化合物中的一类,它们的分子结构中含有碳-碳叁键。
炔烃可以进一步分为单炔烃和多炔烃两类。
在本文中,我们将详细介绍炔烃的命名规则以及结构特点。
一、单炔烃的命名单炔烃是指分子中只含有一个碳-碳叁键的炔烃。
根据命名规则,单炔烃的命名分为三个步骤:首先确定烃的主链,其次标记炔烃叁键的位置,最后确定炔烃的名称。
为了更好地理解单炔烃的命名规则,我们以乙炔为例进行说明。
乙炔是由两个碳原子构成的炔烃,它的分子式为C₂H₂。
首先,我们确定主链长度为两个碳原子,因此它的名称为“乙”。
接下来,我们需要标记炔烃叁键的位置,乙炔中的碳原子编号为1和2,其中编号1上连接有炔烃叁键,因此我们用数字1来标记它的位置。
最后,将这两步结果结合起来,乙炔的名称就是“1-乙炔”。
二、多炔烃的命名多炔烃指的是分子中含有两个以上碳-碳叁键的炔烃。
与单炔烃的命名类似,多炔烃的命名也分为三个步骤:确定主链、标记叁键位置和确定名称。
以丙炔为例来介绍多炔烃的命名规则。
丙炔是由三个碳原子构成的炔烃,其分子式为C₃H₄。
首先,我们确定主链长度为三个碳原子,因此它的名称为“丙”。
接下来,我们需要标记叁键的位置。
丙炔中的碳原子编号为1、2和3,其中编号1和3上连接有炔烃叁键。
我们用数字1和3来标记这两个位置。
最后,将这两步结果结合起来,丙炔的名称就是“1,3-丙炔”。
三、炔烃的结构特点炔烃的分子结构中含有碳-碳叁键,这赋予了它们许多特殊的化学性质。
与其他有机化合物相比,炔烃的化学反应更为活泼,更容易发生加成反应、消除反应和取代反应。
由于叁键的存在,炔烃的分子间相互作用力较弱,使其具有较低的沸点和熔点。
这也导致了炔烃在常温下多呈现为气体或液体的状态。
在物理性质方面,炔烃还具有较强的燃烧性和较高的燃烧热。
由于炔烃分子中碳原子间含有叁键,燃烧时叁键的断裂释放了大量的能量,因此炔烃是优良的燃料。
此外,炔烃还常用于合成其他有机化合物,如合成橡胶、塑料和医药品等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
炔烃比烯烃难氧化,可控制条件,氧化双键保留三键。 CrO3
CH 3C
CCH 2CH
CHCH 3
O CH3C C CH2C
CH3COOH
+ CH3 C OH OH O
3.炔氢的活泼性 SP杂化碳的电负性大于SP2 或SP3 杂化碳,
故SP杂化碳上的氢活泼性更大。即:炔氢有一定酸性 对有机化合物而言,酸性不是使指示剂变色的酸性。 广义的酸性,即pKa值与烷、烯中的氢比较而言。
RC ≡ C Na + Br CH2R
1°卤代烷
液氨
RC ≡ CCH2R
生成的炔钠是一个亲核试剂 用于制备高级炔烃
4.聚合反应
不生成高分子化合物,生成环状二聚、三聚、 四聚及链状二、三、四聚体
2 CH
CH
Cu2Cl2 / NH4Cl
CH
C CH
CH2
乙烯基乙炔
练习:
1. 完成下列反应:
(1) CH3CH =CHCH 3 + Cl2
pKa CH3-CH3 50 CH2=CH2 44 CH≡ CH 25 H-OH 15.7
杂化C的电负性
2.48 2.75 3.29
酸式离解常数
pKa = lgKa
◆ 炔氢的酸性比水弱,要极强的碱才与之生成盐 (即金属炔化物)
HC ≡ CH
Na 液氨
乙炔钠 HC ≡ CNa + 1/2H2 Na -33℃ NaC ≡ CNa 乙炔二钠
ROH ;
: :
: :
亲核加成反应历程
HC ≡ CH + H A
+ -
H+ CH=CH HC=CH
:
A sp2碳负离子
A
H
2.氧化反应: A.KMnO /H+
4
RC≡ → RCO2H HC≡ → CO2+H2O B.O3/H3O+,Zn: RC≡ → RCO2H HC≡ → CO2+H2O
可用来确定 炔烃的结构
(Csp-Csp)
105.9pm (Csp-Hs)
轨道形状:
碳的电负性: pKa:
狭 长
逐 渐 变
成 宽
圆
随 S 成 份 的 增 大, 逐 渐 增 大。 ~50 ~40 ~25
2. 炔烃的命名 (参见前面相关介绍)
4.2 炔烃的化学性质
炔烃:分子中含碳碳叁键(1个σ、2个π)的烃。
通式为 CnH2n-2
CH 3 C
CH
ROOR
C.与H2O加成(马氏加成)
SO + H2H+ 4 HC ≡ CH + H OH [CH2 =CH ++ Hg HgSO4 OH] 重排 CH3-CH=O
烯醇式不稳定
O
- H SO + 2H 4 R-C≡ CH + H OH HgSO4 Hg++
+
[R-C=CH2 ] OH
的化合物进行亲核加成,产物也遵守马氏规则:
20% KOH HOCH 3 。 CH2 150~160 C
=CH
OCH3 O C CH3
HC
CH
+
CH3COOH HCN
Zn (O Ac) 2 。 CH2 170~230 C
=CH
=
O
CuCl - HCl
CH2 =CH
CN
反应的净结果相当于在醇、羧酸等分子中引入 一个乙烯基,故称乙烯基化反应。
CCH3
(2) 亲电加成反应
(i) 加卤素
CH2 CH CH2C CH Br2 -20oC,CCl4 CH2 Br CHCH2C CH Br (90%)
sp杂化轨道电负性大于sp2杂化轨道电负性,炔中电子控制较牢。
HCCH
Cl2 FeCl3
H C C Cl
Cl H
Cl2 FeCl3
CHCl2-CHCl2
(1)生成炔化物
[Cu( NH3 )2 ] Cl
+ห้องสมุดไป่ตู้
RC
-
CCu
CAg )
棕红色沉淀
RC
CH
Cu2Cl2 / NH3
( RC
( AgNO3 / NH3 )
[Ag(NH3 )2 ]NO3
白色沉淀
RC
CCH3
此反应可用于端基炔(炔氢)的鉴别。
(2)炔烃的烷基化反应:用于有机合成,加长 碳链。
炔钠与卤代烷(1°RX)反应
◆反应的关键步骤是由亲核试剂的进攻引起的,故称
亲核加成反应。 亲核加成反应:亲核试剂进攻炔烃的不饱和键而 引起的加成反应称炔烃的亲核加成 ◆亲核试剂:反应中能提供孤对电子并形成新的共
价键的中性分子或负离子;如:CN- ,AcO-具有亲
正电荷(原子核)的性质,故称亲核试剂。
O RCOH
_ HCN: :C ≡ N , (CN );
H C CH3
O
R C CH3
如何由端基炔得醛?
炔烃的硼氢化-氧化反应(间接加水)也可重排成醛、酮
RC
CH
(1) B2H6
(2)
OH
-
H2 O 2
[
R CH
CH OH
]
O R CH2 CH
端基炔的硼氢化-氧化反应得到醛
(3)亲核加成(Nucleophilic Addition Rxn)
炔烃易于ROH、RCOOH、HCN等含有活泼氢
反应能控制在这一步。
加氯必须用催化剂,加溴不用。
反式加成生成 反式烯烃。
◆C=C活性大于C≡C,当分子中同时有C=C及 C≡C时,C≡C与X2加成要难一些。
H2 C CH CH2 C CH
Br2 CCl4 , -5℃
Br Br H2 C CH CH 2 C CH
B.与HX加成:活性HI>HBr>HCl>HF
C2 H5
注意:
A、反应机理:吸附机理 B、炔烃的催化氢化比烯烃的催化氢化容易, 故当分子中同时有烯、炔时,叁键首先被催化 氢化。
CH3CH=CHCH2C
CCH3
H2(1mol)
CH3CH=CHCH2C
CCH3
C、加氢的控制:
CH3CH=CHCH2C CCH3
林德拉催化剂
CH3CH=CHCH2C
高 温
?
(2) C2H5CH =CH2
NBS 过氧化苯甲酰
?
(3)
HC
CNa
+
(CH 3)2CHCH 2Br CH
① Na ② C H3(C H2)3C l
? ?
(4) (CH 3)2CHCH 2C
2. 选择适当的原料合成
CH2 Cl
CH Br
CH 2 Br
第四章 炔烃
4.1 炔烃的结构与命名
1. 乙炔的结构
特点: 1. 三键碳sp杂化;两个sp杂化轨道成180°夹角; 2. 三键由一个σ键,两个π 键组成。直线形分子。
SP杂化:
P轨道 激发 2P 2S2 基态
2
SP杂化 2P 2S 激发态 SP杂化轨道
乙炔的电子云交盖图示
plane A plane B
互变异构体:分子中因某一原子的位置转移而产生 的官能团异构体。 互变异构属于构造异构的一种。在互变异构当中, 酮式和烯醇式处于动态平衡。互变异构体之间难以 分离。
只有乙炔水合得乙醛,其他炔烃水合都得到 酮。端基炔水合得甲基酮。
O
HC
RC
CH
CH
+ H2O
+ H2O
H2SO4 HgSO4
H2SO4 HgSO4
◆三键与双键都是不饱和键,反应相似: 加成反应(催化加氢、亲电加成),氧化反应、 聚合反应,但也有一定特殊性。
◆端基炔(-C≡CH)氢原子具有酸性
1.加成反应
(1)催化加氢:不同催化剂,不同产物 ① Cat. Pt Pd Ni :加两分子氢生成烷烃
R C C R' H2 R CH CH R' H2 R CH2 CH2 R'
H
C
C
H
H C
C
H
H H H C C
H H H
H H
C C
SP2
H H
H
C C
SP
H
杂化方式:
SP3
键角:
109o28’
~120o
180o
碳碳键长
153.4pm
133.7pm
120.7pm
(Csp3-Csp3)
C-H: 110.2pm (Csp3-Hs)
(Csp2-Csp2)
108.6pm (Csp2-Hs)
② Lindlar Cat. (林德拉) :加一分子氢,顺式加成
C2 H5 C C C2 H5 H2 Lindlar Cat. C2 H5 C H C H C2 H5
Pd/CaCO3 Pb(OAc)2
③ 还原氢化,氨基钠/液氨,反式加氢
C2H5C ≡ CC2H5
Na, 液氨 -78℃
H C C
C2H5 H
重排
RCCH3
反应特点: (a) Hg2+催化,酸性;符合马氏规则。 (b) 乙炔乙醛,末端炔烃甲基酮,非末端 炔烃两种酮的混合物。
O CH3C
H
互变异构
O CH3C
H CHCH3
CHCH3
烯醇式(enol form)
酮式(ketone form)
孤立的醛酮,一般酮式较稳定,平衡偏向于酮式。
反应特点: (a)与不对称炔烃加成时,符合马氏规则;反式加成。 (b)与HCl加成,常用汞盐和铜盐做催化剂。 (c)由于卤素的吸电子作用,反应能控制在一元阶段。
