大学有机化学课件炔烃
合集下载
大学有机化学 烯烃和炔烃PPT优质课件

C + Br
C
极性 Br
C
Bδr+
δBr
慢
C B+r + Br-
C
C
π- 络合物
.
σ- 络合物 (溴鎓离子)
第二步: 背面
Br
Br- +
C B+r
快
C
C
C
Br
.
第三章 烯烃和炔烃 第一节 烯烃 (三、烯烃的性质)
2. 加卤化氢 (HX)
X
C C + HX
CC
H
烯烃与卤化氢同样发生分步的、亲电性加成反应
.
3个sp2杂化轨道取平面正
三角形分布,与未杂化的
p 轨道垂直。sp2 杂化轨
道之间的夹角为 120o.
第三章 烯烃和炔烃 第一节 烯烃 (一、烯烃的结构)
头碰头重叠形成C—Cσ 键
键: 284 kJ/mole
.
肩并肩重叠形
成键,重叠
程度较小, 键 较不牢固,不 能自由旋转。
键键能 357kJ/mole
第三章 烯烃和炔烃
第一节 烯 烃
一 烯烃的结构 二 命名和异构 三 烯烃的性质 四 共轭烯烃
第二节 炔 烃
一 炔烃的结构 二 异构和命名 三 炔烃的性质
.
第三章 烯烃和炔烃
第三章 烯烃和炔烃
(Alkenes and Alkynes)
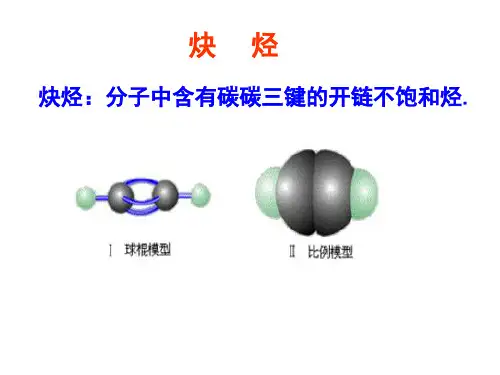
分子中含C=C双键的叫烯烃; 而含C≡C叁键的叫炔烃。烯烃 和炔烃都是不饱和烃 (Unsaturated hydrocarbons)。
.
诱导效应: 多原子分子中,由于原子和基团电负性的不同,引起 键的极性并通过通过静电诱导作用依次影响分子中不 直接相连的键,使之发生极化,从而引起整个分子中 电子云分布发生改变的作用。用符号 I 表示。
炔烃的课件
HgSO4 CH (CH ) C CH CH3(CH2)5C CH + HOH 3 2 5 3 H2SO4 O
加水反应方程式的意义: 加水反应方程式的意义:
①烯醇式结构是不稳定结构,不能稳定存在; 烯醇式结构是不稳定结构,不能稳定存在; ②有机化学反应中存在分子结构的重排现象; 有机化学反应中存在分子结构的重排现象; ③炔烃加水产物的写法---乙炔加水生成乙醛。 炔烃加水产物的写法---乙炔加水生成乙醛。 ---乙炔加水生成乙醛
CH3(CH2)3C 过氧化物 Br CH3(CH2)3CH CH2 CHBr HBr HBr 过氧化物 CH3(CH2)3CBr2CH3 CH3(CH2)3CH2CHBr2
CH3(CH2)3C
CH
ቤተ መጻሕፍቲ ባይዱ
HBr
炔烃与HX作用,在一定的条件下可以停留在一分子加成阶段。 乙炔与一分子氯化氢作用生成氯乙烯,这是工业上生产氯乙烯的方法之一。
方程式的书写注意根据条件确定产物。
Ni,C2H5OH CH3CH2CH2CH3 CH 3C CCH 3 + 2H 2 25 C,5MPa
5 % Pd-BaSO4 R CH2 C C CH2 R 25℃,喹啉, 0。MPa CH2 C C CH2 R R HH
CH3 Pd-CaCO3 HC C C CHCH2CH2OH + H2
CH + NaNH 2 CH + NaNH 2
HC R C
液氨 液氨
HC R
CNa + NH3 C CNa + NH3
(2)炔氢的微弱酸性使它能被某些金属离子所取代生成金 )
属炔化物。反应非常灵敏,可被用来鉴别乙炔和端炔。 属炔化物。反应非常灵敏,可被用来鉴别乙炔和端炔。用 此法可鉴定炔烃中是否含有炔氢。 此法可鉴定炔烃中是否含有炔氢。 CH CH + 2Ag(NH3)2NO3 AgC CAg + 2NH4NO3 + 2NH3 乙炔银(白色)
大学有机化学课件炔烃

炔烃加水也符合马氏规则
O
R–C–CH3
甲基酮
只有乙炔水合得乙醛; 端基炔水合得甲基酮; 非末端炔烃 两种酮的混合物。
3、硼氢化反应 (了解)
炔烃的硼氢化反应, 可以停留在含双键的阶段为顺式构型。
CCHHH3C3
CCCHC3
(BCHH3)32
BCCHH33COCOH CCHC3 H3C BC
3H
H3
O CH3CH2C–CH3
CH≡CNa + CH3CH2Br
Na
CH≡CH
HBr
CH2=CH2
H2 林德拉催化剂
CH≡CH
7、聚合反应 (略)
CH2 CH CH C CH
7 6 54 3 2 1
CH2=CH-CH-CH=CH–CH =CH2
C CH3
C CH
CH2
5-乙炔基-1, 3, 6-庚三烯 2-甲基-3-乙炔基-1,4-戊二烯
二、物理性质
1、炔烃分子短小、细窄, 在液态及固态中彼此很靠近, 分子间作用力强, 故熔点、沸点和密度较大。
反应、聚合反应, 但也有一定特殊性。 CH3–CH3 50
sp杂化控制电子的能力更强, 亲电加成反应稍慢于双键.
1、还原反应
1)催化加氢 (不同催化剂, 不同产物)
① 高活性催化剂 (Ni、Pt、Pd等) (生成烷烃)
H2
H2
R C CH 催化剂 R CH CH2 催化剂 RCH2CH3
CH3CCCH3 +H2 Pt CH3CH2CH2CH3
CH3 H
硼氢化的产物用酸处理, 可得顺式烯烃。
末端炔硼氢化的产物用碱性过氧化氢氧化生成醛。
R
H
RC≡CH
炔烃的ppt课件

CH≡CH CH3C≡CH CH3CH2C≡CH CH3CH2CH2C≡CH CH3CH2C≡CCH3 CH3(CH2)3C≡CH CH3(CH2)4C≡CH CH3(CH2)15C≡CH
-81.8(891毫米) -101.5 -122.5 -98 -101 -124 -80.9 22.5
-83.4 -23.3 8.5 39.7 55.5 71.4 99.8 180(15毫米)
炔烃的
一、炔烃的结构特点
(1)碳原子的sp杂化 基态
2p
2s
激发态
2pΒιβλιοθήκη 2ssp杂化态2p
sp
1s
1s
1s
一个sp杂化碳原子
一个σ键,二个π键。
二个sp杂化碳原子和二个氢原子形成乙炔
H C C
炔的两个π键
二、炔 烃的命名
与烯相似,只将“烯”改为“炔”。
C H C H C H CC H 3 2 C H 3 4-甲基-1-戊炔
(4)加水
HgSO4 H OH SO C HC H+ 2 2 4
H2C CH 重 排 CH CH 3 OH
乙烯醇
O
CC H O
烯醇式(不稳定)
重 排
CC HO
酮式或醛式(稳定)
方程式的书写:写出最终产物即可。
HgSO4 C H ( C H ) CC H C H ( C H ) C C H + H O H 3 2 5 3 3 2 5 H2SO4 O
HBr CH CH (CH ) CBr CH CH (CH ) C 2 3 2 3 2 3 3 2 3
炔烃与HX作用,在一定的条件下可以停留在一分子加成阶段。 乙炔与一分子氯化氢作用生成氯乙烯,这是工业上生产氯乙烯的方法之一。
有机化学第五章炔烃(陈青)-幻灯片

Na
C3 C H2 C HCC 2 C3 H H 液 NH3
CH3CH2 C
H
H C
CH2CH3
18
机理:
Na
RCCR
R C C R Na
负离子自由基
NH3
R
CC
H
R
乙烯型自由基
R
CC
H
R
反式 稳定
R
R
CC H
顺式
R CC
Na
H
R
乙烯型自由基
R
NH3
CC
H
R
乙烯型负离子
R
H
CC
H
R
反式烯烃
② 炔烃用LiAlH4还原得反式烯烃。 ③ 炔烃硼氢化,醋酸处理得顺式烯烃。
3
异构:由于炔烃是个直线形分子,故没有几何异构, 它具有碳链异构和官能团位置异构。 碳链不同
叁键位置不同
1—戊炔
碳链位置异构
3—甲基—1—丁炔
2—戊炔 官能团位置异构
6
命名:系统命名 (IUPAC) 命名原则
炔烃的系统命名原则与烯烃相同,无顺反异构,只将烯字改 为“炔”字即可(英文词尾ene改为yne,乙炔英文名称采用 俗名acetylene)。
乙炔中的碳为SP杂化,轨道中S成分较大,核对电子的束缚
14
能力强,电子云靠近碳原子,使乙炔分子中的C-H键 δ- δ+
极性增加: HCCH 氢具有酸性。
(2)炔化物的生成
①乙炔或 RCCH可和NaNH2、RLi、RMgX反应
RCCH+ NaNH2 RCCH+ n-C4H9Li
RC CNa+ NH3
19
有机化学-炔烃

Nationality: American
b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
有机化学ppt-炔烃
图4-5 1,3-丁二烯分子的共轭π键
C2-C3轨道重叠的结果使得四个p电子的运动范围不再局限 于某两个碳原子之间,而是可以扩展到四个碳原子范围内,形成 一个包括四个碳原子在内的“共轭π键”(或叫大π键),这种现 象称为电子的离域。含有大π键的体系称为共轭体系。电子离域 程度越大,体系能量越低,体系越稳定。
炔烃与酸性高锰酸钾溶液作用时,碳碳叁键断裂,同时生
成羧酸、二氧化碳等。 O
RC CH KMnO4 R C
H
OH + CO2 + H2O
O
O
RC CR' KMnO4 R C OH + R' C OH
H
炔烃也可以被臭氧氧化,也可用于鉴别炔烃。
O
H3CH2CH2CH2CC
CH (1)O3
(2)H2O
(三)聚合反应
烯醇式
R C CH3 O 酮式
5.与HCN亲核加成 在氯化亚铜的催化下,HCN也可与乙炔作用生成丙烯腈。 由于反应是由亲核试剂的进攻引起的,故称为亲核加成反应。
CH CH + HCN Cu2Cl2 CH2 CH CN 丙烯腈
炔烃进行亲电加成虽然比烯烃难一些,但进行亲核加成却 比烯烃容易得多。
(二)氧化反应
C CH 3-炔
CH3 CH CH C CH 3-戊烯-1-炔
若在主链两端等距离处同时遇到双键和叁键,则要从靠近
双键的一端开始编号。例如:
CH2 CH C CH
CH3 CH2 CH CH C CH
1-丁烯-3-炔
3-甲基-1-戊烯-4-炔
三 、炔烃的物理性质
炔烃的物理性质与烷烃、烯烃相似。常温下,C2~C4炔烃 是气体,C5~Cl5炔烃为液体,C16以上炔烃是固体。与烷烃和烯 烃相比,炔烃的极性略强,难溶于水,易溶于石油醚、苯、丙 酮和醚类等有机溶剂中。沸点比相应的烯烃也略高。炔烃的熔 点和沸点也随碳原子数目的增加而升高。部分炔烃的物理常数。
大学有机化学炔烃ppt课件
(2) 亲电加成反应
与溴和氯加成
B r B r B r B r 2 2 C H C C H C H C H C H C C H 3 3C 3 CCl4 B r B r CCl4 B r B r
炔烃与卤化氢加成的加成比烯烃困难。
H C l , H g C l H C l , H g C l 2 2 H C C H C H C H C l C H C H C l 2 3 2 o C 1 5 0 1 6 0 1 5 0 1 6 0
碳碳三键的组成:
乙炔分子的σ键
乙炔分子中π键的形成
碳原子轨道的 sp 杂化方式
1sp 杂化轨道 = 1/2 s + 1/2p
一个sp 杂化轨道
二个sp 杂化轨道
未参与杂化的两个p轨道的对称轴互相垂直且都垂直 于sp杂化轨道对称轴所在直线。
问题:C≡C与C=C那哪个键长度短?
CC
键 能 /k J m o l · 键 长 /n m
C H C H C H C H 3 2 2 3
C H C H 2 5 2 5 P 2 催 化 剂 C C C H C C C H + H 25 25 2 H H 9 7 %
o ( C H ) C H 2 3 3 N a , 液 N H , 7 8 3 C H C H C H C C ( C H ) C H C C 3 2 2 3 3 H C H C H 3 2 9 7 % ~ 9 9 %
A.CH3CH=CH2 C.(CH3)2C=CHCH3
B.CH3C≡CH D.CH3C≡CH3
答案:B
(二) 加成反应
加成反应——炔烃最主要的反应
C C H
炔氢的反应
(1)催化加成
R-C≡C-H + 2H2→R-CH2-CH3
大学有机化学炔烃
SP杂化:
2P2 2S2
基态
激发 2P
2S 激发态
SP杂化
P轨道 SP杂化轨道
乙炔的电子云交盖图示
HC
plane A
plane B
CH
HC
CH
杂化方式: 键角:
H
H
HC H
CH H
H H
CC
H H
SP3
SP2
109o28’
~120o
H CC H
SP 180o
碳碳键长
C-H:
轨道形状: 碳的电负性: pKa:
= 高温
(1) CH3CH CHCH3 + Cl2
?
= (2)
C2H5CH
CH2
NBS 过氧化苯甲酰
?
(3) HC CNa + (CH3)2CHCH2Br
?
① Na
(4) (CH3)2CHCH2C CH ② CH3(CH2)3Cl
?
2. 选择适当的原料合成
CH2 CH CH2 Cl Br Br
只有乙炔水合得乙醛,其他炔烃水合都得到
酮。端基炔水合得甲基酮。
HC RC
O
CH + H2O
H2SO4 HgSO4
H C CH3
O
CH + H2O
H2SO4 HgSO4
R C CH3
如何由端基炔得醛?
炔烃的硼氢化-氧化反应(间接加水)也可重排成醛、酮
RC
CH (1) B2H6
(2) OHH2O2
O
A sp2碳 负 离 子
AH
A2..K氧M化nO反4/H应+: RC≡ → RCO2H
HC≡ → CO2+H2O 可用来确定
2P2 2S2
基态
激发 2P
2S 激发态
SP杂化
P轨道 SP杂化轨道
乙炔的电子云交盖图示
HC
plane A
plane B
CH
HC
CH
杂化方式: 键角:
H
H
HC H
CH H
H H
CC
H H
SP3
SP2
109o28’
~120o
H CC H
SP 180o
碳碳键长
C-H:
轨道形状: 碳的电负性: pKa:
= 高温
(1) CH3CH CHCH3 + Cl2
?
= (2)
C2H5CH
CH2
NBS 过氧化苯甲酰
?
(3) HC CNa + (CH3)2CHCH2Br
?
① Na
(4) (CH3)2CHCH2C CH ② CH3(CH2)3Cl
?
2. 选择适当的原料合成
CH2 CH CH2 Cl Br Br
只有乙炔水合得乙醛,其他炔烃水合都得到
酮。端基炔水合得甲基酮。
HC RC
O
CH + H2O
H2SO4 HgSO4
H C CH3
O
CH + H2O
H2SO4 HgSO4
R C CH3
如何由端基炔得醛?
炔烃的硼氢化-氧化反应(间接加水)也可重排成醛、酮
RC
CH (1) B2H6
(2) OHH2O2
O
A sp2碳 负 离 子
AH
A2..K氧M化nO反4/H应+: RC≡ → RCO2H
HC≡ → CO2+H2O 可用来确定
有机化学第章炔烃和二烯烃ppt课件
总目录
π键的形成:
两个相互垂直的p轨道 分别与两个相邻碳原子 的p轨道互相重叠,形
成相互垂直的两个π键
总目录
2. 共轭二烯烃
(1)键长、键角和氢化热 键角: 约 120°(平面分子)
键长: 键长趋于平均化
总目录
氢化热:
项目 单烯烃
孤立二烯烃
共轭二烯烃
结构式
氢化热 kJ/mol
结论
125.5
预计 2×125.5 = 251 实测 254.4
分子;
CH CH
CH3 C C CH3
2)找出前体分子,考虑连接方式
CH3 C C CH3
3)写出合成反应式
总目录
思考
(1)由乙炔为原料,合成 1-丁炔 (2)由乙炔为原料,合成 3-己炔
总目录
4.
还原反应
(1)催化氢化还原
降低催化剂 活性
控制还原:
烯烃、烷烃 混合产物
毒化催化剂 降低活性
顺式还原式
总目录
超共轭
σ–π超共轭
σ - p 超共轭
总目录
二、共轭效应的特征
1. 键长趋于平均化 2. 共轭烯烃体系内能低 3. 折射率高(π电子云易极化的结果)
总目录
三、共轭效应的传递
沿共轭链传递到共轭体系末端,强度不减弱 。
总目录
四、共轭效应(静态)的相对强度
1. π-π 共轭 π 键电子云转移的方向偏向电负性强
n≥1
总目录
二、共轭二烯烃的命名
1. 命名原则与烯烃一致 标明双键数目和 位次
CH2 CH C CH2 2-甲基-1,3-丁二烯
CH3
2. 几何异构
顺,顺-2,4-己二烯 (2Z,4Z)-2,4-己二烯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、炔烃的结构 乙炔是最简单的炔烃, 为线型分子。
0.120nm 0.106nm
H-C≡C-H
炔烃的官能团是碳碳三键, 碳原子是sp杂化, 两个sp轨道在 同一条直线上。
碳碳三键的特点:
① 炔烃的亲电加成活性不如烯烃。
原因:两个碳原子之间电子云密度大; C-C键长短, 使π键的重叠程度大; 两个π键形成的圆柱型电子云不易极化。
反应、聚合反应, 但也有一定特殊性。 CH3–CH3 50
sp杂化控制电子的能力更强, 亲电加成反应稍慢于双键.
1、还原反应
1)催化加氢 (不同催化剂, 不同产物)
① 高活性催化剂 (Ni、Pt、Pd等) (生成烷烃)
H2
H2
R C CH 催化剂 R CH CH2 催化剂 RCH2CH3
CH3CCCH3 +H2 Pt CH3CH2CH2CH3
HBr
CH3 C CH ROOR CH3 CH CHBr
③ 与水加成
CH≡CH + H-OH
HgSO4 H2SO4
OH 重排
O
CH2=CH 异构化CH3–C–H
乙烯醇
乙醛
OH
互变异构
O
—C=C— (烯醇式)
—C—C— (酮式)
平衡倾向于酮式
RC≡CH + H-OH
OH
HgSO4 H2SO4
RC=CH2 重排
炔烃加水也符合马氏规则
O
R–C–CH3
甲基酮
只有乙炔水合得乙醛; 端基炔水合得甲基酮; 非末端炔烃 两种酮的混合物。
3、硼氢化反应 (了解)
炔烃的硼氢化反应, 可以停留在含双键的阶段为顺式构型。
CCHHH3C3
CH2 CH CH C CH
7 6 54 3 2 1
CH2=CH-CH-CH=CH–CH =CH2
C CH3
C CH
CH2
5-乙炔基-1, 3, 6-庚三烯 2-甲基-3-乙炔基-1,4-戊二烯
二、物理性质
1、炔烃分子短小、细窄, 在液态及固态中彼此很靠近, 分子间作用力强, 故熔点、沸点和密度较大。
① 与卤素加成
首先生成二卤化物, 为反式加成, 继续和卤素作用生成
四卤化物。
Br2
RC CR
Br
+
RC CR
Br-
Br
R
CC
RHale Waihona Puke BrBr Br Br2 R C C R
Br Br ——溴水褪色, 可用于鉴别。
注意: 分步进行 反式产物
加氯时, 必须用FeCl3作催化剂。
Cl Cl
CH CH
Cl2 FeCl3
X
X
CH
CH
HCl HgCl2 , 120℃
CH2
CH Cl
注:加HCl时, 需在 HgCl2 催化下进行。当HCl不过量 时, 可使反应停留在一分子加成阶段。
CH3 C C CH3
HCl HgCl2
CH3 C
Cl
H
C 反式产物
CH3
烯炔加卤化氢时, 一般首先先在双键上进行加成。
HBr CH C CH2 CH CH2 注意特殊情况 (重点): CH≡C–CH=CH2 + HBr 此反应说明了什么?
② 碳碳三键上的氢 (炔-H) 有一定的酸性。
原因:电负性Csp> Csp2> Csp3, 使C-H键极性增强。
二、炔烃的异构和命名
炔烃的异构现象, 是由碳链不同或三键的位置不 同而引起的; 炔烃没有顺反异构。
炔烃的命名(略);
注意: 烯炔类化合物若有等不饱和键和等碳原子数时,
以双键多的链为主链:
H
H
2、亲电加成 (X2、HX、H2O及硼氢化)
炔烃可以发生亲电加成, 但比烯烃的亲电加成难。
例如, 烯烃可使溴的CCl4溶液立刻褪色; 炔烃却需要 几分钟才能使之褪色, 乙炔甚至需在光或三氯化铁 催化下才能加溴。
主要原因 ① 炔烃π电子的可极化性比烯烃小; ② 叁键的键能比双键大; ③ 炔烃是sp杂化, 键长短。
CH2 CH C CH + Br2
CH2 CH C CH
共轭加成!
Br Br
原因: 当烯炔为共轭烯炔时 (双键和三键形成π-π共轭), 结构更稳定。为保留π-π共轭稳定结构, 加成首先发生 在叁键上。
② 与氢卤酸加成
活性:HI>HBr>HCl>HF
亲电加成加成产物符合马氏规则。
X R C CH HX R C CH2 HX R C CH3
第三章:烯烃、炔烃和二烯烃
CH≡CH CH2=CH—CH=CH2
炔烃和多烯烃的命名; 炔烃和共轭二烯烃的结构及化学性质; 炔烃的制法, 重要的炔烃和二烯烃; 共轭体系及共轭效应; 理解速度控制和平衡控制的概念。
炔烃的命名和化学性质, 炔烃的制备; 共轭的定义和应用, 共轭二烯烃的性质。
3.3 炔烃
CH≡C–CH=CH2 + H+
共轭加成!
CH C CH2 CH CH3 Br
H Br
CH=C–CH=CH2 H Br
CH≡C–CH–CH2
H+
CH=C–CH=CH2 √
+H CH≡C–CH–CH2
×
➢ HBr自由基加成 (过氧化物效应, 重要)
加HBr时, 也有过氧化物效应, 反马氏自由基加成。
短小 细长
键长: C≡C
C-C 0.154 nm C=C 0.134 nm C≡C 0.120 nm 直线型
三、炔烃的化学性质
加成反应 氧化反应 聚合反应
CCH
酸性
pKa H2O 15.7
CH≡CH 25
三键与双键都是不饱和键, 反应相似:
NH3 34
加成反应 (催化加氢、亲电加成), 氧化 CH2=CH2 44
HCCH
催化加氢时, 炔烃比烯烃快, 为什么?
② 林德拉(Lindlar)试剂 (重点) (得顺式烯烃)
RC
C R + H2
Pd/CaCO3 Pb(Ac)2
R
R
CC
H
H
CH3 C
C CH3
H2
林德拉试剂
CH3
CH3
CC
H
H
烯炔加氢时, 炔键先被氢化。
CH2=CH–CCH +H2
Pd-BaSO4 喹啉
Cl H
CC
H Cl2 Cl FeCl3
HC
CH
Cl Cl
由于卤素具有-I效应, 反应可以停留在二卤化物阶段。
❖ 烯炔加卤素时, 一般首先加在双键上。
CCHH22 CCHHCCHH22CC CCHH BBrr22 CCHH22 CCHHCCHH22CC CCHH BBrr BBrr
注意特殊情况 (重点):
CH2=CH–CH=CH2
2)碱金属还原 (得反式烯烃)
在液氨中用Na或Li还原炔烃, 主要得反式烯烃。
R C C R Na-NH3(l ) R C C H
H
R
CH3-C≡C-CH3
Na / 液NH3
H C=C CH3
CH3 H
反-2-丁烯
Pd /CaCO3 CH3 C=C CH3 顺-2-丁烯
H2
0.120nm 0.106nm
H-C≡C-H
炔烃的官能团是碳碳三键, 碳原子是sp杂化, 两个sp轨道在 同一条直线上。
碳碳三键的特点:
① 炔烃的亲电加成活性不如烯烃。
原因:两个碳原子之间电子云密度大; C-C键长短, 使π键的重叠程度大; 两个π键形成的圆柱型电子云不易极化。
反应、聚合反应, 但也有一定特殊性。 CH3–CH3 50
sp杂化控制电子的能力更强, 亲电加成反应稍慢于双键.
1、还原反应
1)催化加氢 (不同催化剂, 不同产物)
① 高活性催化剂 (Ni、Pt、Pd等) (生成烷烃)
H2
H2
R C CH 催化剂 R CH CH2 催化剂 RCH2CH3
CH3CCCH3 +H2 Pt CH3CH2CH2CH3
HBr
CH3 C CH ROOR CH3 CH CHBr
③ 与水加成
CH≡CH + H-OH
HgSO4 H2SO4
OH 重排
O
CH2=CH 异构化CH3–C–H
乙烯醇
乙醛
OH
互变异构
O
—C=C— (烯醇式)
—C—C— (酮式)
平衡倾向于酮式
RC≡CH + H-OH
OH
HgSO4 H2SO4
RC=CH2 重排
炔烃加水也符合马氏规则
O
R–C–CH3
甲基酮
只有乙炔水合得乙醛; 端基炔水合得甲基酮; 非末端炔烃 两种酮的混合物。
3、硼氢化反应 (了解)
炔烃的硼氢化反应, 可以停留在含双键的阶段为顺式构型。
CCHHH3C3
CH2 CH CH C CH
7 6 54 3 2 1
CH2=CH-CH-CH=CH–CH =CH2
C CH3
C CH
CH2
5-乙炔基-1, 3, 6-庚三烯 2-甲基-3-乙炔基-1,4-戊二烯
二、物理性质
1、炔烃分子短小、细窄, 在液态及固态中彼此很靠近, 分子间作用力强, 故熔点、沸点和密度较大。
① 与卤素加成
首先生成二卤化物, 为反式加成, 继续和卤素作用生成
四卤化物。
Br2
RC CR
Br
+
RC CR
Br-
Br
R
CC
RHale Waihona Puke BrBr Br Br2 R C C R
Br Br ——溴水褪色, 可用于鉴别。
注意: 分步进行 反式产物
加氯时, 必须用FeCl3作催化剂。
Cl Cl
CH CH
Cl2 FeCl3
X
X
CH
CH
HCl HgCl2 , 120℃
CH2
CH Cl
注:加HCl时, 需在 HgCl2 催化下进行。当HCl不过量 时, 可使反应停留在一分子加成阶段。
CH3 C C CH3
HCl HgCl2
CH3 C
Cl
H
C 反式产物
CH3
烯炔加卤化氢时, 一般首先先在双键上进行加成。
HBr CH C CH2 CH CH2 注意特殊情况 (重点): CH≡C–CH=CH2 + HBr 此反应说明了什么?
② 碳碳三键上的氢 (炔-H) 有一定的酸性。
原因:电负性Csp> Csp2> Csp3, 使C-H键极性增强。
二、炔烃的异构和命名
炔烃的异构现象, 是由碳链不同或三键的位置不 同而引起的; 炔烃没有顺反异构。
炔烃的命名(略);
注意: 烯炔类化合物若有等不饱和键和等碳原子数时,
以双键多的链为主链:
H
H
2、亲电加成 (X2、HX、H2O及硼氢化)
炔烃可以发生亲电加成, 但比烯烃的亲电加成难。
例如, 烯烃可使溴的CCl4溶液立刻褪色; 炔烃却需要 几分钟才能使之褪色, 乙炔甚至需在光或三氯化铁 催化下才能加溴。
主要原因 ① 炔烃π电子的可极化性比烯烃小; ② 叁键的键能比双键大; ③ 炔烃是sp杂化, 键长短。
CH2 CH C CH + Br2
CH2 CH C CH
共轭加成!
Br Br
原因: 当烯炔为共轭烯炔时 (双键和三键形成π-π共轭), 结构更稳定。为保留π-π共轭稳定结构, 加成首先发生 在叁键上。
② 与氢卤酸加成
活性:HI>HBr>HCl>HF
亲电加成加成产物符合马氏规则。
X R C CH HX R C CH2 HX R C CH3
第三章:烯烃、炔烃和二烯烃
CH≡CH CH2=CH—CH=CH2
炔烃和多烯烃的命名; 炔烃和共轭二烯烃的结构及化学性质; 炔烃的制法, 重要的炔烃和二烯烃; 共轭体系及共轭效应; 理解速度控制和平衡控制的概念。
炔烃的命名和化学性质, 炔烃的制备; 共轭的定义和应用, 共轭二烯烃的性质。
3.3 炔烃
CH≡C–CH=CH2 + H+
共轭加成!
CH C CH2 CH CH3 Br
H Br
CH=C–CH=CH2 H Br
CH≡C–CH–CH2
H+
CH=C–CH=CH2 √
+H CH≡C–CH–CH2
×
➢ HBr自由基加成 (过氧化物效应, 重要)
加HBr时, 也有过氧化物效应, 反马氏自由基加成。
短小 细长
键长: C≡C
C-C 0.154 nm C=C 0.134 nm C≡C 0.120 nm 直线型
三、炔烃的化学性质
加成反应 氧化反应 聚合反应
CCH
酸性
pKa H2O 15.7
CH≡CH 25
三键与双键都是不饱和键, 反应相似:
NH3 34
加成反应 (催化加氢、亲电加成), 氧化 CH2=CH2 44
HCCH
催化加氢时, 炔烃比烯烃快, 为什么?
② 林德拉(Lindlar)试剂 (重点) (得顺式烯烃)
RC
C R + H2
Pd/CaCO3 Pb(Ac)2
R
R
CC
H
H
CH3 C
C CH3
H2
林德拉试剂
CH3
CH3
CC
H
H
烯炔加氢时, 炔键先被氢化。
CH2=CH–CCH +H2
Pd-BaSO4 喹啉
Cl H
CC
H Cl2 Cl FeCl3
HC
CH
Cl Cl
由于卤素具有-I效应, 反应可以停留在二卤化物阶段。
❖ 烯炔加卤素时, 一般首先加在双键上。
CCHH22 CCHHCCHH22CC CCHH BBrr22 CCHH22 CCHHCCHH22CC CCHH BBrr BBrr
注意特殊情况 (重点):
CH2=CH–CH=CH2
2)碱金属还原 (得反式烯烃)
在液氨中用Na或Li还原炔烃, 主要得反式烯烃。
R C C R Na-NH3(l ) R C C H
H
R
CH3-C≡C-CH3
Na / 液NH3
H C=C CH3
CH3 H
反-2-丁烯
Pd /CaCO3 CH3 C=C CH3 顺-2-丁烯
H2
