炔烃
4炔烃

炔烃1.炔烃:为分子中含有碳碳三键的碳氢化合物的总称,其官能团为碳-碳三键(C≡C),分子通式为CnH2n-2,是一种不饱合的碳氢化合物。
2.炔烃物理性质炔烃的熔沸点低,密度小,难溶于水,易溶于有机溶剂。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些.不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。
炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。
工业中乙炔被用来做焊接时的原料。
在正炔烃的同系列中,C2~C4的炔烃是气体,C5~C15的是液体,C15以上的是固体。
炔烃的熔点和沸点也随着碳原子数目的增加而增高。
(注:乙炔不纯时,含有H2S,PH3杂质气体,有臭味)3炔烃化学性质炔烃的化学活性比烯烃弱。
炔烃的官能团是--C≡C--,其化学性质与烯烃有不少相似之处,例如能发生加成、氧化和聚和反应等。
(1)氧化反应炔烃能使高锰酸钾和浓溴水褪色(2)加成反应①加氢:R-C≡C-R'+2H2→RCH2CH2R'CH3≡CCH3+H2→CH3-CH=CH-CH3(顺式)CH3≡CCH3+Na+NH3(l)→CH3-CH=CH-CH3(反式)②加卤素:R-C≡CH可生成相应的卤代烯和卤代烷③加卤化氢:R-C≡CH+HX→R-CX=CH2R-CX=CH2+HX→R-CX2-CH3(3)聚合反应炔会发生聚合反应:炔会发合成苯:3HC≡CH→(苯环)4.乙炔:俗称风煤、电石气,最简单的炔烃,是炔烃化合物系列中体积最小的一员,主要作工业用途,特别是烧焊金属方面。
乙炔在室温下是一种无色、极易燃的气体。
纯乙炔是无臭的,但工业用乙炔由于含有硫化氢、磷化氢等杂质,而有一股大蒜的气味。
分子式CH≡CH,化学式C2H2,电子式:H:C:::C:H ,C-C键中间是六个点,分两列,每列三个—H:C:::C:H ,分子空间构型为直线型非极性分子。
5.乙炔的物理性质纯乙炔为无色无味的易燃、有毒气体。
有机化学 第四章 炔烃
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
炔烃

炔烃(CnH2n-2)
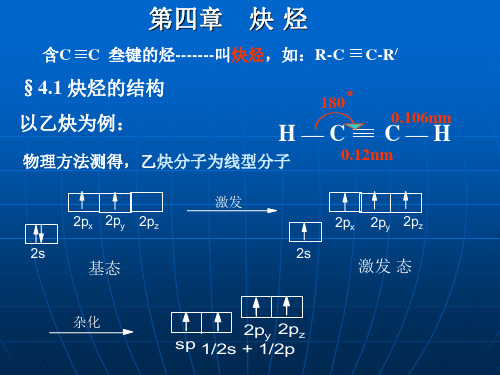
一、炔烃的分子结构 ( 以乙炔为例 )
碳的杂化:
杂化 2s 2p sp 2p
sp3
sp2
sp
H
C
C
H
sp杂化的碳原子含有较多的S成分 (50%),电负性较sp2、sp3强。
二、异构和命名 *异构 :
官能团异构、碳链异构、位置异构。
*命名:
原则与烯烃相同,但分子中同时含叁键和双键时:
1、结构(以 CH2=CH - CH=CH2 为例)
H H
———
C
C H
H
———
———
C
C
H H
H H
———
形成大π键 ↓ π 电子离域 ↓
H H
0.135 C CH
0.135 CH C 0.148
键长趋于平均化
↓ 共轭体系
2、共轭效应
在1,3-丁二烯中四个p轨道相邻且平行,
互相交盖,π电子不再局限于两个碳原子之 间运动,而离域到整个体系,使键长平均化, 内能降低,这样产生的效应叫
碳相连的氢容易给出而具有酸性。
1、金属炔化物的生成
CH CH + Ag(NH3)2NO3 AgC CAg↓
CHBiblioteka CH +Cu(NH3)2 Cl
CuC
CCu ↓
Na CH CH NH3(l) CH CNa
Na NaC
190~220℃
CNa
注意:
H R R C C C C C C H H R AgC RC CAg CAg
CO2 + H2O
RC
CH
RCOOH + CO2 + H2O
炔烃

(S)-7-甲基环辛烯-3-炔 (S)-7-methylcycloocten-3-yne
4,8-壬二烯-1-炔
4,8-nonadien-1-yne
6.2
炔烃的结构
炔烃的结构特征是分子中含有“ C≡C ”,它与 “ C=C ”一样是由键和键构成,下面以乙炔为 例说明叁键的形成及结构,乙炔为一直线型分子, 全部四个原子在同一直线上,在乙炔分子中 0.1061nm
R
X2
R
C
CH
Cl2
X2
R
CHCl2
C X
CH X CHCl2
HC
CH
黑暗
CHCl
CHCl
黑暗
这一反应如在光照的情况下,反应剧烈并爆炸。 所以盛乙炔气、氯气的钢瓶要分开存放,以确保 安全。炔烃和溴也可以发生类似反应,反应现象 为Br2的红棕色褪去,故可用于炔烃的鉴别。
炔烃 26
有机化学
加 X2
HC
C2H5NH2
蓝色溶液
*2 反应体系不能有水,因为钠与水会发生反应。
*3 与制NaNH2的区别 Na + NH3 (液)
Fe3+
NaNH2
炔烃的加氢和还原
H2/Ni, or Pd, or Pt H2/ Pd-CaCO3 or Pd-BaSO4 orNiB
RCH2CH2R’
R H R H
C C
C C
R' (>90%) H R' H
R-CC-R’
硼氢化
RCOOH ~0oC
R H R H
C C
H R' H R'
(90%)
Na, NH3
(82%)
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
第二节 炔烃的结构
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
炔烃

炔烃1.基本性质 1.1概述1.定义 分子里有碳碳三键的不饱和链烃叫做炔烃。
2.通式 C n H 2n-2(n ≥2) ,炔烃与二烯烃、环烯烃为同分异构体(类别异构)。
3.乙炔(1)结构:分子式C2H2,结构式为H -C ≡C -H ,直线型分子,键角180°。
(2)物理性质:纯净的乙炔是无色、无臭气体,比空气轻,微溶于水,易溶于有机溶剂。
(3)乙炔的实验室制法: 4.炔烃通性(1)随着碳原子数的增加,熔沸点逐渐升高,相对密度逐渐增大。
(2)碳原子数小于或等于4的炔烃,在常温下均为气体,其他的炔烃为液体或固体。
(3)炔烃不溶于水,易溶于有机溶剂。
2.性质应用2.1乙炔的实验室制法 (1)化学反应原理CaC 2+2H 2O −−→HC ≡CH ↑+Ca(OH)2 说明:碳化钙(CaC 2)属于离子型碳化物,它遇水可水解,即碳化钙中的钙离子跟H 2O 中的OH -生成氢氧化钙,伴随产生的H+与碳化物中的碳负离子结合成相应的烃。
即CaC 2+2H -OH −−→HC ≡CH ↑+Ca(OH)2 同理:ZnC 2+2H -OH −−→HC ≡CH ↑+Z n (O H )2 Al 4C 3+12H -OH −−→3CH 4↑+Al(OH)2 (2)仪器装置设计从物质的状态、反应条件等方面看,以电石跟水反应制备乙炔气体的反应属于“固+液−−−→常温气”的类型,与实验室中以Zn 和H2SO4稀溶液制备H2的反应类型相同。
因此,制乙炔气体可采用“制氢简易装置”。
(3)实验操作步骤设计该实验与大多数制备实验相似,操作步骤为:连接各仪器为整套装置;检验装置的气密性;将化学药品加到各仪器中去;使反应物混合;收集气体。
(4)应注意的问题①由于CaC 2与H 2O 的反应太剧烈,即便是CaC 2与H 2O 蒸气接触,它们也能顺利地反应,反应又是放热的,所以实验中要获得平稳的乙炔气流,主要措施有:a.以饱和NaCl 溶液代替水;b.通过分液漏斗向广口瓶中加水(或饱和NaCl 溶液)时,要慢、要少。
有机化学-炔烃

b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
05炔烃
sp的特点
① sp的形状类似于sp3和sp2,呈葫芦形 ②sp的能量介于s和p轨道之间; ③方向性:两个sp杂化轨道在同一条直线上;
④剩余的两个未参与杂化的p轨道,互相垂直,且均与两个sp 杂化轨道所在的直线垂直。
5)电负性: sp3 < sp2 < sp
(5) 总结 •碳碳叁键是由一个 键和两个 键 组成. •键能—乙炔的碳碳叁键的键能是:837 kJ/mol; 乙烯的碳碳双键键能是:611 kJ/mol; 乙烷的碳碳单键键能是:347 kJ/mol. •C-H键长—和p轨道比较, s轨道上的电子云更接近原 子核.一个杂化轨道的s成分越多,则在此杂化轨道上的 电子也越接近原子核.由sp杂化轨道参加组成共价键 , 所以乙炔的 C-H 键的键长 (0.106 nm) 比乙烯 (0.108 nm)和乙烷(0.110nm)的C-H键的键长要短. •碳碳叁键的键长—最短(0.120 nm),这是除了有两个 键,还由于 sp 杂化轨道参与碳碳键的组成.
CH3 Br C=C H H
(3) 和水的加成 CHCH + H2O
H2SO4 HgSO4
HO H2C=CH
RCCH + H2O
记住反应 条件!
H2SO4 HgSO4
H 分子重排 CH3-C=O 乙醛 OH O 分子重排 R-C=CH2 R-C-CH3 烯醇式化合物 酮
为什么发生重排? CH2=C-OH CH3-C=O H H •乙 醛 的 总 键 能 2 7 4 1 kJ/mol 比 乙 烯 醇 的 总 键 能 2678kJ/mol大,即乙醛比乙烯醇稳定. •由于两者能量差别不大 (63kJ/mol),在酸存在下 ,它们中 间相互变化的活化能很小.
(3) 乙炔的键
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H
C
C
H
两个相互垂直的2p轨道,其 对称轴两两相互平行,进行 侧面交盖, 形成两个π键。
在乙炔分子中,两个π键的π电子 云分布在C-Cσ键的四周,呈圆柱形。 碳碳双键不能自由旋转,π电子云具有 较大的流动性,易于发生极化。
乙炔分子比例模型
乙炔分子的结构
乙炔π键的电子云分布
炔烃的同分异构
C5H8:
CH3CH2CH2C CH CH3CHC CH CH3CH2C CCH3
1–戊炔
3 –甲基–1–丁炔
CH3
2–戊炔
构造异构
碳架异构 官能团位次异构
炔烃的命名
(1) 衍生命名法 • 以乙炔为母体
• 将其它烯烃分别看作乙炔的衍生物
• 取代基名称按“次序规则”,放在母体名
称之前。
CH3CH2C CCH3
H2O / CH2=CHCH2C≡ CH HgSO4/H2SO4 H2O / H2SO4 O CH2=CHCH2C-CH3
CH3CHCH2C≡CH OH
亲核加成反应
与烯烃相比,炔烃不容易进行亲电加成
反应,但炔烃容易与含活泼氢的试剂进行亲 核加成反应。
δ δ δ H C C R + Nu δ E
E
H C C R Nu
Markovnikov规则:
当不对称烯烃与卤化氢加成时,氢原 子加在烃基取代较少的不饱和碳上,卤原 子加在烃基取代较多的碳原子上。
HCI
H3C C C CH3
CI HCI H3C C C H CH3
CI CH3CH2C CH3 CI
反应活性:HI > HBr > HCl
乙炔加HCl需要有催化剂才能顺利反 应,是合成氯乙烯的工业方法:
Br
CH3
(控制 加成)
反-2,3-二溴-2-丁烯
CH3C CCH3+ 2 Br2
20℃ CCI4
CH3CBr2 CBr2CH3
2,2,3,3-四溴丁烷
炔烃的亲电加成反应的活性较烯烃弱。 分子中同时含有三键和双键时,加入限 量的溴,优先加在双键上:
HC C CH2 CH CH2 + Br2
1-戊烯-4-炔
键在中间的炔烃比叁键在末端的炔烃的沸点和熔
点都高。
炔烃的相对密度小于1。
炔烃难溶于水,而易溶于石油醚、苯、四氯
化碳等有机溶剂。
炔烃的化学性质
亲电加成
加成 亲核加成
R
C
C
H
炔氢酸性
氧化
炔氢的反应
炔氢:与三键碳直接相连的氢称为炔氢。由于 三键的影响这个氢有一定的酸性。
1. 炔氢的酸性
Csp-H的键是一个极性σ 键,电子偏向Csp端,炔 氢有酸性。
O CH CH + CH3COOH
KOH 150~158℃
CH2
CH O C CH3
氧化反应
( 1 ) 高锰酸钾氧化 炔烃被KMnO4氧化与烯烃相似。
1
CH3(CH2)3C CH
KMnO4/OH CH3(CH2)3COOH + CO2 + 2 H
+ H 2O
此反应可用于炔烃结构的鉴定。
(2) 臭氧化 炔烃与臭氧反应,生成羧酸或CO2
H C C H
Ka
H C C + H
(碳负离子) 共轭碱
。 HC≡CH + 2Na 220 C NaC≡CNa
HC
C H + Na NH2
NH3(液)
H
C
C Na + NH3
弱酸
强碱
强碱
弱酸
乙炔、端炔烃能与硝酸银或氯化亚铜的氨溶液 反应,生成白色炔化银或砖红色炔化铜沉淀,可 用来鉴定乙炔和端炔的存在:
1,5-已二烯-3-炔
乙烯基乙炔与HCl反应合成氯代丁二烯,后 者是氯丁橡胶单体。
环三聚:
3 HC CH
WCI6
该反应曾对于证明苯的结构很有意义 环四聚:
4 HC CH
Ni(CN)2
环辛四烯
端炔环三聚:
R C CN
"Ni"
R
R R
+
R R R
两种取代苯的比例取决于催化剂的种类
b. 乙炔的高聚反应
钝化催化剂: ①Lindlar催化剂 [Pd+Pb(OOCCH 3) 4]/CaCO 3 ②Cram催化剂 [Pd+ ]/BaSO 4 N ③Brawn催化剂 Ni(OOCCH 3) 2+NaBH 4 NiB (又称P-2催化剂)
用途:a.制备顺式烯烃。 b.净化聚乙烯单体中微量乙炔。
• 加氢反应活性 炔烃:R C CH > R C C R
HC C CH2 CHBrCH2Br
4,5-二溴-1-戊炔
(95%)
卤素: F2 > Cl2 > Br2 > I2
(3) 与水加成(烯烃的直接水合法 )
炔烃加水反应需在硫酸汞的硫酸溶液催化 下进行:
HgSO4-H2SO4 HC CH + H2O 98-105℃
HC CH H OH
乙烯醇
重排
CH3CHO
炔烃比烯烃更容易进行催化加氢,当分子 中同时存在 C C 和 C C 时,催化 氢化首先发生在三键上。
CH3 HC C C
Pd–CaCO3 CHCH2CH2OH + H2 喹啉 80%
CH3 H2C CH C CHCH2CH2OH
反式部分加氢: 金属Na或Li在液氨中还原炔烃得反式烯烃
CH3CH2C C(CH2)3CH3
乙醛
是工业合成乙醛的方法之一。
不对称炔烃与H2O的加成符合
Markovnikov规则。
含三碳以上的炔烃加水都生成酮。
Hg2+/H+
CHCH2CH2CH2C CH +H2O
CH3CH2CH2CH2C
CH
OH H
重排
CH3CH2CH2CH2CCH3 甲基酮 O
与水加成 在硫酸催化条件下烯烃比炔烃快; 在硫酸汞催化条件下炔烃比烯烃快。
CH3COOH,25℃
炔烃与HBr加成也能按自由基机理进行, 得到反马氏规则产物:
CH3C CH + HBr CH3CH CH + CH3C CH2 Br
1-溴丙烯(88%)
Br
2-溴丙烯(12%)
(2)加卤素反应 炔烃与溴加成也是反式加成:
CH3C CCH3 + Br2
-20℃ 乙醚
H3C C C Br
在齐格勒-纳塔催化剂作用下,乙炔能聚合成高 聚物——聚乙炔。
nHC CH
Ti/AI
( CH CH ) n
H C C H
H H C C
C C H H
H C C H
H C C H H C C H C C H H
反-聚乙炔
顺-聚乙炔
聚乙炔分子具有较好的导电性,故称为“合成 金属”,是有机导体。
sp 杂化碳原子的两个 sp 杂化轨道对 称轴间的夹角为180°, 未参与杂化的两个 p 轨道的对称轴相互垂直。
sp 杂化轨道成直线形的几何构型。
在乙炔分子中: C-Cσ键的形成: C-Hσ键的形成:
sp–sp 交盖 sp–1s 交盖 两个π键的形成: 成键的两个C原子上各有
三个σ键, 其对称轴处于同一直线上。
HC CH +2[Ag(NH3)2]
+ +
AgC CAg +2NH4+2NH3 RC CCu + 2NH4+2NH3
演 示
+
RC CH+2 [Cu(NH3)2]
+
干燥的炔化银、炔化铜易爆炸,使用完 毕加酸使其分解 。
AgC CAg + HCl CuC CCu + HCl
HC CH + AgCl
HC CH + Cu2Cl2
(CH3)2CHC CH
甲基乙基乙炔
异丙基乙炔
(2) 系统命名法
• 确定母体
选择含碳碳叁键在内的连续最长碳链作为母
体,根据其碳原子的个数称 “某炔”。 • 编号 使碳碳叁键的编号最小; • 写出取代基的位次、数目、名称
CH3CC CCH2CH3 CH3
2 –甲基–3–己炔
★
分子中同时含有双键和叁键,应选择含 有双键和叁键的最长碳链为主链,命名 为“ 烯炔 ”。
↑ ↑
Hale Waihona Puke 还原反应催化加氢 炔烃加氢反应也需要催化剂,可以加一 分子氢,也可以加两分子氢。 催化剂:Pt, Pd, Ni
R C C R' + H2
Ni H2
R
CH
CH
R'
RCH2CH2R'
如果使用钝化催化剂,可以得到 顺式烯烃: CH3CH2 CH2CH3
CH3CH2C CCH2CH3 + H2 钝化催化剂 H C C H
乙烯
环己烯
乙炔
官能团
C C C C
烯烃的通式:CnH2n 炔烃的通式:CnH2n-2
炔烃碳碳三键的组成 激发态 基态
2p
电子 跃迁
sp 杂化态
2p
杂化
2p
sp 1s
2s 1s
2s
1s
sp 杂化轨道形成过程示意图
两个sp 杂化轨道
每个sp杂化轨道: 50% 的 s 轨道的成分, 50% 的 p 轨道的成分。
HC CH + HCI
HgCI2/C
H2C CHCI
溴化氢也能与炔烃加成:
CH3CH2CH2CH2C CH + HBr 无水 Fe
