硅及其化合物化学方程式- 公开课
高中化学人教版必修1第四单元第1课《无机非金属材料的主角—硅》优质课公开课教案教师资格证面试试讲教案

高中化学人教版必修1第四单元第1课《无机非金属材料的主角—硅》优质课公开课教案教师资格证面试试讲教案1教学目标
(一)知识与技能
1.通过水泥、陶瓷、玻璃初步了解硅酸盐的重要用途及组成。
2.通过实验掌握Na2SiO3的防火性等性质。
3.初步了解硅单质的性质及用途。
(二)过程与方法
1.通过上网查阅硅的相关资料学会查阅资料的基本方法。
2.通过交流展示活动,培养表达与交流的能力、养成合作学习的精神。
(三)情感、态度与价值观
通过了解玻璃等材料的发展现状、硅在信息科学等领域的应用,认识化学对于生活生产的积极意义,从而提升学习化学的热情。
2学情分析
在学习本节课之前,学生已经了解了硅在信息产业中的一些应用,但是对于硅单质及其化合物的性质并没有太多的理解
3重点难点
重点:硅酸盐的性质及重要用途、硅的用途
难点:硅酸盐的盐氧化物写法的书写
4教学过程
4.1第一学时
教学活动
1【讲授】第一学时
教学环节一:硅酸盐的性质及用途
【导入新课】通过刚才的视频,我们初步了解了普通的沙子如何变成了高端的芯片,这就是化学的魅力。
其实,化学对于人们生活的影响,远远不止于此。
比如,我们以前居住的房屋是茅庐,而现在我们的居住环境得到了很大的改善,这都得益于化学及其他科学的发展。
【提问】这幢建筑中,涉及到了哪些材料?
【学生】水泥、玻璃、陶瓷、钢筋等。
【教师】水泥、玻璃、陶瓷是使用量最大的无机非金属材料,那我们一起来了解一下。
【图表】硅酸盐产品。
人教版高中化学必修一4.1.1硅及其化合物(共21张PPT)优秀课件

(二)硅的化学性质
硅的许多化学性质与碳相似,常温下较稳定,不与O2、Cl2、 硫酸、硝酸等反应。加热时,能与O2、Cl2等反应
常温下与强碱反应
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
(了解) 加热时,能与O2、Cl2等反应
△
Si + O2 == SiO2
△
Si + 2Cl2 == SiCl4
思考:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
分析以上制取原理,若将CO2通入 Na2SiO3溶液中 有何现象?
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓
(2)化学性质 硅酸是不溶于水的极弱酸,酸性弱于碳酸,不能使酸碱
指示剂变色。
H2SiO3 + 2NaOH= Na2SiO3 + 2H2O H2SiO3=Δ= SiO2 + H2O
与碱性氧 化物反应 与碱反应
与水反应
CO2 + CaO=CaCO3
CO2 +2NaOH= Na2CO3+H2O
CO2 + H2O=H2CO3
CaO+SiO2 高温 CaSiO3
SiO2 +2NaOH= Na2SiO3+H2O
不反应
特性:
①不能与水反应生成硅酸。 ②能与氢氟酸反应 SiO2 + 4HF = SiF4↑+ 2H2O
Si无单质状态
(1) 硅和碳一样,其原子既不易失去电子,也不易得到电子, 所以硅和碳主要形成四价化合物。
(2)碳和硅都是亲氧元素,但是硅的亲氧能力更强。
碳的单质
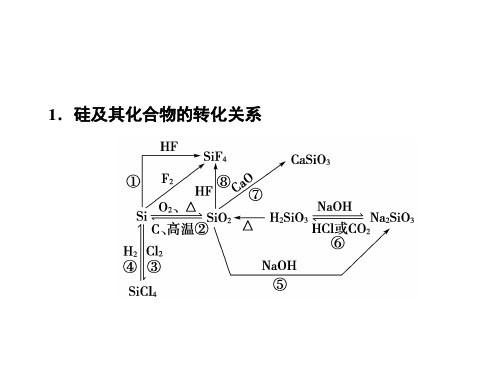
高三化学方程式总结:硅及其化合物方程式

方程式6 硅及其化合物方程式1. Si与氧气反应的化学方程式:Si + O2高温SiO22.Si与氟气反应的化学方程式:Si + 2F2∆SiF43. Si与Cl2反应的化学方程式:Si + 2Cl2高温SiCl44. Si与NaOH溶液反应化学方程式:Si + 2NaOH + H2O =Na2SiO3 + 2H2 ↑离子方程式:Si + 2OH- + H2O =SiO32- + 2H2 ↑5.Si与HF反应化学方程式:Si + 4HF = SiF4↑ + 2H2↑6.工业制粗硅的化学方程式:SiO2 + 2C高温Si + 2CO↑7.工业由SiCl4制纯硅的化学方程式:SiCl4 + 2H2高温Si + 4HCl8.SiO2与氢氟酸反应的化学方程式:SiO2 + 4HF = SiF4↑ + 2H2O9.SiO2与碱性氧化物(CaO)反应的化学方程式:SiO2 + CaO 高温CaSiO310.SiO2与石灰石反应的化学方程式:S iO2 + CaCO3高温CaSiO3 + CO2↑11.SiO2与强碱NaOH溶液反应的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O离子方程式:SiO2 + 2OH -= SiO32-+ H2O12.工业制玻璃的两个反应化学方程式:SiO2 + CaCO3高温CaSiO3 + CO2↑SiO2 + Na2CO3高温Na2SiO3 + CO2↑13.H2SiO3与强碱NaOH溶液的反应:化学方程式:H2SiO3+2NaOH=Na2SiO3+ H2O离子方程式:H2SiO3+2OH-=SiO32-+ H2O14.硅酸的热稳定性很弱,受热分解:化学方程式:H2SiO3∆H2O + SiO215.向硅酸钠溶液中通入足量的CO2的反应:化学方程式:Na2SiO3 + 2CO2 + 2H2O =H2SiO3↓+2NaHCO3离子方程式:SiO32- + 2CO2 + 2H2O =H2SiO3↓+2HCO3-16.向硅酸钠溶液中通入少量的CO2的反应:化学方程式:Na2SiO3 + CO2 + H2O=H2SiO3↓+Na2CO3离子方程式:SiO32- + CO2 + H2O=H2SiO3↓+CO32-17. 向硅酸钠溶液中滴加稀盐酸的反应:化学方程式:Na2SiO3 + 2HCl =H2SiO3↓+2NaCl离子方程式:SiO32- + 2H+=H2SiO3↓方程式7 铝及其化合物方程式1.铝在氧气中燃烧化学方程式4Al + 3O2点燃2Al2O32.铝在氯气中燃烧化学方程式2Al + 3Cl2点燃2AlCl33.铝与硫共热化学方程式2Al + 3S2AlCl34.铝和盐酸反应化学方程式2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式2Al + 6H+ = 2Al3++ 3H2↑硅、铝方程式1。
硅及其化合物复习课件
(3)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体 最好选择________。
a.蒸馏水 b.饱和 Na2SO3 溶液 c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液
实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是________。 已知反应(Ⅲ)相对较慢,则烧瓶 C 中反应达到终点的现象是
(4)Na2S3O3 和 Na2SO3 的存在对 SO24-的检验有干扰,要先除 去。根据题给信息,可先加入过量的稀盐酸将二者除去。
【答案】 (1)液柱高度保持不变 防止倒吸 NaOH(合理即 得分)
(2)2∶1 (3)c 控制滴加硫酸的速度(合理即得分) 溶液变澄清(或浑 浊消失) ad (4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤, 取滤液),滴加 BaCl2 溶液,若出现沉淀则说明含有 Na2SO4 杂质 (合理即得分)
(3)若生成 3 mol Na2S2O3,根据方程式的关系可知需要 3 mol S 和 3 mol Na2SO3;生成 3 mol S 需 2 mol H2S;而生成 2 mol H2S 需 2 mol Na2S 且同时生成 2 mol Na2SO3;故需要的 Na2S 为 2 mol、 Na2SO3 为 1 mol,其物质的量之比为 2∶1。
________。反应后期可用酒精灯适当加热烧瓶 A,实验室用酒精
灯加热时必须使用石棉网的仪器还有________。
a.烧杯
b.蒸发皿
c.试管
d.锥形瓶
(4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即
可析出 Na2S2O3·5H2O,其中可能含有 Na2SO3、Na2SO4 等杂质。 利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说
硅及其化合物PPT课件

△ Si+2Cl2===SiCl4
.
5
与强碱的反应 Si+2NaOH+H2O===NaSiO3+H2
与HF的反应 Si+4HF===SiF4 +2H2
.
6
(3) 单质硅的制法
高温
SiO2+2C==SiCl4
△
SiCl4+2H2===Si+4HCl
化 学 性 质 常 温 下 化 学 性 质 都 不 活 泼。
物质类别 不
氧化物
单
质
物理性质 不 导 电 同
半导体
与HF反应 SiO2+4HF=SiF4↑+2H2O Si+4HF= SiF4↑+2H2↑ 点
与F2反应
不反应
Si+2F2= SiF4
与NaOH反应 SiO2+2NaOH=N.a2SiO3+H2O Si+2NaOH+H2O=Na2SiO3+2H12↑6
硅及其化合物
.
1
晶体硅
单质
无定形硅
硅
二氧化硅
化合物 硅酸
硅酸盐
.
2
1 单质硅
(1)物理性质
晶体硅为灰黑色黑色固体, 熔沸点高,硬度大。属原子 晶体
.
3
(2)硅的化学性质
常温下,化学性质不活泼, 不与强酸,强氧化剂反应, 可于一些非金属单质,氟化 氢,强碱反应
.
4
与非金属的反应
△ Si+O2===SiO2
个人观点供参考,欢迎讨论!
与盐反应 高温 SiO2+Na2CO3===Na2SIO3+CO2
硅及其化合物1 人教课标版精选教学PPT课件

玛瑙
三、硅
三、硅 1。硅的制取
Si2O2C 高 温 S i 2CO S i 2C2l高 温 S iC 4 l SiC 4l2H 2高温 S i 4HCl
提示:CO2C高温2CO
2。硅的物理性质
灰黑色、有金属光泽、硬而脆的固体, 熔点、沸点高,硬度大的半导体材料。
3。硅的结构
4。硅的化学性质
分子筛
二、二氧化硅与信息材料
1.盛放氢氧化钠溶液的玻璃试剂瓶不能用玻璃 塞。你知道其中的原因吗?
2.沙子、石英、水晶、硅藻土等都是天然存在 的二氧化硅。你知道二氧化硅有哪些重要的 应用吗?
3.当我们在电脑前用鼠标和键盘连接瞬息万变 的世界时,当我们打开手机与家人、朋友互 致问候时,神奇无比的硅片制成的集成电路 在为你提供服务。你知道硅是如何制得的?
医生的好助手
目前,在医学领域上,普遍使用一种连接着许多光纤的胃镜。这些 光纤并成一束,束中各条光纤的相对位置保持不变。把胃镜插入病人胃里, 胃镜接收到的光线沿着这些光纤传到体外。每条光纤中的光仅反映胃中一小 点的情况,整束光纤中的光就拼合成胃里某一部分的图像。光纤胃镜的光源 是在体外由光纤传进去的,它不产生热辐射,能减轻病人的痛苦。在光导纤 维的一头装上精致小巧的微型镜头,将胃内的情况传到体外拍摄下来或显示 在屏幕上。还可以在胃镜光纤中留出空的通道,以插入切取生理切片的镊子。
2015届高考化学总复习 第三章 第四节碳、硅及其化合物精讲课件

③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅,已知
SiHCl3能与H2O剧烈反应,在空气中易自燃。 请回答下列问题: (1)第①步制备粗硅的化学反应方程式为_____________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯 SiHCl3采用的方法为__________________________________。
解析: (1) 高温条件下,焦炭与二氧化硅发生氧化还原 反应,因为碳的氧化产物为气体,从反应体系中随时脱离, 从而保证该反应能够顺利进行。由于二氧化碳有氧化性,所 以在电炉那种高温还原性氛围中,二氧化碳根本不存在; (2)SiCl4沸点为57.6 ℃,所以容易挥发,通过加热蒸馏(或精 馏 ) 即可使之纯化; (3) 锌还原 SiCl4 的反应属于置换反应,所
样就去掉杂质,得到高纯硅。(1)工业上制粗硅时,是用SiO2为
原料,在高温下用C还原得到粗硅:SiO2+2C
高温 Si +2CO↑, =====
这样得到的硅含有杂质,可以作为冶炼制取高纯硅的原料。(2)
中由题给物质沸点的不同,可以考虑用分馏的方法来进行分离。
(3)由于SiHCl3与水强烈反应,所以反应环境必须无水,制得氢 气必须干燥, B 中放的是干燥剂 ( 浓硫酸 ) ,常温下, SiHCl3 是
第三章
第四节
非金属及其化合物
碳、硅及其化合物
硅及其化合物的特殊性质巧记
1.Si的还原性大于 C的,但C却能在高温CO↑。 +2C =====
2.非金属单质跟碱作用一般无 H2放出,但Si能跟强碱溶液
人教版高三化学复习课件 硅及其化合物

用氢氟酸在玻璃上雕刻或写字能够得到花纹
③与Na2CO3 、CaCO3高温反应
SiO2 + Na2CO3 =高=温== Na2SiO3 + CO2 ↑
2019/9/20
6
[注]该反应用于玻璃制造工业;必须注意的 是:这个反应之所以能够发生并不是因为酸 性H2SiO3〉 H2CO3,也不是弱酸制强酸的特例
KCl (l)+ Na(l)=8=50=℃NaCl (l)+ K (g)
2019/9/20
7
5、用途
光导纤维 石英:耐高温化学仪器、
石英电子表石英钟 水晶:电子工业的重要部件、
感谢您下载包图网平台上提供的PPT作品,为了您和包图网以及原创作者的利益,请勿复制、传播、销售,否则将承担法律责任!包图网将对作品进 行维权,按照传播下载次数进行十倍的索取赔偿!
SiO2 +2C 高温 Si(粗硅)+2CO↑
(2)与氯反应:感谢您下载包图网平台上提供的PPT作品,为了您和包图网以及原创作者的利益,请勿复制、传播、销售,否则将承担法律责任!包图网将对作品进 行维权,按照传播下载次数进行十倍的索取赔偿! Si +2Cl2 = SiCl4 (温度为400~500℃)
Si + 2NaOH + H2O == Na2SiO3 +2H2 ↑
与氧气
点燃
Si + O2 ===SiO2
加热条件下: 与氢气
高温
Si + 2H2 ===SiH4
2019/9/20
与氯气
高温
Si + 2Cl2 ===SiCl4 3
四、硅的制备
(1)在工业上,用碳在高温下还原二氧化硅的方 法制得粗硅。
