常见物质溶解性及溶度积
溶度积与溶解度有什么关系
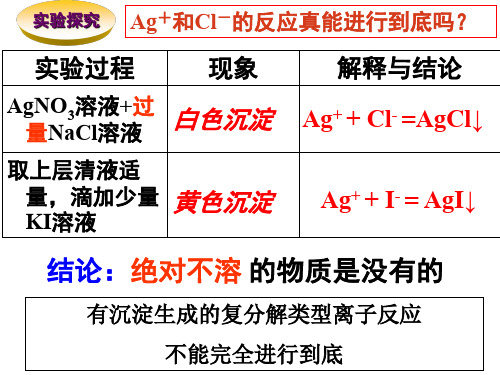
[Ca2+] = [CO32-] = 0.110-3 0.01/1.0 = 10-6 mol /L
Qc = [Ca2+]×[CO32-] = 10-12 < Ksp,CaCO3=4.96 10-9
因此无 CaCO3沉淀生成。
(2)改变CaCl2和Na2CO3的浓度为1.0 mol /L 呢?
AgCl AgCl=Ag++Cl-
AgCl(s) Ag+(aq)+Cl- (aq)
4、溶度积常数:
Ksp = c(Ag+)c(Cl—)
固体浓度视 为定值
在一定温度下,难溶电解质形成沉淀溶 解平衡状态时,饱和溶液中各离子化学计 量数次方的乘积。
Ksp值的大小只与难溶电解质本身的性质和温 度有关,与浓度无关。
难溶 微溶
可溶
易溶
0.01
1
10 (Sg/100g水)
溶解度小于0.01g的电解质称为难溶电解质
难溶电解质的溶解度尽管很小,但不会为0
化学上通常认为残留在溶液中的离子浓度小于 1X10-5mol·L-1,就认为反应完全了
20℃AgCl的溶解度为1.5×10-4g
AgCl溶解平衡的建立 水分子作用下
Ksp值(25℃)
1.8×10-10 mol2L-2 5.0×10-13 mol2L-2 8.3×10-17 mol2L-2 5.6×10-12 mol3L-3 2.2×10-20 mol3L-3
溶解度(g) 1.8×10-4 8.4×10-6 2.1×10-7 6.5×10-3 1.7×10-5
③同离子效应; 化学反应
讨论:对于平衡AgCl(S)⇌ Ag+(aq) + Cl-(aq) 若改变条件,对其有何影响(溶液始终饱和)
常见物质溶解性溶度积
39.5
37.4
46.4
56.7
82.5
118
173
氟硅酸铵
(NH4)2SiF6
18.6
甲酸铵
NH4HCO2
102
143
204
311
533
磷酸一氢铵
(NH4)2HPO4
42.9
62.9
68.9
75.1
81.8
97.2
硫酸氢铵
NH4HSO4
100
酒石酸氢铵
NH4HC4H4O6
1.88
2.7
碘酸铵
BaCl2
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
铬酸钡
BaCrO4
2.775×10-4
氰化钡
Ba(CN)2
80
亚铁氰化钡
Ba2Fe(CN)6
9.732×10-3
氟化钡
BaF2
0.159
0.16
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
难溶电解质的溶度积与溶解度之间的关系

难溶电解质的溶度积与溶解度之间的关系在化学溶解度常数的研究中,我们经常会遇到难溶电解质。
它们是指在水中溶解度非常小的电解质物质,比如银氯化物、铅碘化物等。
在研究这些物质时,我们需要了解它们的溶度积与溶解度之间的关系,这有助于我们更深入地理解溶解度常数的概念。
1. 溶度积的定义溶度积是指在一定温度下,难溶电解质在水中达到溶解平衡时,其离子浓度的乘积。
以银氯化物(AgCl)为例,其离子方程式为AgCl ⇄Ag⁺ + Cl⁻,在溶解平衡时,Ag⁺和Cl⁻的浓度分别为x,那么AgCl的溶度积Ksp就等于x²。
对于难溶电解质来说,Ksp的值通常非常小,代表其溶解度极低。
2. 溶解度与溶度积的关系难溶电解质的溶解度通常定义为单位体积溶液中难溶物质的质量。
溶解度是溶液饱和时,溶液中包含的物质的量,可以用溶度积来表达。
具体而言,当难溶电解质达到溶解平衡时,其溶解度与溶度积之间的关系为溶解度=√(Ksp)。
这表明,溶解度与溶度积之间存在平方根的关系。
3. 溶度积与溶解度的意义溶度积和溶解度的关系对我们有着重要的意义。
通过溶度积,我们可以了解难溶电解质在溶解平衡时离子的浓度,从而推导出其溶解度。
溶度积和溶解度的关系也是我们研究难溶电解质在水溶液中的行为和性质时的重要依据。
它还可以帮助我们预测在不同条件下溶液中难溶电解质的溶解度变化。
总结回顾通过上述分析,我们不难发现,难溶电解质的溶度积与溶解度之间存在着明显的关系。
溶度积是在溶解平衡下离子浓度的乘积,而溶解度则是溶液饱和时单位体积溶液中难溶物质的质量,其与溶度积之间存在平方根的关系。
这种关系帮助我们更深入地了解难溶电解质的溶解特性,以及在不同条件下其溶解度的变化规律。
个人观点对于难溶电解质的溶度积与溶解度之间的关系,我个人认为应该结合实际,在化学实验中进行验证和观察,以更加深入地了解其内在规律。
我们也可以进一步探讨难溶电解质的相关性质和应用,从而拓展对这一主题的理解和认识。
溶度积与溶解度的关系解读

溶度积与溶解度的关系关键词:溶度积,溶解度难溶电解质的溶度积及溶解度的数值均可衡量物质的溶解能力。
因此,二者之间必然有着密切的联系,即在一定条件下,二者之间可以相互换算。
根据溶度积公式所表示的关系,假设难溶电解质为A m B n,在一定温度下其溶解度为S,根据沉淀-溶解平衡:B n(s)mA n+ + nB m−A[A n+]═ m S,[B m−]═ n S则K sp(A m B n)═ [A n+]m[B m−]n ═ (m S)m(n S)n ═ m m n n S m+n(8-2)溶解度习惯上常用100g溶剂中所能溶解溶质的质量[单位:g/(100g)]表示。
在利用上述公式进行计算时,需将溶解度的单位转化为物质的量浓度单位(即:mol/L)。
由于难溶电解质的溶解度很小,溶液很稀,可以认为饱和溶液的密度近似等于纯水的密度,由此可使计算简化。
【例题8-1】已知298K时,氯化银的溶度积为1.8×10−10,Ag2CrO4的溶度积为1.12×10−12,试通过计算比较两者溶解度的大小。
解(1)设氯化银的溶解度为S1根据沉淀-溶解平衡反应式:AgCl(s)Ag++Cl−平衡浓度(mol/L)S1S1K sp(AgCl)═ [Ag+][Cl−]═ S12S1 ═10⨯═ 1.34×10−5(mol/L)8.1-10(2)同理,设铬酸银的溶解度为S2AgCrO4(s)2Ag++ CrO42-平衡浓度(mol/L)2S2 S2K sp(Ag2CrO4)═[Ag+]2 [CrO42-]═(2S2)2S2═4S23S2 6.54×10−5(mol/L)>S1在上例中,铬酸银的溶度积比氯化银的小,但溶解度却比碳酸钙的大。
可见对于不同类型(例如氯化银为AB型,铬酸银为AB2型)的难溶电解质,溶度积小的,溶解度却不一定小。
因而不能由溶度积直接比较其溶解能力的大小,而必须计算出其溶解度才能够比较。
溶解度与溶度积ppt课件

难溶 微溶
可溶
易溶
0.01
1
S >10g 易溶 S 0.01~1g 微溶
10 (S g/100g水)
S 1~10g 可溶 S <0.01g 难溶
7
本章主题—沉淀溶解平衡,主要讨论研究 微溶和难溶的无机化合物,下文将其统称为难 溶电解质。
10
沉淀溶解平衡
将BaSO4晶体放入水中,开始时溶解速率较 大,沉淀速率较小。在一定条件下,当溶解和沉
淀速率相等时,便建立了一种动态的多相离子平
衡,可表示如下:
BaSO 4 (s)
溶解 沉淀
Ba
2
(aq)
SO
2 4
(aq
)
Ksp (BaSO4) = [c(Ba2+ )/c ][c(SO24 )/c ]
溶度积和溶解度的相互换算
在溶度积的计算中,离子浓度必须是物质的量的浓度,
其 单 位 为 mol·L-1 ; 而 溶 解 度 的 单 位 有 g/100g 水 , g·L-1 , mol·L-1。计算时一般要先将难溶电解质的溶解度 S 的单位 换算为mol·L-1。对于难溶物质饱和溶液浓度极稀,可作近 似处理:(xg/100g H2O)×10/M ~ mol·L-1
9.1×10-6 8.0×10-27 6.3×10-36 4×10-53 8×10-16 4×10-38 1.8×10-11 2.06×10-13 2.5×10-13
14
溶度积与溶解度的关系
联系:溶度积与溶解度均可表示难溶电解质的溶解性, 两者之间可以相互换算。 区别:溶度积是一个标准平衡常数,只与温度有关。而 溶解度不仅与温度有关,还与系统的组成、pH值的改变 及配合物的生成等因素有关。
溶解度和溶度积表(全)
BaCl2 Ba(ClO2)2
BaCrO4 Ba(CN)2 Ba2Fe(CN)6
BaF2 BaSiF6 Ba(HCO2)2 BaHPO4 BaHPO3 Ba(OH)2·8H2O
31.2 43.9
26.2 1.67
碘酸钡
Ba(IO3)2
碘化钡 钼酸钡 硝酸钡 亚硝酸钡 草酸钡 氧化钡 高氯酸钡 高锰酸钡 焦磷酸钡 硒酸钡 硫酸钡 硫化钡 砷酸铋 氢氧化铋 碘化铋 磷酸铋 硫化铋 氢氧化铂 (II) 溴化铂 (IV) 氟化钚 (III) 氟化钚 (IV) 碘酸钚 (IV) [ 编辑 ] 氮、镝
2.519 ×10-5
8.18
0°C 10°C
216
233
41.4 46.2 65.8
213
1.83
1.49
17.1
0.16
0.141
0.38
0.52
67.6
70.8
152
191
104
8.79 0.264
7.14 0.265
129
152
348
376
氯化镉
CdCl2
100
135
135
氰化镉
Cd(CN)2
2.2 ×10-2
亚铁氰化镉
Cd2Fe(CN)6
8.736 ×10-5
氟化镉
CdF2
0.88
碘化钴 硝酸钴 亚硝酸钴 高氯酸钴 硫酸钴 二氧化硅
CoI2 Co(NO3)2 Co(NO2)2 Co(ClO4)2 CoSO4 SiO2
[ 编辑 ] 铪、氦、钬
物质
氢氧化铪 (III)
化学式
Hf(OH)3
氢氧化铪 (IV)
Hf(OH)4
溶度积与溶解度关系

溶度积与溶解度关系嘿,朋友们!今天咱来聊聊溶度积和溶解度这对“好兄弟”。
咱先来说说溶解度,这就好比是一个班级里能容纳的学生数量。
有的物质比较容易溶解在溶剂里,就像那些性格开朗好相处的同学,能在班级里很自在地待着,数量也会比较多;而有的物质就比较难溶解,像是性格有点古怪的同学,在班级里的数量就比较少啦。
那溶度积呢,它就像是班级里的一种特殊规定或者标准。
只有达到了这个标准,物质才能稳定地存在于溶液中。
如果没达到,就好像不符合班级规定的同学,可能就待不下去啦。
你想想看,要是一种物质的溶解度很大,那是不是意味着它很容易就达到溶度积的要求呀?这就好像一个很优秀的同学,很轻松就能符合班级的各种标准。
但要是溶解度很小呢,那要达到溶度积可就有点费劲咯,就跟一个学习有点吃力的同学要达到很高的标准一样。
比如说盐吧,我们做菜经常会用到盐。
盐在水里的溶解度还不错,所以我们很容易就能在水里溶解一定量的盐。
但是如果水里已经溶解了很多盐,接近了溶度积,那再想溶解更多可就难喽。
这就好像班级里的座位有限,已经坐满了人,再想加人就不太容易啦。
再比如一些难溶的物质,就像有些很难融入集体的同学。
它们的溶解度很小,要达到溶度积就更是难上加难啦。
那这溶度积和溶解度的关系对我们生活有啥用呢?这用处可大啦!咱就说在化工生产中吧,工程师们得知道各种物质的溶度积和溶解度,这样才能合理地控制反应条件,让反应顺利进行,生产出我们需要的产品呀。
在环境保护方面也很重要哦!如果我们不了解一些污染物在水里的溶度积和溶解度,怎么能有效地治理水污染呢?总之,溶度积和溶解度的关系就像生活中的很多道理一样,看似简单,实则蕴含着大奥秘呢!我们要好好去研究它们,利用它们,让它们为我们的生活和社会发展服务呀!所以,可别小瞧了这溶度积和溶解度的关系哟!。
常用溶度积常数

溶度积定义对于物质 AnBm(s)=n Am+(aq)+ mBn-(aq), 溶度积(Ksp)=(C(Am+) )^n ( C(mBn-))^m溶度积的应用很广泛。
在定性分析中,利用金属硫化物、氢氧化物、碳酸盐等溶度积的差异分离金属离子。
若往氯化铅饱和溶液中加入氯化钾时,溶液中Cl-浓度增大,Pb2+和Cl-的浓度系数次方之积较氯化铅的溶度积大,这时将有部分离子发生Pb2++2Cl- --→PbCl2的反应,将过剩的PbCl2沉淀出来,直至两种离子的浓度系数次方之积等于氯化铅的溶度积为止。
因此,为使溶解度小的物质完全沉淀,需要加入含有共同离子的电解质。
人教版化学选修4化学反应原理第三章沉淀的溶解平衡涉及溶度积的计算溶解度与溶度积的关系溶解度和溶度积的互相换算:两者都可以用来表示难溶电解质的溶解性。
溶度积是微溶解的固相与溶液中相应离子达到平衡时的离子浓度的乘积,只与温度有关。
溶解度不仅与温度有关,还与系统的组成,PH的改变,配合物的生成等因素有关。
只有同一类型的难溶电解质才能通过溶度积比较其溶解度(mol/l)的相对大小。
大多数实际溶解度S比由c计算得到的要大。
溶度积规则与离子积的关系离子积IP(ion product):任一条件下离子浓度幂的乘积。
Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是IP的一个特例。
数值分析1. IP=Ksp 表示溶液是饱和的。
这时溶液中的沉淀与溶解达到动态平衡,既无沉淀析出又无沉淀溶解。
2. IP<Ksp 表示溶液是不饱和的。
溶液无沉淀析出,若加入难溶电解质,则会继续溶解。
3. IP>Ksp 表示溶液为过饱和。
溶液会有沉淀析出常用溶度积常数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溴化铵
NH4Br
60.6
68.1
76.4
83.2
91.2
108
125
135
145
碳酸铵
(NH4)2CO3
100
氯酸铵
NH4ClO3
28.7
氯化铵
NH4Cl
29.4
33.2
37.2
41.4
45.8
50.4
55.3
60.2
65.6
71.2
77.3
氯铂酸铵
(NH4)2PtCl6
0.289
0.374
0.499
37.4
36
34.7
33.8
33.2
32.7
33.5
31.1
29.7
砷酸钙
Ca3(AsO4)2
3.629×10-3
叠氮化钙
Ca(N3)2
45
苯甲酸钙
Ca(C7H5O2)2
·3H2O
2.32
2.45
2.72
3.02
3.42
4.71
6.87
8.55
8.7
碳酸氢钙
Ca(HCO3)2
16.1
16.6
17.1
1.352×10-7
氟化钚(III)
PuF3
3.144×10-4
氟化钚(IV)
PuF4
3.622×10-4
碘酸钚(IV)
Pu(IO3)4
7.998×10-2
[编辑]氮、镝
物质
化学式
0°C
10°C
20°C
30°C
40°C
50°C
60°C
70°C
80°C
90°C
100°C
一氧化氮
NO
5.6×10-3
一氧化二氮
14.9
27.7
49.9
67.3
60.3
砷酸铋
BiAsO4
7.298×10-4
氢氧化铋
Bi(OH)3
2.868×10-7
碘化铋
BiI3
7.761×10-4
磷酸铋
BiPO4
1.096×10-10
硫化铋
Bi2S3
1.561×10-20
氢氧化铂(II)
Pt(OH)2
3.109×10-11
溴化铂(IV)
PtBr4
3.5×10-2
4.6×10-2
5.7×10-2
碘化钡
BaI2
182
201
223
250
264
291
301
钼酸钡
BaMoO4
6×10-3
硝酸钡
Ba(NO3)2
4.95
6.67
9.02
11.5
14.1
20.4
27.2
34.4
亚硝酸钡
Ba(NO2)2
50.3
60
72.8
102
151
222
261
325
草酸钡
NH4IO3
2.6
碘化铵
NH4I
155
163
172
182
191
209
229
250
硝酸铵
NH4NO3
118
150
192
242
297
421
580
740
871
高碘酸铵
(NH4)5IO6
2.7
草酸铵
(NH4)2C2O4
2.2
3.21
4.45
6.09
8.18
14
22.4
27.9
34.7
高氯酸铵
NH4ClO4
12
溴酸钆(III)
Gd(BrO3)3
·9H2O
50.2
70.1
95.6
126
166
氢氧化钆(III)
Gd(OH)3
1.882×10-5
硫酸钆(III)
Gd2(SO4)3
3.98
3.3
2.6
2.32
氯化钙
CaCl2
59.5
64.7
74.5
100
128
137
147
154
159
乙酸钙
Ca(C2H3O2)2
·2H2O
BaC2O4·2H2O
3×10-3
氧化钡
BaO
3.8
高氯酸钡
Ba(ClO4)2
239
336
416
495
575
653
高锰酸钡
Ba(MnO4)2
1.5×10-2
焦磷酸钡
Ba2P2O7
9×10-3
硒酸钡
BaSeO4
5×10-3
硫酸钡
BaSO4
2.448×10-4
硫化钡
BaS
2.88
4.89
7.86
10.4
50°C
60°C
70°C
80°C
90°C
100°C
氢氧化钯(II)
Pd(OH)2
4.106×10-10
氢氧化钯(IV)
Pd(OH)4
5.247×10-14
乙酸钡
Ba(C2H3O2)2
58.8
62
72
75
78.5
75
74
74.8
砷酸钡
Ba3(AsO4)2
2.586×10-9
叠氮化钡
Ba(N3)2
12.5
22.7
39.5
37.4
46.4
56.7
82.5
118
173
氟硅酸铵
(NH4)2SiF6
18.6
甲酸铵
NH4HCO2
102
143
204
311
533
磷酸一氢铵
(NH4)2HPO4
42.9
62.9
68.9
75.1
81.8
97.2
硫酸氢铵
NH4HSO4
100
酒石酸氢铵
NH4HC4H4O6
1.88
2.7
碘酸铵
0.637
0.815
1.44
2.16
2.61
3.36
铬酸铵
(NH4)2CrO4
25
29.2
34
39.3
45.3
59
76.1
重铬酸铵
(NH4)2Cr2O7
18.2
25.5
35.6
46.5
58.5
86
115
156
砷酸二氢铵
NH4H2AsO4
33.7
48.7
63.8
83
107
122
磷酸二氢铵
NH4H2PO4
不溶
-
HNO3
水
-
HCl
HCl
-
-
-
-
-
HCl
-
不溶
HCl
HNO3
HNO3
HCl
略溶,
HCl
水
水
水
水
水
水
Fe(CN)64-
不溶
-
不溶
-
-
不溶
不溶
-
-
-
不溶
-
-
不溶
不溶
HCl
不溶
不溶
不溶
水
水
水
水
水
水
水
Fe(CN)63-
不溶
-
不溶
不溶
-
不溶
不溶
-
-
不溶
-
-
-
水
不溶
不溶
不溶
不溶
HCl
水
水
水
水
水
水
水
S2O32-
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
碘化物, I-
不溶
HNO3
略溶,
HNO3
HCl
HCl
略溶
水
水
水解,
HCl
水
水解,
HCl
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
溴化物, Br-
不溶
HNO3
不溶
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
水
水
BO2-
HNO3
-
HNO3
-
HCl
HCl
HCl
-
-
HCl
-
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶
略溶
HCl
水
水
水
硅酸盐, SiO32-
HNO3
-
HNO3
-
