饮料中维生素C含量的测定
化学实验酸碱滴定法测定某种饮料中维生素C的含量

化学实验酸碱滴定法测定某种饮料中维生素C的含量维生素C是一种重要的营养物质,对人体健康起着至关重要的作用。
本实验旨在通过酸碱滴定法测定某种饮料中维生素C的含量。
酸碱滴定法是一种常用的分析方法,通过滴定剂与待测物反应的终点滴定,来确定被测物含量的测定方法。
实验材料和仪器:1.维生素C标准溶液(浓度已知)2.0.1M 碘酸钾溶液3.0.1M 碘化钾溶液(用作淀粉指示剂)4.某种饮料样品5.滴定管、试剂瓶、移液管等实验仪器实验步骤:1.制备维生素C标准溶液:精确称取维生素C标准样品,溶解于适量的去离子水中,转移到500 mL容量瓶中,用去离子水稀释至刻度线。
2.样品的准备:将某种饮料样品倒入容量瓶中,稀释至一定体积,使浓度适中。
3.滴定操作:取一个已清洗干净的滴定管,用已知浓度的碘酸钾溶液标定滴定管。
4.滴定:将准备好的饮料样品放入滴定管中,加入适量碘酸钾溶液,液体呈淡黄色。
5.滴定过程中加入淀粉指示剂,当溶液变成蓝色时,说明已经接近滴定终点。
6.注意事项:在接近滴定终点时,滴定速度应减慢,一滴一滴地加入滴定液,直至出现由蓝色变为无色,终点滴定结束。
7.数据记录:记录实验中消耗的滴定剂体积,计算出维生素C的含量。
实验原理:维生素C的测定是通过碘酸与维生素C的氧化还原反应进行的。
碘酸是一种强氧化剂,它能将维生素C氧化为脱氢抗坏血酸。
反应中,维生素C还原碘酸为碘离子。
滴定过程中用淀粉指示剂,当溶液中维生素C被滴定剂完全氧化时,多余的碘酸将与淀粉形成亮蓝色蓝黑色终点颜色。
实验数据和计算:1.已知维生素C标准溶液的浓度为C1 (mol/L),滴定时消耗的碘酸钾溶液体积为V1 (mL)。
2.某种饮料样品中维生素C的浓度为C2 (mol/L),滴定时消耗的碘酸钾溶液体积为V2 (mL)。
3.根据反应的化学方程式可以得出:n(C2H4O2) = n(KIO3)。
根据摩尔反应比可以得出维生素C的摩尔浓度。
实验结果:通过实验测定,我们可以得出某种饮料样品中维生素C的含量。
饮料中维生素c含量的测定

饮料维生素C含量测定
噫,今儿个咱们来摆一摆这个饮料里头维生素C含量测定的事儿。
你说这市面上花花绿绿的饮料,哪个不含点儿维生素C 嘛,但到底有好多,那就得拿科学仪器来测一测了。
首先呢,你得准备些家伙什儿,啥子紫外分光光度计啊,标准品维生素C啊,还有那些要测的饮料样品。
先把那标准品维生素C整得巴巴适适的,配成不同浓度的溶液,拿去测一测,画个标准曲线出来,这就跟画地图一样,心里得有个数儿。
然后啊,再把那些饮料样品一个个地倒点儿出来,稀释一下,免得把仪器整坏了。
接着就用那紫外分光光度计去照一照,看看吸收光是多少,再跟标准曲线一对比,嘿,这饮料里头维生素C的含量就一目了然了。
不过呢,这事儿说起来简单,做起来可就得细心点儿了。
仪器得校准好,操作也得规范,不然测出来的结果就不准了。
还有啊,这饮料里头可能还有其他成分会影响测定结果,所以还得做些前处理,把干扰因素给排除了。
总的来说呢,测定饮料里头维生素C含量这事儿,还是得靠科学,不能光靠眼睛看、嘴巴尝。
只有拿数据说话,才能让人信服嘛。
所以大伙儿在买饮料的时候,也别光看广告上咋个吹,还是得看看营养成分表,心里才有个底儿。
饮料中维生素 C 含量的测定

Iustry科技文苑行业74 食品安全导刊 2018年12月饮料中维生素C 含量的测定□ 周宁菱 景德镇市市场和质量监督管理综合检验检测中心维生素C(VC)又称抗坏血酸,是人体生长发育及维持健康不可缺少的营养物质,但是人体内不能贮存VC,同时自身也无法合成VC,且人体若严重缺乏VC 易引起坏血病[1]。
中国营养学会推荐的成人每日VC 摄入量为100mg,最高为1000mg,摄入过多或过少都会引起身体的病变,故了解日常饮食,如各种饮料中的VC 含量十分必要。
目前,定量VC 的方法有2,6-二氯靛酚钠法[2]、碘量法[3]、分光光度法[4]和高效液相色谱法(HPLC)[5]等。
本文选择高效液相色谱-二极管阵列检测器法(HPLC-PDA)[6]测定常见饮料中VC 的含量,此法根据不同物质有不同光谱的特性来定性,通过峰面积来定量。
本实验以8种不同品牌的饮料为检测样本,对其VC 含量进行测定,并讨论开盖后环境温度和放置时间对V C 含量的影响,以期为人们科学补充VC 提供参考建议。
1 材料与方法1.1 仪器与试剂高效液相色谱仪:Waters e2695型(配置Waters2998型二极管阵列检测器)、超纯水机(Millipore EXPRESS40)、紫外分光光度计(岛津UV 2550型)、VC 标准品(中国食品药品检定研究院)。
1.2 方法1.2.1 样品中VC 的测定方法采用HPLC-PDA 法测定饮料中的VC 含量[6],色谱条件分别是:色谱柱为ODS C18柱(250mm×4.6mm,5μm),流动相为0.1%醋酸溶液,流速为1.0mL/min,柱温为28℃。
1.2.2 标准曲线的绘制精密称取25.00mg VC 标准品,用超纯水定容于100mL 棕色容量瓶中,配制成250mg /L 标准溶液,分别精密量取不同体积的250mg /L VC 标准溶液,配制成200mg /L、150mg /L、100mg /L、50mg /L、10mg /L 的VC 标准系列溶液。
维生素c测定实验报告

维生素c测定实验报告维生素C测定实验报告。
实验目的:本实验旨在通过分光光度法测定果汁中维生素C的含量,了解维生素C的性质和测定方法。
实验原理:维生素C是一种易氧化的物质,可以被2,6-二氨基苯酚(DPIP)还原成无色的化合物。
当果汁中含有维生素C时,它会与DPIP发生反应,使DPIP的颜色由蓝色逐渐变为无色。
通过测定果汁中DPIP的消耗量,可以计算出果汁中维生素C的含量。
实验步骤:1. 将一定量的果汁样品加入试管中;2. 加入适量的DPIP试剂,混合均匀;3. 用分光光度计在特定波长下测定溶液的吸光度;4. 根据标准曲线计算出果汁中维生素C的含量。
实验结果:经过实验测定,我们得出果汁中维生素C的含量为XXmg/100ml。
实验分析:通过本次实验,我们了解到分光光度法是一种简便、快速、准确的测定方法,适用于测定果汁、蔬菜等食品中维生素C的含量。
同时,我们也发现果汁中维生素C的含量受到多种因素的影响,如果汁的种类、保存方式等。
实验总结:本次实验通过分光光度法成功测定了果汁中维生素C的含量,进一步加深了我们对维生素C的认识。
在今后的实验中,我们将继续学习和探索更多关于维生素C的知识,不断提高实验技能和分析能力。
实验注意事项:1. 实验过程中要注意操作规范,避免试剂的飞溅和溅洒;2. 实验结束后要及时清洗实验器材,保持实验台面的整洁;3. 实验中要注意安全,避免接触有毒有害物质。
维生素C在日常生活中扮演着重要的角色,它不仅是一种营养物质,还具有抗氧化、美白肌肤等功效。
通过本次实验,我们对维生素C有了更深入的了解,相信在今后的学习和生活中,我们会更加珍惜并正确利用维生素C的重要性。
维生素C的含量测定(直接碘量法)
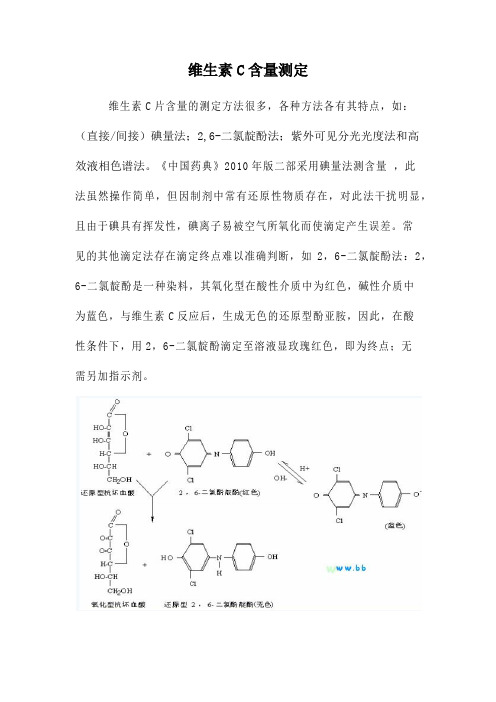
维生素C含量测定维生素C片含量的测定方法很多,各种方法各有其特点,如:(直接/间接)碘量法;2,6-二氯靛酚法;紫外可见分光光度法和高效液相色谱法。
《中国药典》2010年版二部采用碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法干扰明显,且由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-二氯靛酚法:2,6-二氯靛酚是一种染料,其氧化型在酸性介质中为红色,碱性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至溶液显玫瑰红色,即为终点;无需另加指示剂。
分光光度法运用维生素C的旋光性能进行含量测定,但操作费时,而高效液相色谱法是目前发展较为迅速的一种方法,灵敏度高,选择性好,是一个准确高效的测定维生素C含量的方法。
我们主要介绍的是直接碘量法。
直接碘量法一.实验原理维生素C是人体重要的维生素之一,它影响胶元蛋白的形成,参与人体多种氧化-还原反应,并且有解毒作用。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C,通常还需储藏能维持一个月左右的维生素C。
缺乏时会产生坏血病,故又称抗坏血酸。
维生素C属水溶性维生素,分子式C6H8O6。
分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,因而可用I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、饮料、蔬菜、水果中维生素C的含量。
由于维生素C的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I - 在强酸性中也易被氧化,故一般选在pH为3~4的弱酸性溶液中进行滴定。
由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差;又由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定比较麻烦。
饮料中维生素C含量的测定.ppt
又叫抗坏血酸,是一种水溶性维生素。广泛存在于新鲜水 果和蔬菜中。人体不能合成我, 必须从食物中获取。当人 体缺乏我时,易患坏血病。
分子式C6H8O6,相对分子质量为176.13, 我容易失去电子,是一种较强的还原剂,容易 被氧化,在受热或碱性溶液中更容易被氧化。。
一、原理 ——滴定法
1、滴定时的化学反应
2、指示剂的选择 淀粉溶液
3、滴定终点的判断
用碘溶液滴定至稳定的蓝色,半分钟内不褪色 即为终点
测定饮料中维生素C的含量。
二、实验步骤:
1、用酸式滴定管取5.00ml饮料,置于锥形瓶中,加入10ml蒸 馏水,3ml HAc溶液和3 ml 5%的淀粉; 2、用水和I2标准溶液润洗酸式滴定管2-3次。 3、将I2标准溶液装入酸式滴定管中读数,开始滴定至出现稳 定的浅蓝色,30s内不褪色即为终点,记下消耗I2溶液体积。 4、平行三次实验。
2、换算成和饮料瓶身标识中溶液体积相同的维生素C的质量 (单位mg)。 3、和试样饮料的标识数据对比。
四、误差分析
1、锥形瓶中加了蒸馏水 无影响 2、振荡锥形瓶时,液体飞溅出来 偏小
3、滴定管未用碘标准液润洗 偏大
4、饮料放置时间长,少 量维Cቤተ መጻሕፍቲ ባይዱ瓶中已被氧化
偏小
5、碘标准溶液久置(碘挥发) 偏大
滴 定 管 保 持 垂 直
左手 滴加速度先快后慢
半分钟颜色不变
视线与凹液 面水平相切
右手 眼睛注视瓶内颜色变化
数据记录
用量
序号
饮料 V/ml
1
5.00
碘标准溶液
V消耗
I2(ml) V前(ml) V后(ml)
2
5.00
3
5.00
菓珍饮料中维生素C含量的测定20190625

菓珍饮料中维生素C含量的测定1.K2Cr2O7标准溶液的配制准确称取0.0981g K2Cr2O7,置于烧杯中,再加入少量水,搅拌,待K2Cr2O7全部溶解后,定容到200mL容量瓶中。
2.Na2S2O3标准溶液配制用台秤称取1.0g Na2S2O3置于烧杯中,加入少量水,搅拌,待Na2S2O3全部溶解后,稀释至400mL无色试剂瓶中。
3.I2标准溶液的配制称取0.35g I2,碾碎,再称取2.0g KI,将二者置于50mL烧杯中,加少量蒸馏水,搅拌,稀释至200mL棕色试剂瓶中。
4.菓珍溶液的配制称取1份40.2000g菓珍,置于烧杯中,加少量水,定容于200mL 容量瓶中。
5. K2Cr2O7标准溶液标定Na2S2O3溶液用25mL移液管移取K2Cr2O7 25.00mL置于锥形瓶中,加入10mL KI溶液,再加入5mL 6mol/L HCl,再加入50mL水,溶液呈黄褐色,将Na2S2O3标准溶液装入滴定管,开始滴定,滴定至溶液由黄褐色变为浅黄色时,用量筒量取2mL淀粉溶液加入锥形瓶内,溶液变为墨绿色,继续滴定,当溶液变为无色时即为滴定终点,平行测定3次,记录所消耗Na2S2O3标准溶液的体积。
6. Na2S2O3标准溶液滴定I2溶液用25.00mL移液管移取Na2S2O3 25.00mL于锥形瓶,加入50mL 水和10mL HAc,再加入2mL淀粉指示剂,滴定管内装入I2标准溶液,开始滴定,锥形瓶内溶液由无色变为蓝色时为滴定终点,平行测定3次,记录所消耗I2标准溶液的量。
7.菓珍溶液中维生素C含量的测定将配制好的菓珍溶液摇匀后,分别移取25.00mL于锥形瓶中,分别加入2mL淀粉溶液,并用I2标准溶液滴定,锥形瓶内溶液由黄色变为蓝色,蓝色即为滴定终点,记录所消耗I2标准溶液的体积。
高效液相色谱法测定食品和饮料中维生素C含量

中维 生 素 C含 量 的 方法 , 现报 道 如 下 。
1 研 究 资料
22 准确度试验 .
本 试 验 采 用 猕猴 桃 为本 底 试 样 , 均含 量 平
为 0 2 2 % , 了低 、 、 3个 浓 度 的 加 标 回 收 , 个 浓 度 .5 4 做 中 高 每 各 做 3个 。 回收 率 范 围 为 9 . % ~1 2 , 表 1 93 0% 见 。 表 1 准 确度 实验
A.维 生 素 C对 照 品 ; .猕 猴 桃 样 品 ; B C.浓 缩 果 汁 ; :维 生素 C 1 图 1 维 生 素 C标 准 品 和样 品 色 谱 图
的试 样 , 溶 液 颜 色 背 景 干 扰 大 , 最 终数 据 有 影 响 。高 效 液 其 对 相 色 谱 法 具 有 高 效 、 速 、 定 、 敏 度 高 的特 点 , 在 较 短 时 快 稳 灵 能 间 内完 成 测 定 , 者 探 讨 了高 效 液 相 色 谱 法 测 定 食 品 及 饮 料 笔
法 l 等 , 是维 生 素 C具 有 较 强 的 还 原 性 , 中性 和 碱 性 环 2 但 在
心
』 — L
触I. } 且
— —
境 下 不稳 定 , 热 迅 速 分 解 , 测 方 法 操 作 步 骤 复 杂 , 有 试 遇 检 具
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饮料中维生素C的测定实验设计方案【实验原理】1.维生素C又称抗坏血酸Vc,分子式C6H8O6。
Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。
其滴定反应式如下:C 6H8O6+I2= C6H6O6+2HI用淀粉溶液作指示剂,若溶液突变成蓝色,则滴定终点到达。
2.I2标准溶液的标定(间接碘量法)碘标准溶液可选用As2O3直接标定,由于As2O3是有毒性物质,本实验选用Na2S2O3标定碘。
而Na2S2O3不是基准物质,不能直接配制标准溶液,需用K2Cr2O7来标定。
故I 2标准溶液的标定方法为:先用K2Cr2O7标定Na2S2O3的浓度,再用Na2S2O3标定I2标准溶液的浓度。
①用K2Cr2O7做基准物质,间接碘量法标定Na2S2O3溶液的浓度。
其过程为:K2Cr2O7与KI先反应析出I2,析出的I2再用标准的Na2S2O3溶液滴定,从而求得Na2S2O3的浓度。
这个标定Na2S2O3的方法为间接碘量法。
标定Na2S2O3溶液时有:6I-+Cr2O72-+14H+ = 2Cr3++3I2+7H2O;2S2O32-+I2= S4O62-+2I-根据以上反应方程式可知Na2S2O3标定时的计量系数比为:K 2C2O7:Na2S2O3= 1:6。
②用标准的Na2S2O3溶液标定I2标准溶液的浓度,用淀粉溶液作指示剂,若溶液突变成蓝色,则滴定终点到达。
碘量法的基本反应式:2S2O32-+I2= S4O62-+2I-根据以上原理可知各物质的定量关系比为:Vc :I2:Na2S2O3:K2C2O7= 1 :1 :2 :1/3【实验内容】测定不同饮料(统一鲜橙多,汇源橙汁)中维生素C的含量。
【实验用品】1.实验试剂(1)市售“统一鲜橙多”“汇源橙汁”饮料溶液的配制依据:根据“统一鲜橙多”饮料包装上标明的维生素C的含量:25mg/100ml,换算成摩尔浓度约为1.42×10-3mol/L(汇源橙汁含量与其近似)。
由于其浓度太小,配制溶液所需药品的质量太小,称量时不准确,故将其扩大10倍,因此配制I2标准溶液的浓度大概为1.42×10-2mol/L,标定好后,再稀释10倍,测定维生素C的含量。
根据各物质的定量关系比:Vc:I2:Na2S2O3:K2C2O7= 1:1:2:1/3,计算出所需溶液的浓度,再根据各物质的相对摩尔质量,计算出配制一定体积的该浓度的溶液所需的称量质量。
由于K2C2O7是基准物质,需准确称量,其他药品用托盘天平粗称即可。
(2)K2Cr2O7标准溶液(约为1/3的2.83×10-2 mol/L):用电子分析天平准确称取0.34—0.35克的K2Cr2O7基准物质,置于烧杯中加入适量蒸馏水,待其全部溶解后转移至250mL容量瓶中,定容,摇匀,备用。
(3)I2溶液(约为2.83×10-2 mol/L,控制滴定体积在25ml内):称取1.8g I2,置于研钵中加少量水,充分研磨。
待I2全部溶解后,将溶液转入棕色试剂瓶,加水稀释至250mL,摇匀,放置暗处保存。
注意:① I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶解很慢,所以配制I2溶液时不能过早加水稀释,应先将I2和KI混合,用少量水充分研磨,溶解完全后再加水稀释。
I与KI间存在如下平衡:I2+I-=I3-。
②游离I2容易挥发损失,这是影响碘溶液稳定性的原因之一。
因此溶液中应维持适当过量的I-离子,以减少I 2的挥发。
空气能氧化I-离子,引起I2浓度增加:4I-+O2+4H+=2I2+2H2O。
此氧化作用缓慢,但由于光、热及酸的作用而加速,因此I2溶液应处于棕色瓶中置冷暗处保存。
I2能缓慢腐蚀橡胶和其他有机物,所以I2应避免与这类物质接触。
(4)Na2S2O3标准溶液(约为5.68×10-2 mol/L) :称取3.5克Na2S2O3·5H2O置于250mL烧杯中,加入新煮沸冷却的蒸馏水,使其全部溶解,再加入少量的Na2CO3,加水稀释至250mL,将溶液转入棕色试剂瓶。
注意:①用煮沸的水配硫代硫酸钠以去除溶解在水中的氧气,因为氧气会氧化硫代硫酸钠;硫代硫酸钠溶液不要加热,加热会加速空气中的氧气氧化硫代硫酸钠。
②Na2S2O3一般含有少量杂质,在PH=9-10间稳定,所以在Na2S2O3溶液中加入少量的Na2CO3,Na2S2O3见光易分解可用棕色瓶储于暗处。
(5)KI溶液(2%浓度)(6)淀粉溶液(5%)(7)6mol/L HCl溶液2.实验仪器50ml碱式滴定管、50ml酸式滴定管、250ml锥形瓶、250ml容量瓶、25ml移液管、500ml烧杯、研钵、玻璃棒等。
【实验设计】介绍维生素C的性质及其作用维生素C是一种无色晶体,分子式C6H8O6,相对分子质量为176.13,熔点190-192℃,是一种水溶性维生素,溶液显酸性,并有可口的酸味。
容易失去电子,是一种较强的还原剂,在受热或碱性溶液中更容易被氧化。
维生素C的结构式为:维生素C也称抗坏血酸,在人体中有中重要功能,它参与体内的氧化还原反应,维持细胞间的正常结构;促进伤口愈合,维持牙齿、骨骼、血管和肌肉的正常功能;帮助某些无机盐和氨基酸的吸收,增强对传染病的抵抗力,有解毒作用。
维生素C广泛存在于新鲜水果和绿色蔬菜中,人体不能合成,它是一种水溶性维生素,人体摄入后比较容易流失,因此需要经常补充。
【实验步骤】(1)Na2S2O3溶液的标定(用K2C2O7标准溶液标定)准确移取20.00ml已配置好的K2C2O7标准溶液于碘量瓶中,加入10ml 6 mol/LHCl溶液,5ml KI溶液(浓度2%),摇匀,放在暗处5min,待反应完全后,加入50ml蒸馏水,用待标定的Na2S2O3溶液滴定至淡黄色,然后加入2 ml 5%的淀粉指示剂,继续滴定至溶液呈现亮绿色为终点。
平行测定三次,注意滴定过程中碘量瓶中颜色的变化,并计算出Na2S2O3溶液的浓度。
(2)I2标准溶液的标定(用已标定好的Na2S2O3溶液标定)准确移取20.00mlNa2S2O3溶液于250m锥形瓶中,加入50ml蒸馏水,2ml 5%的淀粉指示剂,用碘溶液滴定至稳定的蓝色,半分钟内不褪色即为终点。
平行测定3次,计算I2标准溶液的浓度。
(3)“统一鲜橙多”饮料中维生素C含量的测定。
准确移取25.00ml已标定的I2标准溶液于250ml容量瓶中,定容,摇匀。
用移液管移取20.00ml“统一鲜橙多”(“汇源果汁”)饮料,置于250ml锥形瓶中,加入50ml蒸馏水,2 ml 5%的淀粉指示剂,立即用稀释10倍的I2标准溶液滴定至出现稳定的浅蓝色,30s内不褪色即为终点,记下I2溶液体积。
平行三次,计算维生素C的百分量。
【数据处理】1.配制溶液时所称取得药品的质量:项目药品K2C2O7Na2S2O3·5H2O I2KI质量/g配制溶液的体积/ml250.00 250 250 2.数据处理Na2S2O3标定1 2 3V(Na2S2O3)/mlC(Na2S2O3)/mol*L-1c(Na2S2O3)/mol*L-1didr注:I2标定1 2 3V(I2)/mlC(I2)/mol*L-1c(I2)/mol*L-1didr注: c(I2)=“统一鲜橙多VC”测定1 2 3)/mlV(稀释I2C(VC)/mol*L-1c(VC)/mol*L-1didr注:。
