重要的杂环化合物
吡啶与嘧啶结构式__概述说明以及解释

吡啶与嘧啶结构式概述说明以及解释1. 引言1.1 概述吡啶和嘧啶是两种重要的杂环化合物,在有机化学和药物化学领域具有广泛的应用。
它们都属于氮杂环化合物,拥有特殊的分子结构和性质。
本文将对吡啶和嘧啶的结构式、性质及应用进行综述,并探讨它们的合成方法和反应机理。
1.2 文章结构本文共分为五个部分。
首先是引言部分,概述文章的目的和内容。
接下来是吡啶与嘧啶结构式的介绍,包括吡啶和嘧啶的具体结构式及其区别与联系。
第三部分将详细阐述吡啶与嘧啶的性质及其在不同领域中的应用。
然后,我们将着重探讨吡啶与嘧啶的合成方法和反应机理,包括各自的合成路线以及互相之间可能存在的转化反应机制。
最后,在结论中总结了吡啶与嘧啶的特点和重要性,并展望了未来研究领域可能面临的挑战。
1.3 目标本文旨在全面介绍吡啶和嘧啶的结构式、性质及应用,并对它们的合成方法和反应机理进行深入探讨。
通过该文,读者可以更好地理解吡啶和嘧啶这两种重要化合物,了解它们的特点和重要性,以及在不同领域中的应用前景。
同时,本文也为相关领域的研究人员提供了一些可能的发展方向和挑战。
2. 吡啶与嘧啶结构式2.1 吡啶的结构式吡啶是一种含有氮原子的芳香化合物,其分子式为C5H5N。
吡啶分子由一个六元环和一个氮原子组成,六元环上有五个碳原子和一个氮原子,碳原子上分别连接着一个氢原子。
吡啶的结构示意图如下所示:```H|H–C=N–C–H|H```2.2 嘧啶的结构式嘧啶也是一种含有氮原子的芳香化合物,其分子式为C4H4N2。
嘧啶分子由一个六元环和两个氮原子组成,六元环上有四个碳原子和两个氮原子。
其中一个氮原子连接着另一个含碳基团。
嘧啶的结构示意图如下所示:```H H\ /C = N –C|N|H```2.3 吡啶与嘧啶的区别与联系尽管吡啶和嘧啶都属于芳香异族化合物且具有相似的命名后缀“-in”,它们之间存在一些区别和联系。
区别:- 结构差异: 吡啶分子的六元环上只有一个氮原子,而嘧啶分子的六元环上有两个氮原子,并且其中一个氮原子连接着碳基团。
2-芳基苯并噻唑的合成研究进展

2-芳基苯并噻唑的合成研究进展摘要:2-芳基苯并噻唑是一类非常重要的杂环化合物,是构建药物分子、天然产物、功能材料和很多生物活性分子的骨架。
由于这些良好的特性,2-取代的苯并噻唑类化合物在医药方面有着很广泛的应用,它在抗菌、抗肿瘤、抗过敏、抗惊厥、消炎、保护神经系统和免疫调节等方面都有较好的活性。
关键词:2-芳基苯并噻唑;合成;研究一、2-芳基苯并噻唑的的重要性2-芳基苯并噻唑是一类非常重要的杂环化合物,是构建药物分子、天然产物、功能材料和很多生物活性分子的骨架[1] 例如,唑泊习他(zopolrestat1)是一种抑制醛糖还原酶的药物,能够治疗糖尿病[2];2-(4-氨基苯基)苯并噻唑及其衍生物(如5F203(2)和PMX610(3))是一类高效且具有良好选择性的抗肿瘤试剂,对人类乳腺癌、卵巢癌和结肠癌有毫微摩尔级的抑制活性;席夫碱(4)可用作类淀粉蛋白抑制剂,用于治疗老年痴呆症(图1)。
图1含取代基团的苯并噻唑类药物苯并噻唑类化合物在农用化学品中也表现出除草、抗菌和杀毒等方面的活性。
除草剂Benazoline是人工合成的具有生物活性的苯并噻唑衍生物。
另外,苯并噻唑类化合物在工程材料领域中也有着广泛应用,被用作塑料染色剂、橡胶硫化促进剂以及荧光探针材料等。
例如,荧光素存在于萤火虫中,在其体内经酶氧化导致生物发光;2-巯基苯并噻唑作为自由基转移试剂,在聚丁二烯和聚异戊二烯的硫化反应中起催化作用。
二、2-芳基苯并噻唑的合成研究进展1.以邻氨基芳基硫酚为原料合成2-芳基苯并噻唑最常用的方法是以邻氨基芳基硫酚为原料,和羧酸、醛、腈类、β-二酮或苄胺等缩合,该类反应经过了中间体邻酰氨基苯硫酚。
当使用芳基羧酸和邻氨基芳基硫酚反应时,一般需要在强酸或者高温条件下才能够得到较高产率的2-芳基苯并噻唑。
邻氨基苯硫酚和芳香醛也能够缩合得到2-芳基苯并噻唑,该方法一般需要Lewis酸或者强氧化剂。
除此之外,能够提供苯甲酰基的化合物都能与邻氨基苯硫酚反应生成2-芳基苯并噻唑。
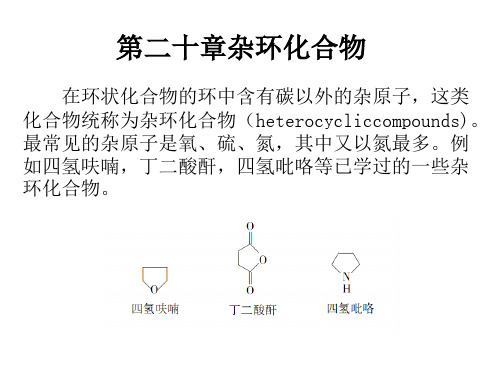
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
2,3,4-三氟苯胺 芳香族杂环化合物

1. 三氟苯胺简介三氟苯胺(2,3,4-三氟苯胺)是一种重要的芳香族杂环化合物,化学式为C6H4F3N。
它是三氟甲基苯胺的同分异构体,具有三个氟原子取代苯环上的氢原子。
三氟苯胺在有机合成、药物合成和材料科学领域具有广泛的应用价值。
2. 三氟苯胺的性质2.1 物理性质三氟苯胺是白色至浅黄色结晶固体,具有具有特殊的芳香气味。
它的熔点约为6-8摄氏度,沸点约为193-195摄氏度。
三氟苯胺在常温下不溶于水,但可溶于大多数有机溶剂,如乙醇、乙醚和二甲基甲酰胺。
2.2 化学性质在化学反应中,三氟苯胺表现出一系列重要的性质。
它可以发生氢键和范德华力作用,与Lewis酸和亲电试剂发生取代反应,同时也可作为亲核试剂与电子不足的化合物发生亲核加成反应。
三氟苯胺还可参与芳烃的氟化反应、重氮化反应等重要的有机合成反应。
3. 三氟苯胺的应用3.1 有机合成由于三氟苯胺具有较强的亲电性和亲核性,在有机合成中被广泛应用于芳香族化合物的合成反应。
它可作为重要的试剂在芳香族硝化反应中提高反应的亲电取代活性,促进化学反应的进行。
3.2 药物合成三氟苯胺也是药物合成领域重要的中间体,许多具有生物活性的有机化合物的合成中都需要三氟苯胺作为原料。
它作为一种重要的杂环化合物,可以用于合成抗血小板药物、抗癌药物和抗菌药物等。
3.3 材料科学在材料科学领域,三氟苯胺可用于制备具有特殊功能的高性能材料。
它可以用于合成高性能聚合物、涂料和功能性有机材料,这些材料具有优异的耐热性、耐腐蚀性和电学性能,广泛应用于航空航天、电子、光学等领域。
4. 三氟苯胺的合成方法4.1 氟化反应三氟苯胺可通过三氟甲基苯的氟化反应制备。
氟化反应是以三氟甲基苯为原料,在氢氟酸、氢氧化钠等条件下进行反应,生成三氟苯胺。
4.2 重氮化反应另外,三氟苯胺还可通过重氮化反应合成。
在重氮化反应中,三氟甲基苯胺首先发生硝基化反应制成重氮化合物,再通过还原反应得到三氟苯胺。
5. 结语3,4-三氟苯胺作为一种重要的芳香族杂环化合物,在有机合成、药物合成和材料科学领域具有广泛的应用价值。
吡唑环的合成方法_概述及解释说明

吡唑环的合成方法概述及解释说明1. 引言1.1 概述吡唑环是一种重要的有机化合物,具有广泛的应用领域。
它不仅在药物领域扮演着重要角色,还广泛用于材料科学、农药合成和有机光电等领域。
因此,吡唑环的合成方法对于有机化学研究和实际应用至关重要。
1.2 文章结构本文将对吡唑环的合成方法进行综述。
首先,我们将介绍传统方法和新颖方法两个方面。
其中传统方法是指已经被广泛接受并使用的吡唑环合成方法,而新颖方法则包含了近年来研究者们不断提出的新思路和技术。
接下来,我们将比较传统方法与新颖方法的优缺点,并分析其适用性及潜在发展方向。
其次,在解释说明部分,我们将深入探讨吡唑环的结构和性质。
通过系统地分析其分子组成和特殊的环状结构,我们可以更好地理解吡唑环化合物的特点及其反应活性。
此外,我们还将介绍吡唑环在不同应用领域中的重要作用,如药物研究、农药合成以及有机光电材料等,并展望未来吡唑环研究的发展方向。
1.3 目的本文旨在全面介绍和讨论吡唑环的合成方法,并探讨其结构与性质以及广泛应用领域。
通过对传统方法和新颖方法的比较分析,我们希望能够为研究者提供一种思路和技术选择的参考,并为吡唑环合成方法的进一步发展提供展望和建议。
最终,我们期待本文能够促进吡唑环化合物的研究和应用,推动有机化学领域的发展。
2. 吡唑环的合成方法:2.1 传统方法:传统上,吡唑环的合成通常基于亲电芳香取代反应和环化反应。
其中最典型的方法是通过让已存在的吡唑片段与其他化合物发生反应来构建吡唑环结构。
例如,一种常见的传统方法是以卤代芳烃或酸作为底物,并与氨基化合物进行缩合反应,然后在适当条件下进行氧化和脱水反应得到目标产物。
此外,将卤代吡啶与羰基化合物通过钯催化偶联反应(如Suzuki偶联、Heck 偶联等)也是一种常见的传统方法。
该方法具有选择性好、反应条件温和等优点。
2.2 新颖方法:随着有机化学合成领域的发展,许多新颖的合成策略和方法被设计出来用于吡唑环的合成。
9-杂环化合物的应用-香料

吡嗪 2-甲基2,3-二甲基2,5-二甲基2,3,5-三甲基2,3,5,6-四甲基2-乙基-3-甲基2-甲基-5-乙烯基3-甲基-2-异丁基2-乙酰基2-异丁基-3-甲氧基2-仲丁基-3-甲氧基2-异丙基-3-甲氧基5,6,7,8-四氢喹啉 2-甲氧基-3(或5-或6-)-异丙基
某些吡嗪化合物及其感官性能
O OEt
C
R
O
CHO
+ Cl
C H CH3
(CH3CO) 2
O O
RO
BF3
RO
O
第二节 吡嗪类香味物质
1、一些重要的吡嗪化合物
1)吡嗪类在自然界的存在及形成 吡嗪类属于含氮六员杂环化合物,已从各种食物体系中分离出来,它 也是在自然界中分布最广的香味物质,最早发现吡嗪类在自然界的存在是 在1962年鉴定出其存在于杂醇油中。此后,大量出现关于该类物质存在的 报道。吡嗪类物质主要存在于热处理食品中,例如:牛肉、大麦、可可、 咖啡、花生、爆米花和黑麦面包中。除烷基取代的吡嗪在自然界存在外, 尚有烷氧取代的吡嗪化合物物也存在于自然界申。例如:2-烷基-3-甲氧基 吡嗪发现在钟形胡椒和豌豆中存在;2-异丁基-3-甲氧基吡嗪和2-仲丁基3-甲氧基吡嗪存在于格蓬油中。 食品中吡嗪类的形成有各种各样的解释,其大体可以分成两种理论:第 一,氨基酸和糖类或糖的降解物质相互作用的结果可以生成吡嗪类化合物, 也即梅拉德(Maillard)反应产生吡嗪类化合物;第二,α-羟基酸或氨基酸 的热解反应产生吡嗪类及烷基取代的衍生物。
HO OH
HO HO
OO
OO HEAT
HO HO
OO
O
HO
+
+
OR O
O
O
第十二讲 杂环化合物

S
1 2 a
O
O
基本环环边编号
N O N H N
基本环
N N
N N
O
噻吩并[3,2b]吡咯
呋喃并[3,2b]吡喃
吡唑并[4,5d]恶唑
吡嗪并[2,3d]哒嗪
二、六元杂环化合物
(一)吡啶:
H H H N
吡啶分子 中的键
H H
吡啶分子 中的p轨道
N
吡啶分子中 的共轭体系
吡啶键长平均化程度较高,有芳香性。 吡啶环亲电取代比苯难。 取代基进入间位,且收率偏低。
O
O
O
O
O
O
O
O
O
O
α-吡喃 α-吡喃酮 γ-吡喃 γ-吡喃酮 香豆素
O
H
+
色酮
OH
O
O
γ -吡喃酮的徉盐是芳香体系。
CH=CHPh N PhCH=CH N CH=CHPh
羟醛缩合型
CH3 N H3C N CH3
PhLi
CH2Li N H3C N CH3
C H3I
CH2CH3 N H3C N CH3
烷基化反应
嘧啶的合成
由-二羰基化合物(或类似物)与1,1-二胺类 化合物合成
常用的1,1-二胺类化合物:
H2N O H2N
N
-甲基吡啶
COOH
N
H
N
-呋喃甲醛 3-呋喃甲醛
-吡啶甲酸 3-吡啶甲酸
-吡咯甲酰胺 2-吡咯甲酰胺
-吡啶甲酸 3-吡啶甲酸
互变异构
H N H3C N N H N
H3C
Br
H N N Br
N NH
六元杂环.

H2SO4 heat
H H2C C CHO
NH2 +
H H2C C CHO
Michael addition
H
N
H+
OHC
H N
H+ , - H2O
OH
H N OHC H N
H N
+
NO2
N
NH2
+
以 α,β-不饱和醛或酮代替甘油、酸也可用磷酸或其他酸
NH2 +
H2C
HO C CCH3
FeCl3, ZnCl 2 PhNO2, heat
环上的亲核取代
环上有好的离去基团 ( 如 NO2 , Cl ) 可被取代
Cl
NH3
NH2
N
100 - 200 ℃ N
NaOMe N Cl MeOH, heat
N OMe
N Br
NaOH H2O, heat
Cl PhNH2
N
heat
N OH NHPh N
强碱亲核试剂---- 消除-加成机理
PhLi N
N
+
N
浓 H2SO4
N
22 ℃
SO3H N
N NO2
Br Br2, 浓 H2SO4
N
Ag2SO4, heat
N
+
N
Br
亲核取代反应
NaNH2, Xylene 100 ℃
N
n-BuLi Toluene N
N
NH2
N
Bu-n
喹啉和异喹啉 氧化和还原均比苯容易
氧化:苯环优先 还原:吡啶环优先
KM nO4
嘧啶环上有活化基团 ( 如 OH、NH2 等 ) 时,可硝化、磺化
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 纯粹的糠醛是无色有特殊气味的液体,熔点— 38.7℃,沸点161.7℃,相对密度1.159,在水中 溶解度为9.1%,易容于乙醚和乙醇等有机溶剂。 在空气中被氧化聚合为黄色、棕色以至黑褐色的 物质。在醋酸存在下,它与苯胺呈鲜红色反应, 可用于糠醛和戊糖的鉴别。 • 糠醛是一个不含—氢原子的不饱和醛,化学 性质很活泼,容易发生氧化、还原、歧化和聚合 等反应,是有机合成工业的重要原料,广泛的应 用于油漆、树脂、医药和农药等工业。
NH 2
NH 2
N
N
N H
O
N H
OH
胞嘧啶(2-羟基-4-氨基嘧啶)
O OH
NH
N
N H
O
N H
OH
• • 维生素B6又名盐酸吡哆素,它包括吡哆醇、吡哆醛和吡哆胺: • CH2OH CH2NH2
CHO
HO H3C
CH2OH
N
HO H3C
CH 2OH
N
HO H3C
CH2OH
N
• 吡哆醇 吡哆醛 吡哆胺 • • • 维生素B6为无臭的白色晶体,在空气中稳定,易溶于水和乙醇。它广 泛存在于鱼、肉、蛋、蔬菜及谷物中。它参与生物体内氨基酸和脂肪 的代谢。在临床上用于治疗脂溢性皮炎和促进白细胞的生成。
四、三唑类的衍生物
• 三唑类衍生物一般是指分子中含有三个氮原子的五元杂环化合物,这 里主要讨论1,2,4—三唑的衍生物。1,2,4—三唑是白色晶体, 熔点121℃,沸点260℃。它有芳香性,对氧化剂很稳定,有很弱的 碱性。同时,氮上的氢又显弱酸性,可被活泼金属取代。它的衍生物 三唑酮和三唑醇是人工合成的杀菌剂:
NH
N
N
HN
• •
图12-6 卟吩(porphin)
CH3
CH3 CH CH2
CH H3C N
CH2
CH3 CH N CH2
C20H39O2CCH2CH2 CH3O2C O CH3
N N
N Mg N R CH2CH3
Fe N H3C CH3 CH2CH3 N R
叶绿素a: 血红素
• 卟吩环中的氮原子可以用共价键和配位键与不同金属离子结合。例如, 在叶绿素中与镁结合,在血红素中与铁结合,在维生素B12中则是与 钴结合。 • 叶绿素于蛋白质结合广泛存在于植物的叶和绿色茎中。绿色植物进 行光合作用时,它能把吸收的太阳能转变为化学能,并同时合成糖类 化合物。叶绿素有a、b、c、d四种:叶绿素a存在于所有的高等植物、 藻类和蓝细菌中;叶绿素b主要存在于高等植物、绿藻中;叶绿素c则 存在于硅藻、褐藻、甲藻中;叶绿素d仅在红藻中发现。其中最重要 的有a和b两种:叶绿素a为蓝黑色的晶体,在乙醇溶液中为蓝绿色; 叶绿素b为黄绿色的粉末,在乙醇溶液中为黄绿色。二者的差别仅在 于环上R 基不同,R是为叶绿素a,R是为叶绿素b。在多数植物体内, a:b=3:1。 • 叶绿素不溶于水,而溶于丙酮、乙醇、氯仿等有机溶剂中,其乙醇 溶液有很强的荧光。叶绿素分子中有两个酯键,易水解生成相应的酸 和醇。在碱性条件下,用硫酸铜溶液小心处理叶绿素,铜离子代替了 镁离子而进入卟吩环中,故叶绿素仍保持了绿色。在制植物标本时, 常用此法保持植物的绿色。血红素存在于哺乳动物的血红球中,它与 蛋白质结合成血红蛋白,血红蛋白的功能是输送氧气,供组织进行新 陈代谢。用盐酸水解血红蛋白,则得到氯化血红素。 • 维生素B12又名钴胺素,是结构较复杂的一种天然化合物。它主要存 在于动物的肝脏中,为深红色针状结晶,是抗恶性贫血的一种水溶性 维生素。
5 6 7 8 4 3 2
O
O
1
苯并吡喃 常见的花色素有下列三种:
2—苯基苯并吡喃
HO OH
HO
HO OH
HO
OH
OH
O
O
+ Cl -
+ Cl -
氯化天竺葵素
氯化青芙蓉素
HO OH OH
HO
OH
O
+ Cl -
OH
氯化飞燕草素
• 各种花色苷在不同的PH介质中显示出不同 的颜色。同一种花色苷在不同的植物中或 种植在不同土壤中的同一种花草也能呈现 出不同的颜色。例如,在玉蜀黍穗中的青 芙蓉素苷显紫色,而在玫瑰花中的青芙蓉 素苷显红色。花色苷颜色的变化是由于其 分子中的花色素在不同的PH介质中的结构 和颜色的变化如下:
• 七、苯并吡喃的衍生物 • 苯并吡喃是苯和吡喃稠合而成的。许多天然色素都是它们的衍生物, 如花色素、儿茶素等。 • 花色素是苯并吡喃的重要衍生物之一。它们与糖结合成糖苷存在于花 或果实中,这种苷叫做花色苷。它们导致植物的花和果所呈现出的各 种颜色,用酸水解花色苷即得糖和花色素的佯盐。各种花色素都含有 2-苯基苯并吡喃的基本骨架:
五、吡啶的衍生物
• 吡啶存在于煤油中,它的衍生物广泛存在于自然界,并且大都具有强 烈的生理活性,常见的有维生素PP和维生素B6等。 • 维生素PP是烟酰胺两种物质的总称。它属于B族维生素:
COOH
N
烟酸
N
O C
NH2
烟酰胺
•
烟酸即—吡啶甲酸,为无色针状晶体,熔点235.2℃,易溶于热水, 对酸碱稳定。烟酰胺即—吡啶甲酰胺,为白色针状结晶或粉末,熔点 133℃,易溶于水。他们存在于肉类、肝肾、乳汁、花生、米糠和酵 母中。人体缺乏维生素PP会引起癞皮病,故维生素PP又称做抗癞皮 病维生素。
OH OH OH HO
儿茶素
O
O
OH
OH OH
HO
OH
没食子儿茶酸
八、嘧啶的衍生物
• 嘧啶是含有两个氮原子的六元杂环。它是无色晶体,熔点20~22℃, O O 沸点
HN N
HN H N
O
O N H N H
O N H N H
黄嘌呤
尿酸
组成核酸的嘌呤碱有腺嘌呤和鸟嘌呤,二者都存在户变异构现象:
NH 2 NH N N HN
OC6H11O5 OC6H11O5
HO
O
O
OH
青芙蓉苷色素
OC6H11O5 OC6H11O5
OC6H11O5 OC6H11O5
HO
OH
O
+ OH
HO
O
O
O-
青芙蓉苷阳离子(红色,PH<3)
青芙蓉苷阴离子(蓝色,PH>11)
• 儿茶素是茶叶、儿茶、葡萄等中所含鞣质 的主要组成部分。从新鲜茶叶中分离出的 柔质中含有12%左右的五倍子酸,78%左 右的儿茶五倍子酸酯及一些游离的儿茶素。 儿茶素不是鞣质,因此不具有鞣质的特性。 • OH OH •
二、噻吩的衍生物
H
• 生物素和先锋霉素是 噻吩的重要衍生物, 其结构如下:
O S
H
N
O NH
S
HOOC(CH2)4 H H
生物素
CH 2 C NH
Nቤተ መጻሕፍቲ ባይዱO S O
CH 2O COONa
C
CH 3
先锋霉素I
• 生物素又名维生素H,是人体必需的维生素之一。它 广泛存在于动植物体内,如谷物、蔬菜和肉类中;生 物素是无色针状晶体,熔点232~233℃,溶于水和乙 醇。在中性或碱性条件下稳定,与强碱或氧化剂易分 解。在动物的生理过程中参与CO2的固定及羧化过程。 人体缺乏它,会导致身体疲乏,食欲不振,贫血和皮 肤发炎、脱屑等。 • 先锋霉素是由头孢菌素C半合成的一类广谱抗生素。 目前人工合成的先锋霉素类药物有十余种,其中先锋 霉素又叫头孢金素,使白色结晶粉末,味苦,易溶于 水,难溶于有机溶剂。它的抗菌谱广,主要用于对青 霉素耐药的金黄色葡萄球菌和一些革兰氏阴性杆菌引 起的严重感染,如尿道和肺部的感染、败血症、脑膜 炎及腹膜炎等。
第四节 重要的杂环化合物
一· 呋喃的衍生物
(一)—呋喃甲醛
它最早是由米糠与稀酸共热制成的,故又称糠醛。糠醛的来源丰富,通常利用含 有多聚戊糖的农副产品,如米糠、玉米芯和花生壳等同稀硫酸或盐酸加热脱水制 取: 稀 H2SO4 稀 H2SO4 (C5H8O4)n + nH2O n HO CH CH OH CHO -n(H2O) O H CH C H CHO HO OH 多聚戊糖 糠醛 戊醛糖
(二)呋喃类药物
• 呋喃坦丁、呋喃唑酮 和呋喃西林是一类5— 硝基呋喃甲醛的衍生 物。它们都是人工合 成的广谱抗菌药物, 其结构是如下:
O2N O CH N N
O
N
O
呋喃坦丁
H
呋喃唑酮
O
O2N
CH N NH C N
O
呋喃西林
O2N
CH
O
N
O
N O
介绍
• 呋喃坦丁又名呋喃妥因,它是鲜黄色晶体,味苦,熔点约 258℃(分解),难溶于水及有机溶剂,可溶于N,N—二 甲基甲酰胺中。由于它的分子中含有酰亚胺结构,故显弱 酸性,能与碱生成盐。它主要用于抑制和杀灭大肠杆菌、 金黄色葡萄球菌、化脓性链球菌和伤寒杆菌等,常用于治 疗泌尿系统的炎症。 • 呋喃唑酮又名痢特灵。它是黄色粉末,熔点254~258℃ (分解),难溶于水及有机溶剂,也显弱酸性。大肠杆菌、 炭疽杆菌、痢疾杆菌和伤寒杆菌等对其最为敏感,故常用 于肠道感染和菌痢等。 • 呋喃西林又名呋喃新。它是柠檬黄色结晶粉末,难溶于水 及醇,主要对葡萄球菌、痢疾杆菌和枯草杆菌等有杀灭和 抑制作用。由于它的毒性较大,已很少内服,多作为外消 炎剂。
H
NH
CH 2
N
C
C CH 3
CH 2OH
NH
NH
CH 2
O
N
CH 2
N
N
N
N N H
N
N
N H
N
N H
玉米素
激动素
6-苄氨基嘌呤
•
细胞分裂素能促进植物细胞分裂,扩大和诱导细胞分化, 以及促进种子发芽等。它们常分布于植物的幼嫩组织中, 例如,玉米素最早是从未成熟的玉米种得到的。人们常用 细胞分裂素促进植物发芽,生长和防衰保绿,以及延长蔬 菜的贮藏时间和防止果树生理性落果等。 • 123~124℃,易溶于水。吡啶也是由六原子组成的闭合共 轭体系。由于环上有两个强的吸电性氮原子,故环中各碳 原子上的电子密度很低,因此,嘧啶难发生亲电取代反应, 不易被氧化,碱性比吡啶弱得多,但仍能与酸成盐。嘧啶 在自然界并不存在,但其衍生物广泛存在于自然界,例如, 核酸和维生素B1 中都含有嘧啶环。组成核酸的嘧啶碱有 胞嘧啶、尿嘧啶和胸腺嘧啶。这三种嘧啶碱都有酮式和烯 醇式互变异构现象:
