常见有机物同分异构体小结
一烷烃、烯烃、炔烃、芳香烃

§1.有机物的同分异构体二、同分异构体㈠、方法:主链由长到短,支链由简到繁,位置由心到边不到端,排布由对到邻到间。
(1)等效氢法:分子中有n种“等效”氢原子,其一元取代物就有n种。
①同一个碳原子上的氢原子属于“等效”氢原子。
②同一分子中处于轴对称位置或镜面对称位置上的氢原子属于“等效”氢原子。
③同一个碳原子上相同取代基上的氢原子属于“等效”氢原子。
CH3-CH2-CH-CH2-CH3等效氢有种,一卤代物有种,核磁共振氢谱∣CH2-CH3图上有峰。
(2)换元法一种烃如果有m个氢原子可被取代,那么它的n元取代物与(m-n)元取代物种类相等。
【例1】苯的二氯代物有种,四氯代物有种。
㈡、各类有机物的同分异构体1、C n H2n+2(烷烃)→C n H2n+2O(n≥2,醇、醚)。
【例3】-C4H9的异构体有种,分别是;-C3H7的异构体有种,分别是。
(2)C n H2n+2O(n≥2,醇、醚):如C3H8O的同分异构体有、、。
2、C n H2n(n≥3,烯烃、环烷烃)→C n H2n O (n≥3,醛、酮、烯醇)→C n H2n O2(n≥2,羧酸、酯、羟基醛)→C n H2n O3 (n≥2,羟基酸)⑴C n H2n(n≥3,烯烃、环烷烃):C4H8、、、。
⑵C n H2n O (n≥3,醛、酮、烯醇):C3H6O 、、。
⑶C n H2n O2(n≥2,羧酸、酯、羟基醛):C3H6O2、、、⑷C n H2n O3 (n≥2,羟基酸):C2H4O33、C n H2n-2 (n≥4,炔烃、二烯烃、环烯烃) 。
C4H6 、、、、。
4、C n H2n-6 (n≥6,苯及同系物)→C n H2n-6O (n≥6,酚、芳香醇、醚)。
⑴CnH2n-6 (n≥6,苯及同系物):C8H10、、、。
⑵CnH2n-6O (n≥6,酚、芳香醇、醚):C7H8O 、、、、§2.烷烃、烯烃、炔烃、芳香烃物质分子结构主要化学性质(有机物写结构简式)甲烷⑴分子式⑵电子式⑶结构式⑷结构简式⑸空间构型键角。
同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析
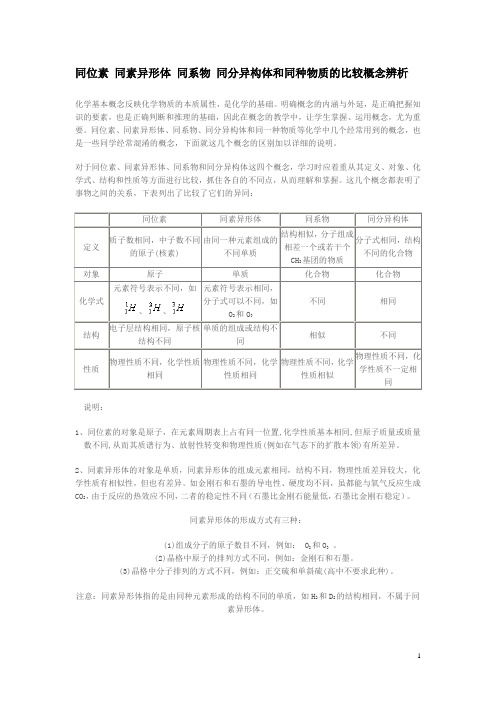
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:、、说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
同系物、同分异构体、有机物物理性质归纳

-COOCH3
9、
10、COOCH3
COOCH3
11、CH2=CHCOOCH2CH3 12、(CH3)2CHCOOCH(CH3)2
属于苯的同系物的是
3
。
二、下列物质中:
1、 4、 2、CH2=CHCH=CH2
-CH=CH2
CH3
3、
-CHCH3 -CH2CH3
5、(CH3)3COH 8、
6、CH2CHCH2
练习:
下列每组中的两种物质间不互为同分异 构体的是:( D ) A、CH3CH2CH2CH3 与 CH3CH(CH3)2
B、CH3CH=C(CH3)2 与 CH2=CHCH(CH3)2 C、
D、
—CH2OH 与 CH3—
与
—OH
同分异构体——分子式相同,而分子结 构不同的化合物互称同分异构体。 同系物——结构相似,在分子组成上相 差一个或若干个CH2原子团的物质互称同系 物。 同素异形体——同种元素的不同单质互 称同素异形体。 同位素——质子数相同而中子数不同的 同种元素的原子互称同位素。
(3)换元法
[例] 已知C6H4Cl2 有三种异构体,则C6H2Cl4 有三种异构体。(将H代替Cl)
[练习] 二恶英是一类具有高毒性芳香族化合物的总称, 其母体A结构如图:
二 (1)A 一氯代物有 种。 (2) A 的七溴代物共有 二 种。 (3)A 二氯代物有 10 种。
3、同分异构体的书写: (4):给出若干个基团进行组合。 1、C11H16 的苯的同系物中, 只含有一个支链, 且支链上含有两个“ —CH3” 的结构有四种 , 写出其结构简式.
二、下列物质中:
1、 4、
CH3
2、CH2=CHCH=CH2
有机物的结构特点(同分异构体)

4种。
练习4: 消去反应) 有几种?
CH2CH2COOH 的同分异构体(且满足能发生银镜反应和
练习5:
— CH CH COOH
2 2
的同分异构体且满足
(1)苯环上只有一个侧链 (2)属于饱和脂肪酸的酯类 有多少种?写出结构 简式
2种 硼氮苯结构类似苯,则其一氯取代产物有__ 其二氯取代产物有__ 4种
④ ③ ②
①
并五苯
判断与书写规律二---技巧性 常见烷基的种类要
请快速判断出满足以下条件的物质的同分 异构体的个数。 1、分子式为C4H10O的醇的同分异构体有___ 4 种; 4 种。 2、分子式为C5H10O的醛的同分异构体有___ 变式提高: 1、 分子式为C4H10O的醇中能氧化成醛的同分 2 种; 异构体有___ 2、(2011年海南卷) C4H8O2的同分异构体中
练习6:
醛A的同分异构体甚多,其中
属于酯类化合物,而且结构式中有苯环结构的同分
异构体就有6个,它们是___、_____ 、____、 ______、____、______。
2005北京;26、有机物A(C6H8O4)为食品包装 纸的常用防腐剂。A可以使溴水褪色。A难溶于 水,但在酸性条件下可发生水解反应,得到B (C4H4O4)和甲醇。通常状况下B为无色晶体, 能与氢氧化钠溶液发生反应。
2 CH3CH2CH2OH和 CH3CHCH3
3 CH3CH2CHO和 CH3COCH3
位置异构
官能团异构
4 CH3— CH — CH3和 CH3 CH2CH2 CH3 碳链异构
CH3 5 CH2=CHCH2CH2CH3和CH3CH2CH = CHCH3 位置异构
2、同分异构体的书写
有机物的同分异构体知识点汇总

有机物的同分异构体知识点汇总1.同分异构体是指化合物具有相同的分子式,但具有不同结构的现象。
这种现象在有机化合物中广泛存在,也存在于某些无机化合物中。
2.同系物、同分异构体、同素异形体和同位素是四种不同的概念。
同系物指结构相似、组成相差CH2原子团的有机物,同分异构体指分子式相同但结构不同的化合物,同素异形体指单质中同一元素性质不同的形态,同位素指原子质子数相同但中子数不同的原子。
3.分子结构不同是由分子里原子或原子团的排列方式不同而引起的。
同分异构现象在某些化合物中强烈存在,而在分子组成、分子结构越简单的化合物中,同分异构现象越弱。
4.同分异构体之间的化学性质可能相同也可能不同,但它们的物理性质一定不同。
在同分异构体中,分子里支链越多,熔沸点一般越低。
5.分子式相同则相对分子质量必然相同,但相对分子质量相同而分子式不一定相同。
最简式相同的化合物不一定是同分异构体。
同分异构体是指由相同的元素组成,但分子结构不同的化合物。
在有机化学中,同分异构现象非常普遍,主要包括四种类型:碳链异构、官能团位置异构、官能团类别异构和顺反异构。
碳链异构是指由于碳原子连接次序不同引起的异构,例如正丁烷和异丁烷。
因为烷烃分子中没有官能团,所以只存在碳链异构。
另外,戊醛和2-甲基丁醛也属于碳链异构。
官能团位置异构是指由于官能团位置不同引起的异构,例如CH3CH=CHCH3和CH3CH2CH=CH2,以及1-丁醇和2-丁醇。
含有官能团的有机物一般都存在官能团位置异构。
官能团类别异构是指分子式相同,但官能团类型不同所引起的异构。
除了烷烃以外,绝大多数有机化合物分子都存在官能团类别异构体。
例如炔烃、二烯烃、芳香烃、饱和脂肪醇、醚、醛、酮、环醚、环醇、烯基醇、羧酸、酯、羟醛等。
顺反异构是指在立体化学中,分子中的两个官能团或基团的位置关系不同,导致分子的手性不同。
顺反异构体是一种非常特殊的同分异构体,例如L-和D-葡萄糖就是顺反异构体。
有机化合物的同分异构体及命名

XX,a click to unlimited possibilities
汇报人:XX
目录
01 添 加 目 录 项 标 题 03 有 机 化 合 物 的 命 名
02 有 机 化 合 物 的 同 分 异构体
04 同 分象异构命名:根 据分子的构象不同, 采用不同的名称, 如“椅式”和“船 式”等。
键合异构命名:根 据化合物中键合方 式的不同,采用不 同的名称,如“内 酯”和“外酯”。
Part Five
同分异构体的应用
在化学教学中的作用
帮助学生理解有机化合物的结构与性质 培养学生的空间想象能力和逻辑思维能力 提高学生分析问题和解决问题的能力 为后续学习有机化学打下基础
同分异构体可以降低石油产品的成 本和提高经济效益
THANKS
汇报人:XX
在有机合成中的应用
同分异构体可用 于合成不同的有 机化合物,增加 有机化合物多样 性。
同分异构体具有 相同的分子式, 但不同的结构, 可以作为合成子 或中间体使用。
同分异构体可以 用于合成具有特 定性质的有机化 合物,如药物、 农药等。
同分异构体的合 成有助于深入了 解有机化合物的 性质和反应机理。
衍生物命名法:以一个核心的有机化合物为基础,通过改变某些取代基来 得到新的有机化合物
系统命名法
定义:根据国 际命名规则, 采用特定的词 头、词干、数 字等来命名有 机化合物的方
法。
优点:能够准 确、简洁地表 示有机化合物 的结构,避免
歧义。
规则:遵循先 列出取代基, 再列出主链的 原则,同时考 虑取代基的优 先顺序和命名
在药物研发中的应用
同分异构体可用于发现新药,通过改变药物分子 的同分异构体,可以改变药物的活性、药效和副 作用。
有机物的同分异构体

有机物的同分异构体有机化学是研究有机物结构、性质和反应的一门科学。
在有机化学中,同一分子式的有机物可以存在不同的结构,这就是同分异构体的现象。
同分异构体具有相同的分子式,但它们的结构以及性质可能有所不同。
本文将系统地介绍有机物的同分异构体,并探讨它们的形成原因和应用。
一、同分异构体的概念同分异构体,指的是分子式相同,但结构不同的化合物。
它们的相对分子质量相等,但分子结构的排列方式不同,导致其化学性质和物理性质的差异。
由于同分异构体的存在,扩展了有机物的种类,增加了有机化学的研究难度。
二、同分异构体的分类同分异构体主要可以分为以下几类:1. 键式同分异构体:它们的分子式相同,但键的连接方式不同。
例如,甲醇(CH3OH)和甲醚(CH3OCH3)就属于键式同分异构体。
甲醇中氧原子和碳原子通过一个C-O单键相连,而甲醚中氧原子和碳原子通过两个C-O单键相连。
2. 位置同分异构体:它们的分子式相同,但它们的官能团或取代基的位置不同。
例如,2-丙醇和1-丙醇就属于位置同分异构体。
2-丙醇的羟基(OH)与第二个碳原子相连,而1-丙醇的羟基与第一个碳原子相连。
3. 环式同分异构体:它们的分子式相同,但它们的分子结构中存在不同的环。
例如,环戊烷和环己烷就是环式同分异构体。
环戊烷由一个五元环组成,而环己烷由一个六元环组成。
4. 构象同分异构体:它们的分子式相同,但它们的空间构型不同。
例如,顺丁烯和反丁烯就是构象同分异构体。
顺丁烯的两个甲基基团在同一侧,而反丁烯的两个甲基基团在相对侧。
三、同分异构体的形成原因同分异构体的形成原因主要有两个方面:1. 分子结构的不同排列:同一分子式的有机物可以通过不同的键的连接方式、位置的不同等来形成不同的结构。
2. 手性中心的存在:某些有机物分子中存在手性中心,即一个碳原子附着有四个不同的基团。
手性中心的不对称性导致了两种不对称的结构,从而形成了同分异构体。
四、同分异构体的应用同分异构体在有机化学和生物领域具有重要的应用价值。
高中化学重要知识点有机化合物的同分异构体

高中化学重要知识点有机化合物的同分异构体同分异构体是有机化学中常见的现象,指的是化学式相同,结构式和性质却不同的化合物。
它们具有相同的分子式,但由于原子间的排列方式不同,导致它们的结构和性质差异显著。
同分异构体的存在在化学研究和应用中具有重要意义,它们的发现和研究有助于人们对有机化合物的理解和利用。
一、同分异构体的分类同分异构体主要分为以下几种类型:1. 结构异构体:分子内原子的连接方式不同,分为链式异构体、位置异构体、环式异构体等。
比如正丁烷和异丁烷就是典型的结构异构体,它们的化学式均为C4H10,但分子结构不同,导致性质的差异。
2. 功能异构体:具有相同分子式,但它们在空间结构中的部位不同,从而产生不同的功能。
比如右旋糖和左旋糖就是功能异构体,它们都是分子式为C6H12O6的己醛,但是它们的旋光性质不同,右旋糖旋光,左旋糖则左旋光。
3. 立体异构体:分子内原子空间排列方式的不同,可分为构型异构体和对映异构体。
构型异构体是指在空间中存在固定的构型,如顺式异构体和反式异构体。
对映异构体则是指分子结构中具有手性中心的异构体,它们的镜像关系可以通过非重叠重叠一一对应。
二、同分异构体的性质差异同分异构体之间具有显著的性质差异,主要体现在以下几个方面:1. 物理性质:对于同分异构体来说,它们在物理性质上常常有明显的差异,如沸点、熔点、密度等。
2. 化学性质:同分异构体的化学性质也会存在差异,如反应活性、稳定性等。
不同结构的同分异构体由于原子间连接方式的不同,使得它们对不同的反应条件和环境的响应不同,从而表现出不同的化学性质。
3. 生物活性:对于一些有机化合物来说,同分异构体的生物活性差异常常十分显著,具有重要的医药和生物学研究价值。
例如,药物的同分异构体可能表现出不同的药效或毒性。
三、同分异构体的应用同分异构体不仅在化学研究中有重要作用,也在实际应用中有广泛的应用:1. 准确鉴定:对于有机化合物来说,同分异构体的存在使得对化合物的准确鉴定变得更具挑战性,需要借助各种分析技术来区分同分异构体。
