中考化学考点分值分布表
2021年-广东省中考化学-第一部分-第五单元-第18课时-常用仪器与实验基本操作

不能加热
(续表) 仪器
用途
注意事项
酒精灯
用于加热
详见本讲考点2的“物 质的加热”部分
胶头滴管用过后应立即
胶头滴管、 胶头滴管用于吸取和滴加 ___清__洗__干__净___,再去吸
滴瓶 少量液体;滴瓶用于盛放 取其他液体;滴瓶上的
液体药品
滴管与滴瓶配套使用,
不可用水冲洗
铁架台 用于固定和支持各种仪器
托盘天平:称量时,左物右码;加砝码时,先 大后小(精确度为__0_.1___g)
量筒:10 mL量筒的精确度为__0_.1___mL 漏斗(或分液漏斗)
镊子(取_块____状固体)、药匙(取__粉__末__状固体)、 胶头滴管(取少量_液__体___)
试管夹、铁架台、坩埚钳 长颈漏斗、石棉网、玻璃棒、试管刷等
(2)刷洗:须转动或上下移动___试__管__刷___,但用力不能过猛。 (3)洗涤干净的标志:内壁上附着的水既不___聚__成__水__滴___,
也不__成__股__流__下____。
5.实验室安全知识
意外事故
处理方法
浓 酸 : 用 大 量 的 水 冲 洗 → 涂 3% ~ 5%
浓酸、浓碱溅到皮肤或 的NaHCO3溶液
—
(续表) 仪器
漏斗
试管夹 玻璃棒
用途 用作加液器,将液体注入小 口径容器中;用于过滤
用于夹持试管 用于搅拌、过滤或转移液体
注意事项 不可加热 防止烧损和腐蚀
—
温馨提示 玻璃棒在初中实验中常见的作用
实验操作
作用
固体配制溶液
搅拌,加快溶解
浓溶液配制稀溶液
搅拌,使混合均匀
在氢氧化钠溶液中滴加稀盐酸
搅拌,加快反应
四川初中化学分值分布详细信息

四川初中化学分值分布详细信息一、实验操作和技能类1. 实验操作技能的掌握程度(20分):学生需要掌握实验前的准备工作,包括实验器材的选择和准备、实验物质的取用等。
同时,还需要熟悉实验步骤,并能够正确操作实验仪器,完成实验任务。
在实验过程中,还需要注意安全操作,遵守实验室规章制度。
2. 实验现象的观察和总结(20分):学生需要能够仔细观察实验现象,记录实验数据,并进行合理的总结和归纳。
同时,还需要能够运用科学知识解释实验现象,提出合理的假设和解释。
3. 实验数据的处理和分析(20分):学生需要能够准确地记录实验数据,并运用适当的数学和统计方法进行数据处理和分析。
同时,还需要能够运用化学知识解释数据结果,并得出科学结论。
4. 实验结果的表达和沟通(20分):学生需要能够准确地表达实验结果,并使用恰当的图表和文字进行沟通。
同时,还需要能够清晰地陈述实验过程和结论,并回答相关问题。
5. 实验安全和环保意识(20分):学生需要具备实验安全和环保意识,遵守实验室规章制度,正确使用实验仪器和化学药品,防止事故和污染的发生。
同时,还需要能够识别和处理实验中的安全隐患,采取相应的安全措施。
二、基础知识和理论类1. 基础知识的掌握程度(20分):学生需要掌握化学的基本概念、基本原理和基本常识,并能够准确运用化学知识解决问题。
同时,还需要掌握常见的化学实验方法和技术,能够正确选择和运用化学知识解决实际问题。
2. 知识的理解和运用能力(20分):学生需要能够理解和运用化学知识解决实际问题,包括化学现象的解释、化学方程式的平衡和反应速率的计算等。
同时,还需要能够将化学知识应用于实际生活和工作中,解决相关问题。
3. 知识的拓展和创新能力(20分):学生需要具备拓展和创新化学知识的能力,能够探究和研究新的化学现象和问题,并提出合理的解决方案。
同时,还需要能够运用科学方法进行实验设计和数据分析,提出新的观点和结论。
4. 知识的归纳和总结能力(20分):学生需要能够对所学的化学知识进行归纳和总结,形成系统的知识结构,并能够灵活运用所学的知识解决相关问题。
中考化学知识点、题型、分值
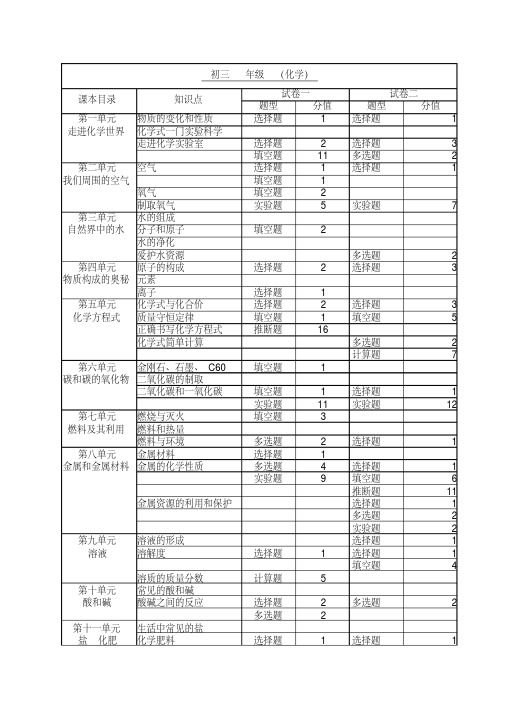
题型分值题型分值
第一单元物质的变化和性质选择题1选择题1走进化学世界
化学式一门实验科学走进化学实验室
选择题2选择题3填空题11多选题2第二单元空气选择题1选择题
1
我们周围的空气
填空题1氧气填空题2制取氧气
实验题5实验题7
第三单元水的组成自然界中的水分子和原子
填空题
2
水的净化爱护水资源
多选题2第四单元原子的构成选择题2选择题
3
物质构成的奥秘元素
离子
选择题1第五单元化学式与化合价选择题2选择题3化学方程式质量守恒定律
填空题1填空题5正确书写化学方程式推断题
16
化学式简单计算多选题2计算题
7
第六单元金刚石、石墨、C60填空题1碳和碳的氧化物二氧化碳的制取
二氧化碳和一氧化碳填空题1选择题1实验题11实验题
12
第七单元燃烧与灭火填空题3燃料及其利用
燃料和热量燃料与环境
多选题2选择题1第八单元金属材料
选择题1金属和金属材料金属的化学性质多选题4选择题1实验题
9
填空题6推断题11金属资源的利用和保护
选择题1多选题2实验题2第九单元溶液的形成选择题1溶液溶解度选择题1选择题1填空题
4
溶质的质量分数计算题5第十单元常见的酸和碱酸和碱酸碱之间的反应选择题2多选题2
多选题2第十一单元生活中常见的盐盐 化肥
化学肥料
选择题
1
选择题1
试卷一试卷二
课本目录知识点
初三 年级 (化学)
第十二单元人类重要的营养物质选择题1选择题1化学与生活化学元素与人体健康填空题2选择题1
填空题6有机合成材料多选题2填空题10
填空题5。
化学试卷分数分布

小题总分: 题号 1-9题 10、11题 12、13题 30分 题型 选择 选择 选择 总分 9 2 4 难易程度 易 中 难 主要考点 化学变化定义,食品中的有机物化学符号 实验操作,化学材料、水,化学与能源, 酸碱盐 化学计算的结构,酸碱盐 酸碱盐及其应用 化学元素符号的书写、金属于非金属资源 物质结构,溶解度、物质结构,化学材料
14-17题填空Fra bibliotek15易
大题总:35分 题号 18 19 20 21 22 23 24 题型 实验 实验 实验 实验 实验 推断 计算 单题分值 难易程度 5 3 4 4 7 6 6 中 中 难 难 中 难 中 主要考点 实验操作,无机元素推断 实验操作,酸碱盐性质 酸碱盐性质,燃烧与灭火 实验操作,燃烧与灭火,酸碱盐 实验操作,空气各组分的制取 实验操作,酸碱盐性质 化学计算,化学方程式
12、13题 20、21题 压轴题 23 24
选择 实验 推断 计算
酸碱盐之间的转化 化学方程式的书写 酸碱盐与实验操作结合 对未知物质的性质与构成进行推断 正确书写化学方程式,并准确计算
天津中考化学知识点

天津中考化学知识点篇一:天津中考化学知识点及考点中考化学知识点及考点在总复习中,建议打破课本中单元顺序,按天津市中考试卷内容可将各部分相应的知识按其内在联系进行归纳、整理为身边的化学物质、物质构成的奥秘、物质的化学变化及化学与社会发展四个板块。
复习中要注重基础的落实。
因为任何形式的考题总是以基础知识作为载体,复习时要以教材为根本。
复习中要突出本学科的特点。
复习时必须加强实验与科学探究能力的训练,全面掌握基本实验,注重综合实验设计能力的训练与培养:主要包括信息源的分析与筛选、实验原理的多向迁移、实验方案的选择(科学性、安全性、可行性、简约性)。
探究性试题大多数是考查学生对实验条件的控制,考查学生归纳、演绎等逻辑思维。
一、身边的化学物质它是初中化学的重要载体,也是初中化学内容的重要组成部分。
除了对物质组成、性质、制法、用途等知识的记忆外,还要了解研究组成、性质、制法、用途的方法。
这些内容包括:1.地球周围的空气:空气的组成;氧气、二氧化碳的主要性质、用途以及对人类生活的重要作用;氧气、二氧化碳的实验室制法;氧、碳在自然界中的循环。
2.水与常见的溶液:水的组成;某些天然水(包括硬水)和纯水的区别;常用的水处理方法;溶解现象和溶液;溶解度与溶解度曲线;溶质质量分数及溶液配制;结晶现象;乳化现象;溶解现象和溶液的重要应用。
3.金属与金属矿物:金属与合金的特性及其应用;常见金属与氧气的反应;防止金属锈蚀的简单方法;铁和铝等金属的矿物,还原铁矿石的方法;废弃金属对环境的污染和回收金属的重要性。
4.生活中常见的化合物:常见酸碱的主要性质和用途;酸碱溶液的稀释;酸碱指示剂和ph试纸测定溶液酸碱性;常见盐在日常生活中的应用;生活中常见的有机物及其对人类生活的重要性。
二、物质构成的奥秘1.了解构成物质的基本微粒,树立物质由微观粒子构成的观念,从微观角度理解物质及其变化,把宏观和微观的分析联系起来,建立元素的概念,从宏观角度描述和表示物质的组成,能进行有关组成的简单计算。
初中扬州中考化学三年试卷结构及分值考点对比

初中扬州中考化学三年试卷结构及分值考点对比摘要:一、引言- 介绍初中扬州中考化学试卷的基本情况- 简述本文的目的和结构二、三年试卷结构对比- 2018-2020 年扬州中考化学试卷结构对比- 分析三年试卷结构的相似性和差异性- 总结试卷结构的特点三、分值考点对比- 2018-2020 年扬州中考化学分值分布对比- 分析三年试卷中各知识点的分值占比- 总结分值考点的规律和趋势四、考点分析- 重点分析2018-2020 年扬州中考化学考点- 详述各知识点的考查方式和难度- 给出针对性的复习建议五、结论- 总结全文内容- 对2021 年扬州中考化学试卷的展望正文:一、引言初中扬州中考化学试卷是评估学生化学知识水平的重要工具,对于学生来说,了解试卷的结构和考点分布有助于提高复习效率,更好地应对考试。
本文将对2018-2020 年初中扬州中考化学试卷的结构和分值考点进行对比分析,旨在为学生们提供有针对性的复习建议。
二、三年试卷结构对比从2018-2020 年扬州中考化学试卷的结构来看,整体上保持了稳定。
试卷分为选择题和非选择题两部分,其中选择题包括单选题和多选题,非选择题包括填空题、简答题和实验题。
具体而言,2018 年和2019 年的试卷结构基本一致,而2020 年的试卷结构在选择题部分有所调整,将多选题改为了判断题。
三、分值考点对比通过对2018-2020 年扬州中考化学试卷的分值分布进行对比分析,发现各知识点的分值占比存在一定规律。
其中,基础知识部分(如化学计量、化学方程式等)占比较高,约在40% 左右;化学原理和实验技能部分次之,约在30% 左右;而化学综合应用部分占比较低,约在30% 左右。
从三年试卷的分值考点分布来看,基础知识始终是考查的重点,而化学原理和实验技能的考查逐渐受到重视。
四、考点分析针对2018-2020 年扬州中考化学考点,本文将重点分析以下几个方面:1.化学计量:主要涉及物质的量、摩尔质量、气体摩尔体积等概念,以及化学方程式的书写和计算。
天津中考化学考点及所占分值

天津中考化学考点及所占分值考点内容分值比例基础A基础B 提高C专题一、物质变化和性质:71. 物理变化和化学变化 22. 物理性质和化学性质 23. 质量守恒2-3 4. 化学反应与能量 1-2 5. 基本反应类型 2-3 6. 氧化还原1 专题二、物质组成结构和分类:9 1. 构成物质的粒子2 2. 组成物质的元素 2 3. 原子结构2 4. 原子与分子的区别1-2 5. 元素的性质、种类与结构的关系 1-2 6. 物质分类 3-4 专题三、化学用语:24 1. 元素符号书写及意义 2 2. 周期表结构及其简单应用 2 3. 原字(离子)结构示意图 1-2 4. 离子符号 1-2 5. 化合价 1-2 6. 化学式4-5 7. 化学方程式 8-94 专题四、溶液的性质:8 1. 溶液的定义、组成、特征 1 2. 溶解过程中溶液温度的变化 2 3. 饱和溶液与不饱和溶液 1-2 4. 溶解度及其曲线2-31 5. 溶液中溶质的质量分数 22专题五、空气和氧气:5 1. 空气成分、测定、验证及污染的防治 2 2. 氧气的性质和用途(反应现象) 1-2 3. 氧气的实验室制法 3-4 专题六、自然界的水:4 1. 电解水实验及水的化学式推导 2 2. 水的性质和用途 1 3. 水的净化和过滤 2 4. 硬水和软水15. 爱护水资源及水体污染及防治,节水标记1、管路敷设技术通过管线不仅可以解决吊顶层配置不规范高中资料试卷问题,而且可保障各类管路习题到位。
在管路敷设过程中,要加强看护关于管路高中资料试卷连接管口处理高中资料试卷弯扁度固定盒位置保护层防腐跨接地线弯曲半径标等,要求技术交底。
管线敷设技术中包含线槽、管架等多项方式,为解决高中语文电气课件中管壁薄、接口不严等问题,合理利用管线敷设技术。
线缆敷设原则:在分线盒处,当不同电压回路交叉时,应采用金属隔板进行隔开处理;同一线槽内强电回路须同时切断习题电源,线缆敷设完毕,要进行检查和检测处理。
中考化学考点分值分布表

★ ★ ★ ★ ★ ★ ★ ★ ★ ★ ★ ★ ★ ★ ★
好:4
中:4.5
差:5
中考所占分值:10-15分
题型:选择题、填空题、计算题、实验题
好:4 中:5 差:6
第十单元《酸和碱》
中考所占分值:15-20分
题型:选择题、填空题、计算题、实验题
★ ★ ★ ★
好:4
第十一单元《盐 化肥》
中:5
第十一单元《盐 化肥》
★ ★
第六单元《碳和碳的氧化物》
4 二氧化碳的用途及对生活环境的 影响 5一氧化碳(性质、用途)
★ ★ ★
中考所占分值:10-15分
题型:选择题、填空题、计算题、实验题
1燃烧和灭火 2燃料(化石燃料)和热量 第七单元《燃烧及其利用》 3使用燃料对环境的影响 4使用和开发新的燃料和能源
中考所占分值:5-10分
好:1 中:2 差:3
备注:(1)1次课按1小时计算 (2)“★”为本章重、难点
初三知识点,重难点,归纳 课本 目录 知识点 重难点
★ ★ 1什么是化学,化学研究任务 2化学的发展史 《绪言 化学使世界变得更加绚丽多彩》 3绿色化学 4化学对人类生存发展的影响
中考所占分值:2-4分 题型:选择题为主
课时数 好:1 中:1.5 差:1.5
1 物质的变化(物理变化与化学变 化) 2 物质的性质(物理性质与化学性 质) 第一单元 《走进化学世界》 3物质的变化和性质的关系 4物质的性质与用途的关系 5化学实验探究学习的特点和方法 6实验基本操作
好:4
★ ★ ★ ★ ★ ★
中:4.5 差:4.5
题型:选择题、填空题、计算题、实验题
第九单元《溶液》
九 年 级 下 册
