浙江选考版高考化学二轮复习专题训练物质的检验与鉴别分离与提纯
(浙江选考)高考化学二轮复习 专题七 第6讲 有机化学实验教案-人教版高三全册化学教案
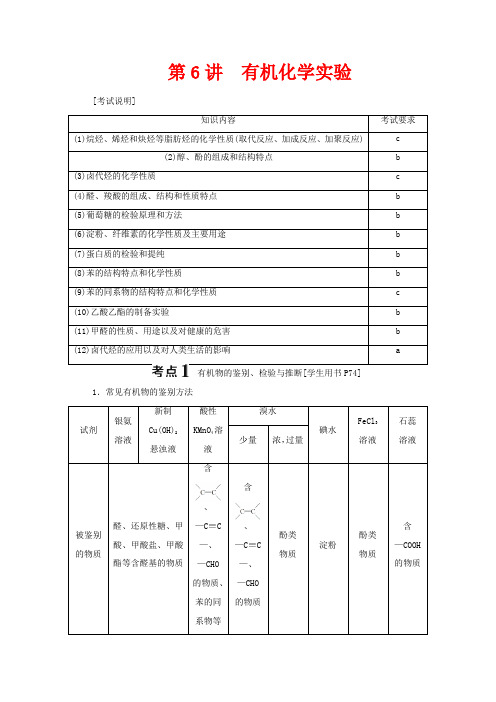
第6讲有机化学实验[考试说明]知识内容考试要求(1)烷烃、烯烃和炔烃等脂肪烃的化学性质(取代反应、加成反应、加聚反应) c(2)醇、酚的组成和结构特点 b(3)卤代烃的化学性质 c(4)醛、羧酸的组成、结构和性质特点 b(5)葡萄糖的检验原理和方法 b(6)淀粉、纤维素的化学性质及主要用途 b(7)蛋白质的检验和提纯 b(8)苯的结构特点和化学性质 b(9)苯的同系物的结构特点和化学性质 c(10)乙酸乙酯的制备实验 b(11)甲醛的性质、用途以及对健康的危害 b(12)卤代烃的应用以及对人类生活的影响 a有机物的鉴别、检验与推断[学生用书P74] 1.常见有机物的鉴别方法试剂银氨溶液新制Cu(OH)2悬浊液酸性KMnO4溶液溴水碘水FeCl3溶液石蕊溶液少量浓,过量被鉴别的物质醛、还原性糖、甲酸、甲酸盐、甲酸酯等含醛基的物质含、—C≡C—、—CHO的物质、苯的同系物等含、—C≡C—、—CHO的物质酚类物质淀粉酚类物质含—COOH的物质(1)卤代烃中卤族元素的检验 ①原理⎭⎪⎬⎪⎫R —X +NaOH ――→H 2O △R —OH +NaX NaX +AgNO 3===AgX ↓+NaNO 3 ⇒根据沉淀AgX 颜色判断X 是Cl 、Br 还是I⎭⎪⎬⎪⎫R —CH 2—CH 2—X +NaOH ――→醇△R —CH===CH 2+NaX +H 2O NaX +AgNO 3===AgX ↓+NaNO 3 ⇒同上原理判断X 的类型(此方法只适用于能发生消去反应的卤代烃)②步骤:取少量卤代烃―→加NaOH(醇)溶液―→加热―→冷却―→加足量稀HNO 3―→加AgNO 3。
(2)淀粉水解程度的推断①原理:(C 6H 10O 5)n +n H 2O ――→H 2SO 4微热n C 6H 12O 6; 淀粉遇碘水变蓝;CH 2OH(CHOH)4CHO +2Ag(NH 3)2OH ――→水浴加热 CH 2OH(CHOH)4COONH 4+H 2O +2Ag↓+3NH 3。
2019高考化学二轮练习导航资料(浙江新课件):物质的鉴别、分离、提纯.ppt

4. 化学是以实验为基础的自然科学,下列实验操 作方法正确的是( )
①制氧气时排水法收集氧气后出现倒吸现象,应 立即停止加热
②给试管中的液体加热时,可加入碎瓷片或不时 移动试管,以免暴沸伤人
(3)如何判断
SO
24
已除尽?
_静__置__,__在__上__层__澄__清__溶__液__中__再__加__入__少__量__B__a_(N__O_3_)_2溶____
_液__,__若__不__变__浑__浊__,__表__明_______离__子__已__除__尽__。
(4)实验过程中产生的多次沉淀___不__需__要_(选填“ 需要”、“不需要”)多次过滤,其理由是 _因__为__几__个__沉__淀__反__应___互__不__干__扰__,__因__此__最__后__只__过__滤__一__次__ _,__可__减__少__操__作__程__序________。
)
A.溶液中一定存在Br-、 B.溶液中可能存在NH C.溶液中一定不存在Fe2+、I-、SO32D.溶液一定呈碱性
【解析】本题考查了常见离子的鉴别和性质。
饱和氯水的存在着多种粒子,具有多重性质,加入
足量氯水后有气泡生成再加入BaCl2无沉淀生成说明
一定有 ,一定没有SO32- (若有 SO32- ,加入过量氯
2.(2011·菏泽一模) 现有①NaOH;②Al2(SO4)3 ;③Ba(NO3)2;④CuSO4;⑤FeCl3;⑥淀粉溶液; ⑦KI 这7种溶液( ) A
A.不需外加试剂即可鉴别 B.必须外加试剂才能鉴别 C.如有碘水即能全部鉴别 D.另有一种溶液即可鉴别
【解析】首先通过观察可鉴别出有色物质:CuSO4( 蓝色),FeCl3(黄色),通过鉴别出的物质加入少量未 鉴别的溶液中,如先加CuSO4,则可鉴别出NaOH溶 液,Ba(NO3)2溶液,再取未鉴别的溶液少许加FeCl3 则可鉴别出KI。向此中加未鉴别出的②和⑥,变蓝
第25讲 物质的分离与提纯 检验与鉴别-11-2024版高考完全解读 化学 (新高考)

第八章化学实验第25讲物质的分离与提纯检验与鉴别1.(2022·浙江1月选考·25)下列实验方案设计、现象和结论中有不正确的是( )。
选项目的方案设计现象和结论A 检验硫酸厂周边空气中是否含有二氧化硫用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化溶液不变色,说明空气中不含二氧化硫B 鉴定某涂改液中是否存在含氯化合物取涂改液与KOH溶液混合加热充分反应,取上层清液,硝酸酸化,加入硝酸银溶液,观察现象出现白色沉淀,说明涂改液中存在含氯化合物C 检验牙膏中是否含有甘油将适量牙膏样品与蒸馏水混合,搅拌,静置一段时间,取上层清液,加入新制的Cu(OH)2,振荡,观察现象溶液出现绛蓝色,说明牙膏中含有甘油D 鉴别食盐与亚硝酸钠各取少量固体加水溶解,分别滴加含淀粉的KI溶液,振荡,观察溶液颜色变化溶液变蓝色的为亚硝酸钠;溶液不变蓝的为食盐答案:D解析:利用二氧化硫能使酸性KMnO4溶液褪色的原理,可检验空气中是否含有二氧化硫,A正确;鉴定某涂改液中是否存在含氯化合物,先加碱液水解,酸化后加硝酸银看是否出现白色沉淀,B正确;甘油可以与新制的Cu(OH)2反应生成绛蓝色物质,利用此性质可检验牙膏中是否含有甘油,C正确;亚硝酸钠在酸性条件下与KI发生氧化还原反应,题中未说明酸性条件,D错误。
2.(2020·山东卷·8)实验室分离Fe3+和Al3+的流程如图所示:已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。
下列说法错误的是( )。
A.萃取振荡时,分液漏斗下口应倾斜向下B.分液时,应先将下层液体由分液漏斗下口放出C.分液后水相为无色,说明已达到分离目的D.蒸馏时选用直形冷凝管答案:A解析:萃取振荡时,分液漏斗下口应倾斜向上,A错误;分液时下层液体先从下口流出,上层液体从上口倒出,B正确;分液时水相为无色,则水相中不存在配离子[FeCl4]-,说明已达到分离的目的,C正确;蒸馏时选用直形冷凝管,可以使馏分顺利流出,D正确。
2025年浙江省普通高中学业水平考试 学考复习——专题23 物质的分离、提纯与检验

饱和NaHCO3溶液
HCl+NaHCO3 = NaCl+H2O+CO2↑
CO2(SO2)
饱和NaHCO3溶液
SO2+2NaHCO3 = Na2SO3+H2O+2CO2
CO2(CO)
灼热CuO
CO(CO2)
NaOH浓溶液
CH4(CH2= CH2)
溴水
解度小
CO+CuO
Cu+CO2
CO2+2NaOH = Na2CO3+H2O
化学 · 学考
第23讲
物质的分离、提纯与检验
知识点一
物质的分离与提纯
1. 物质分离、提纯的区别
(1)物质的分离:将混合物中的各组分彼此分开得到相应纯净物
的过程。
(2)物质的提纯:将混合物中的杂质除去的过程,也叫除杂。
2. 物质分离、提纯的常用方法
方法
过滤
结晶、
重结晶
适用范围
装置示意图
固体与液体
举例
升 成分在一定温度下可
混合物,利用碘易升华
华 直接变为气体,再冷却
的特性,可将碘与氯化
成固体
蒸
分离溶于溶剂中的
发 溶质
钠分离
从食盐水溶液中提
取食盐晶体
2. 常见气体的提纯(除杂)
(内为杂质)
除杂试剂
化学方程式或原理
HCl极易溶于水,Cl2在饱和NaCl溶液中的溶
Cl2(HCl)
饱和NaCl2
可使带火星的木条复燃
Cl2
黄绿色,能使湿润的碘化钾淀粉试纸变蓝
SO2
NH3
CO2
无色有刺激性气味的气体。能使品红溶液褪色,加热后又显红色;能
(浙江专用)高考化学大二轮复习专题六化学实验20物质的分离、提纯与制备课件

第20讲物质的分离、提纯与制备重点梳理考点一物质分离、提纯1•物质的分离与提纯的基本原理⑴“四原则”①不增,不得引入新杂质;②不减,尽量不减少被提纯的物质;③易分,使被提纯或分离的物质跟其他物质易分离;④易复原,被提纯的物质要易被复原。
(2)“三必须”①除杂试剂必须过量;②过量试剂必须除尽(除去过量试剂带入的新杂重点梳理质,同时注意加入试剂的顺序);③必须选择最佳的除杂途径。
重点梳理2 •物质分离与提纯的常见类型(1)“固+固吟昆合物的分离(提纯)加热升华法:女BNaCl和L均易溶加水难溶+易溶结晶法:如KNO3和NaCl 过滤法;女口NaCl和Mg(OH)其他特殊法:如FeS和Fe可用磁铁吸引重点梳理(2)“固+液”混合物的分离(提纯)—萃取法:如从碘水中提取碘旦色一蒸发结晶:如从硫酸铜溶液中获取胆矶晶体固+液——I—蒸馆:如从海水中获取蒸憾水不互溶过滤(3)“液+液吟昆合物的分离(提纯)I互浴蒸懈法:如从石油中获取汽油、煤油液+液一、七|不互溶分液法:如油和水、乙酸乙酯和Na2CO3溶液重点梳理(4)“气+气吟昆合物的分离(提纯)——洗气法:女口CO?中的HC1 (饱和NaHCO3溶液)气+气———灼烧法:如N2中的(灼热的铜网)重点梳理精选例题3•从海带中提取碘(1)工业浸泡干海带与实验室灼烧后的海带灰浸泡,都能使I-因溶解而进入水溶液中。
(2)将溶液中I-氧化生成I?的过程中,可以用新制氯水,也可以用H2O2,两者使用过程会有差异,新制氯水过量后会将I?继续氧化,从而得到【2的量会减少。
(3)氧化后得到的粗碘水采用过滤的方法得到粗碘,而不是先萃取后分液,对于过滤后的滤液可以采用萃取、分液等操作,以得到更多的碘单质。
(4)若少量【2溶解在CC14溶液中,较难回收,一般可以用碱液反萃取, 使有机层中少量【2重新与碱反应进入水层,然后再提取回收。
重点梳理4•纸层析法分离铁离子与铜离子纸层析是利用滤纸为惰性支持物,水作为固定相,有机溶剂作为流动相,利用混合物在固定相和流动相中的分配比不同而进行的分离。
二轮高考化学题:物质的检验、分离和提纯

2021届二轮高考化学题:物质的检验、分离和提纯含答案专题:物质的检验、分离和提纯一、选择题1、肼(N2H4)又名联氨,常温下为无色油状液体,沸点为113.5 ℃,有弱碱性和较强的还原性。
实验室用N2H4还原Cu(OH)2制备纳米Cu2O的装置如图所示(部分夹持、加热装置已略)。
已知:NaNO2与NH4Cl反应能生成N2。
下列说法错误的是()A.装置②、⑥中分别盛装浓硫酸和稀硫酸B.无水硫酸铜由白色变为蓝色,说明从装置④中出来的气体中含有水蒸气C.装置④中发生反应的化学方程式为N2H4(g)+4Cu(OH)22Cu2O+N2+6H2OD.加入反应试剂后,先打开活塞K2,待装置④中反应完全且冷却至室温后,再打开活塞K1排净装置中的N2H42、《炼丹秘诀》中的“抽汞法”有如下叙述:“朱砂不计多少。
入砂锅中以炭屑填平锅口,剪蛎壳板如锅大密钻小窍盖之,却将空砂锅一个与前锅二口相合,铁丝固济(包括有用铁丝缠和用盐泥固济二法),地下掘一穴安埋空锅,锻炼之后候冷取出,大概银朱一两只有真汞三钱。
”文中涉及的操作方法是()A.蒸馏B.升华C.干馏D.萃取3、下列除杂方法错误..的是()。
选项括号内为杂质实验操作或方法A NO2(NO) 通入O2B CuSO4溶液[Fe2(SO4)3] 加入足量CuO,过滤C 溴苯(溴) 加入NaOH溶液,分液D MnO2(I2) 加热4、石油分馏的原理是利用物质的()A.沸点差异B.密度差异C.溶解度差异D.化学性质差异5、《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是()。
A.蒸馏B.升华C.干馏D.萃取6、下列根据实验操作和现象所得出的结论正确的是()。
选项操作现象结论A 向某溶液中加入铜片和浓硫酸并加热有红棕色刺激性气味的气体产生原溶液中一定有NB 向某溶液中滴入氯水,再滴加KSCN溶液溶液显红色原溶液中一定有Fe2+C 向某无色溶液中加入硝酸钡溶液产生白色沉淀,沉淀不溶于稀硝酸原溶液中一定有SD 向品红溶液中通入气体溶液褪色该气体一定是SO27、固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种。
2023届高三化学高考备考二轮复习训练--物质的分离、提纯和检验

2023年高考化学专题训练--物质的分离、提纯和检验一、单选题1.丙酮(C3H6O)通常是无色液体,与水混溶,密度小于1g•mL﹣1,沸点约为56℃.要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是()A.蒸馏B.分液C.过滤D.蒸发2.现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。
分离以上各混合液的正确方法依次是()A.分液、萃取、蒸馏B.萃取、蒸馏、分液C.分液、蒸馏、萃取D.蒸馏、萃取、分液3.下列说法中错误的是()A.油脂水解可得到丙三醇B.蛋白质、淀粉、纤维素都是高分子化合物C.蛋白质水解的最终产物均为氨基酸D.纤维素水解与淀粉水解得到的最终产物不同4.下列实验操作中错误的是()A.蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出D.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来5.下列由相关实验现象所推出的结论正确的是()A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42﹣C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水6.只用胶头滴管和试管,不能区别的溶液是()A.CaCl2和Na2CO3B.稀盐酸和Na[Al(OH)4]C.稀盐酸和Na2CO3D.NaOH和AlCl37.化学与生产、生活、社会密切相关。
下列说法错误的是()A.制作面包类食品时,常用小苏打作膨松剂B.高炉炼铁、生产水泥和制造玻璃都要用到石灰石C.鉴别织物成分是蚕丝还是“人造丝”,可采用灼烧闻气味的方法D.乙醇、过氧乙酸、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的8.以用下列实验装置进行相应实验,能达到实验目的的是()A.用图a所示装置除去Cl2中含有的少量HClB.用图b所示装置蒸干NH4Cl 饱和溶液制备NH4Cl晶体C.用图c所示装置制取少量纯净的CO2气体D.用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层9.下列实验装置,不能达到相应实验目的的是()10.海水中不仅含有丰富的水资源,而且蕴藏着宝贵的化学资源。
第二单元物质的检验、分离与提纯 高考化学(浙江选考)复习专题课件

CaCO3+2H+
Ca2++CO2↑+H2O
(3)甘油的检验:加入新制的C+2H2O
2.火柴头中某些成分的检验 (1)火柴头的成分:一般为KClO3、MnO2等氧化剂和易燃物如硫等。 (2)火柴头中硫元素的检验 a.方法:燃烧后检验是否有SO2生成。检验SO2可用② 品红 溶液,也可 用酸性高锰酸钾溶液。 b.常用检验SO2的实验装置
c.易挥发,以便与所萃取的物质相分离,常用的萃取剂有乙醚、氯仿、苯等。 碘单质在水中溶解度④ 较小 ,而在有机溶剂中溶解度⑤ 较大 , 结合萃取剂选择的要求,可以选择苯、汽油、四氯化碳作为萃取剂,从 滤液中提取碘单质。 2.用纸层析法分离铁离子和铜离子 (1)装置制作 取一支大试管,配一个合适的橡胶塞。在橡胶塞的下部用小刀切开一条 缝,插入回形针以夹持滤纸条。在距滤纸条末端约2 cm处用铅笔画一个 小圆点作为原点。
和② 物理状态 ;物质的提纯是净化混合物中的主体物质,不必考 虑提纯后杂质的③ 化学成分 和④ 物理状态 。
2.常用方法 (1)物理方法 a.过滤:用于固液分离。所用仪器和用品:⑤ 烧杯、漏斗、玻璃棒、铁 架台(带铁圈)、滤纸 。操作注意:一贴(滤纸紧贴漏斗内壁,中间无气 泡),二低(滤纸边缘略低于漏斗边缘;漏斗里液面略低于滤纸边缘),三靠 (倾倒液体的烧杯口紧靠玻璃棒;玻璃棒末端轻靠在三层滤纸处;漏斗下 端管口尖端紧靠烧杯内壁)。
二、海带中碘元素的分离及检验与用纸层析法分离铁离子和铜离子 1.海带中碘元素的分离及检验 (1)碘元素的检验 将海带置于坩埚中灼烧,在残留的灰分中加入水,此时残留灰分中的I-进 入溶液,过滤,在滤液中加入稀硫酸,再加入双氧水或氯水,将I-氧化成碘 单质,利用① 淀粉 溶液来检验碘单质。在实验中若使用氯水作氧化 剂,应注意氯水的用量不宜过多,否则会发生反应:5Cl2+I2+6H2O ②
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的检验与鉴别、分离与提纯一、选择题1.(2015·济南模拟)下列有关仪器用途的说法中正确的是()A.试管、烧杯均可用于给液体、固体加热B.使食盐水中NaCl结晶析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角C.区别NaCl、Na2SO4时常用到胶头滴管、试管D.漏斗可用于过滤及向滴定管中添加溶液解析烧杯只能用于给液体加热,A错;使食盐水中NaCl晶体析出的方法通常是蒸发浓缩、冷却结晶,使用的容器应是蒸发皿而不是坩埚,B错;由于物质鉴别所用试剂量较少,故应使用试管作反应容器,通过胶头滴管滴加试剂,C对;向滴定管中添加溶液的方法是直接将试剂瓶中的液体倾倒入滴定管中,D错。
答案 C2.(2015·朝阳区模拟)用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到的是()实验步骤实验用品A 步骤1:将海带灼烧灰化B 步骤2:将海带灰溶解、过滤C 步骤3:氧化滤液中的I-D 步骤4:检验碘元素解析灼烧海带时使用三角架、泥三角、坩埚、坩埚钳、酒精灯;海带灰溶解、过滤时使用烧杯、普通漏斗、玻璃棒、铁架台;氧化碘离子时不需要使用容量瓶。
答案 C3.(2014·重庆高考)茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是()A.将茶叶灼烧灰化,选用①、②和⑨B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦C.过滤得到滤液,选用④、⑤和⑦D.检验滤液中的Fe3+,选用③、⑧和⑩解析A项,灼烧在坩埚内进行,另外还用到酒精灯和泥三角,正确;B项,溶解、稀释用到烧杯和玻璃棒,错误;C项,过滤使用漏斗、烧杯、玻璃棒,正确;D项,检验Fe3+应选用KSCN溶液,用胶头滴管取用试剂,在试管内进行反应,检验,正确。
答案 B4.(2014·海南高考)下列除杂操作可行的是()A.通过浓硫酸除去HCl中的H2OB.通过灼热的CuO除去H2中的COC.通过灼热的镁粉除去N2中的O2D.通过水除去CO中的CO2解析H2和CO均可以与灼热的CuO反应,B项错误;N2和O2均可以与灼热的镁粉反应,C 项错误;用水除去CO2的过程会引入新杂质水蒸气,且水不易吸收CO2,D项错误。
答案 A5.(2016·浙江萧山中学调研)下列化学实验事实及解释都正确的是()A.向Na2SO3溶液中加入硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质B.某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊,说明该溶液中一定有CO2-3C.某溶液中加入BaCl2溶液,产生白色沉淀,加稀硝酸后,白色沉淀不溶解,也无其他现象,说明该溶液中一定含有SO2-4D.取少量久置的Na2SO3样品溶于水,加足量盐酸有气体产生,然后加BaCl2溶液,产生白色沉淀,说明Na2SO3样品已部分变质解析A项不变质也会产生白色沉淀;B项有可能是SO2-3、HCO-3;C项有可能是SO2-3,先产生BaSO3沉淀然后再被氧化为BaSO4;D项产生SO2气体后再加入BaCl2溶液仍有沉淀,证明产生了BaSO4,说明样品部分变质。
答案 D6.(2016·山东济南联考)下列实验中,所选装置不合理的是()A.分离Na2CO3溶液和CH3COOC2H5,选④B.用CCl4提取碘水中的碘,选③C.用FeCl2溶液吸收Cl2选⑤D.粗盐提纯,选①和②解析解答本题主要从物质的性质、实验原理、仪器的选择是否正确等角度去分析。
CH3COOC2H5与Na2CO3溶液互不相溶,故应选择分液法将其分离,因此应选③,A错;用CCl4提取碘水中的碘,应选择分液漏斗进行萃取分液,B正确;将Cl2通过盛有FeCl2溶液的洗气瓶,可将Cl2吸收,C正确;粗盐提纯应先将粗盐溶于蒸馏水中,然后过滤除掉泥沙等不溶物,再蒸发、浓缩最后得到NaCl晶体,D正确。
答案 A7.下列实验可实现鉴别目的的是()A.用KOH溶液鉴别SO3(g)和SO2B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2C.用CO2鉴别NaAlO2溶液和CH3COONa溶液D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液解析A项,SO3(g)和SO2均能与KOH反应且没有明显的现象;B项,Br2(g)和NO2均具有氧化性,均能使湿润碘化钾淀粉试纸变蓝;C项,CO2与NaAlO2溶液反应生成白色沉淀Al (OH)3,CO2与CH3COONa不反应;D项,AgNO3溶液和K2SO4溶液与BaCl2溶液反应均生成白色沉淀,错误。
答案 C8.(2015·湖南省十三校联考)下列关于物质的检验方法正确的是()A.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有 SO2-4B.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水C.向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含有CO2-3或HCO-3D.将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有 NH+4解析A中可能含有Ag+,错误;B中其他氧化性的离子也可以,如Fe3+,错误;C中也可能含有SO2-3或HSO-3,错误。
答案 D9.(2014·全国大纲,10)下列除杂方案错误的是()选项被提纯的物质杂质除杂试剂除杂方法A CO(g)CO2(g)NaOH溶液、浓H2SO4洗气B NH4Cl(aq)Fe3+(aq)NaOH溶液过滤C Cl2(g)HCl(g)饱和食盐水、浓H2SO4洗气D Na2CO3(s)NaHCO3(s)—灼烧解析A项,NaOH溶液吸收CO2,浓H2SO4除去水蒸气,且两种试剂都不与CO反应,正确;B 项,NaOH溶液不仅能与Fe3+反应,还能与NH+4反应,且还能引入杂质,错误;C项,饱和食盐水可以除去HCl,浓H2SO4可以除去水蒸气,正确;D项,灼烧能使NaHCO3固体分解生成Na2CO3,正确。
答案 B10.(2015·江苏化学,7)下列实验操作正确的是()A.用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pHB.中和滴定时,滴定管用所盛装的反应液润洗2~3次C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相D.用装置乙加热分解NaHCO3固体解析A项,用pH试纸测溶液的pH时,pH试纸不能湿润,错误;C项,用分液漏斗分液时,下层液体从下口放出,待下层液体放出后,上层液体从上口倒出,错误;D项,加热固体时,试管口要略向下倾斜,错误。
答案 B11.(2016·浙江东阳质检)下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是()A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)解析本题是用一种试剂鉴别多种物质的实验题,着重考查学生对常见物质的化学性质、物理性质的掌握情况,以及鉴别实验方案的设计能力的考查。
A中可先利用FeCl3鉴别出Ba(OH)2[产生红褐色Fe(OH)3沉淀]和KSCN(溶液变为红色),然后再利用Ba(OH)2鉴别出Mg(NO3)2(产生白色沉淀),最后一种为NaCl,故能鉴别;B 中可将H2SO4分别加入四种溶液中,产生无色无味气体的为NaHCO3,产生白色沉淀的为Na2SiO3,产生刺激性气味气体的为(NH4)2SO3,余下的为NaNO3,故能鉴别;C中用AgNO3溶液无法鉴别CaCl2溶液和K2CO3溶液;D中可将KOH溶液分别逐滴加入四种溶液中,产生蓝色沉淀的为CuSO4,先产生白色沉淀后又溶解的为AlCl3,加热有刺激性气味气体产生的为(NH4)3PO4,没有明显现象的是NaBr溶液,故选C。
答案 C12.下列分离物质的方法中,根据微粒大小进行分离的是()A.萃取B.重结晶C.聚沉D.渗析解析A.萃取是利用溶质在不同溶剂中溶解度的不同将其分离的方法,与微粒大小无关,故A不选;B.重结晶是利用物质的溶解度随温度的变化较大将其分离的方法,与微粒大小无关,故B不选;C.聚沉为胶体的性质,不能分离混合物,聚沉时分散质的直径变大,故C不选;D.渗析操作中微粒小的可透过半透膜,而胶体中微粒直径比离子、分子大,不能透过半透膜,分离方法与微粒大小有关,故D 选。
答案 D二、填空题13.(2016·浙江嘉兴8月)下列是制备CuO 的流程图:工业CuSO 4――→Ⅰ ――→ⅡCuSO 4溶液――→ⅢCuSO 4·5H 2O ―→……―→CuO(1)步骤Ⅰ的目的是除去不溶性杂质。
操作是___________________________________________________。
(2)步骤Ⅱ的目的是除铁。
操作是:滴加H 2O 2溶液,稍加热;当Fe 2+转化完全后,慢慢加入Cu 2(OH )2CO 3粉末,搅拌,以控制溶液pH =3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH =1。
控制溶液pH =3.5的原因是_________________________________________________________。
(3)步骤Ⅲ的目的是得到CuSO 4·5H 2O 晶体。
操作是_________________________(填操作名称),过滤,水浴加热烘干。
水浴加热的特点是___________________________________________________________________。
解析 (1)不溶性杂质由于不溶于水,采用过滤的方法除去。
(2)步骤Ⅱ操作:向含有CuSO 4、FeSO 4的溶液中滴加H 2O 2,发生反应:2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O ,此时溶液的pH<3.5,而pH =3.5时,Fe (OH )3沉淀易形成,故此时要加入Cu 2(OH )2CO 3粉末,以中和H +,控制pH =3.5,同时加热煮沸,使Fe 3+水解趋于完全,生成Fe (OH )3沉淀,同时抑制Cu 2+的水解。
过滤除去Fe (OH )3沉淀,再加稀硫酸酸化得到CuSO 4溶液。
(3)通过蒸发溶剂、冷却结晶的方法析出硫酸铜晶体,加热烘干时温度不能超过100 ℃,且需温度恒定,以防温度过高使硫酸铜分解,因此采用水浴加热。
答案 (1)溶解、过滤(2)使Fe 3+可全部转化为Fe (OH )3沉淀,而Cu 2+不会转化为Cu (OH )2沉淀(3)蒸发浓缩、冷却结晶 受热均匀,温度易于控制在100 ℃以下14.(2015·海淀区模拟)根据下列各组溶解度曲线图,判断分离提纯方法。
