氮氧化物的产生及转化解析
大气中氮氧化物的形成与化学反应机制

大气中氮氧化物的形成与化学反应机制大气中的氮氧化物(NOx)是指氮氧化物(氮气(N2)氧化产生的化合物)的总称,主要包括一氧化氮(NO)和二氧化氮(NO2)。
它们是大气中的重要污染物,对人类健康和环境造成不良影响。
因此,了解大气中氮氧化物的形成与化学反应机制对于减少这些污染物的排放至关重要。
1. 氮氧化物的来源氮氧化物主要来自燃烧过程,包括工业生产、交通运输和能源消耗等活动产生的废气排放。
具体而言,机动车辆排放是城市大气中氮氧化物的重要来源,尤其是柴油车的排放更为显著。
此外,燃煤、燃油以及其他高温燃烧过程也会释放大量氮氧化物。
森林、农田和废物处理等体系也可释放一定量的氮氧化物。
2. 形成机制氮氧化物的形成涉及多个化学反应。
首先,在高温(1000°C以上)下,氧气和氮气发生反应,生成一氧化氮:N2 + O2 → 2NO。
这个反应在燃烧过程中是主要的氮氧化物形成途径。
其次,一氧化氮会与大气中的氧气进一步反应,生成二氧化氮:2NO + O2 → 2NO2。
在大气中,氮氧化物的平衡浓度主要由一氧化氮和二氧化氮之间的反应控制。
3. 其他影响因素氮氧化物的形成还受到其他环境因素的影响。
温度是一个重要的因素,高温有利于氮氧化物的形成;而低温有助于一氧化氮与氮氧化物的转化为无毒的氮气。
此外,湿度也会影响氮氧化物的浓度。
高湿度条件下,氮氧化物会与大气中的水反应,生成硝酸等氮酸,从而减少氮氧化物的浓度。
4. 化学反应机制大气中氮氧化物的化学反应机制较为复杂。
一氧化氮和二氧化氮可以通过光解反应或与其他气体反应而进一步转化为其他化合物。
例如,一氧化氮可以通过与大气中的臭氧反应生成一氧化氮过氧化物:NO + O3 → NO2 + O2。
一氧化氮过氧化物是重要的臭氧生成物,它与VOC(挥发性有机化合物)在有光照的条件下进行反应,形成下午的臭氧。
此外,大气中的氮氧化物还可以与其他大气污染物发生复杂的化学反应。
例如,氮氧化物可以与二氧化硫(SO2)反应,生成硝酸和亚硫酸:NO2 + SO2 → HNO3 + HSO4。
氮氧化物的产生与转化
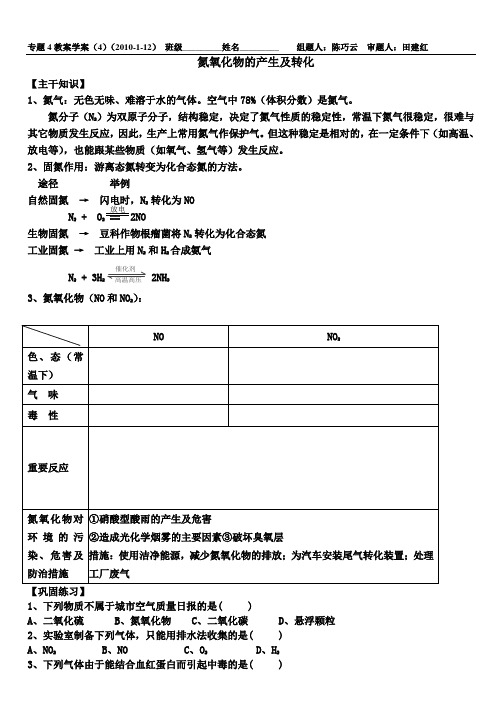
专题4教案学案(4)(2010-1-12) 班级_________姓名_________ 组题人:陈巧云 审题人:田建红氮氧化物的产生及转化【主干知识】1、氮气:无色无味、难溶于水的气体。
空气中78%(体积分数)是氮气。
氮分子(N 2)为双原子分子,结构稳定,决定了氮气性质的稳定性,常温下氮气很稳定,很难与其它物质发生反应,因此,生产上常用氮气作保护气。
但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
2、固氮作用:游离态氮转变为化合态氮的方法。
途径 举例自然固氮 → 闪电时,N 2 转化为NON 2 + O2 == 2NO生物固氮 → 豆科作物根瘤菌将N 2 转化为化合态氮工业固氮 → 工业上用N 2 和H 2合成氨气N 2 + 3H 2 催化剂 高温高压 2NH 3 3、氮氧化物(NO 和NO 2):【巩固练习】1、下列物质不属于城市空气质量日报的是( )A 、二氧化硫B 、氮氧化物C 、二氧化碳D 、悬浮颗粒2、实验室制备下列气体,只能用排水法收集的是( )A 、NO 2B 、NOC 、O 2D 、H 23、下列气体由于能结合血红蛋白而引起中毒的是( )放电成功不是将来才有的,而是从决定去做的那一刻起,持续累积而成。
A 、Cl 2B 、NOC 、O 2D 、CO4、鉴别NO 2和溴蒸汽的方法正确的是( )A 、用氢氧化钠溶液B 、用湿润的淀粉碘化钾试纸C 、用硝酸银溶液D 、用蒸馏水5、美国医学教授因发现X 物质在人体血管系统内具有传送信号的功能而荣获1998年诺贝尔生理学和医学奖。
因此 X 物质被誉为“生物信使分子”。
已知 X 是一种奇电子数分子,也是一种污染大气的无色气体且能使血红蛋白失去携氧能力。
则 X 是:( )A.COB.HFC.CO 2D.NO6、起固氮作用的化学反应的是 ( )A.工业上用氮气和氢气合成氨气B.一氧化氮与氧气反应生成二氧化氮C.氨气经催化氧化生成一氧化氮D.由氨气制碳酸氢氨和硫酸氨7、在NO 2与水的反应中,水( )A .是还原剂B .是氧化剂C .既是氧化剂又是还原剂D .既不是氧化剂又不是还原剂8、一定体积下,将等体积的NO 和O 2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积约为原气体总体积的( )A 、41B 、43C 、81D 、839、在体积为VL 的密闭容器中通入a mol NO 和b mol O 2,反应后容器内氮原子数和氧原子数之比为( )A 、b aB 、b a 2C 、b a a 2+ D 、)2(2b a a +10、在标准状况下,将NO 2和O 2按体积比为4﹕1充满一个干燥的烧瓶,将烧瓶倒置于水中,瓶内液面上升,最后烧瓶内溶液的物质的量浓度为 ( )A 、0.045mol/LB 、0.036mol/LC 、0.026mol/LD 、0.030mol/L11、电闪雷鸣是人们司空见惯的自然现象,地球上每年平均发生315160余次闪电每当雷电交加之际,空气中可能发生如下反应:① ②③12、NO 分子因污染空气而臭名昭著。
氮氧化合物的产生及转化课件

一氧化氮是一种无色无味的有毒气体,是氮氧化物中最简单的一种。它在常温下以气体形式存在,但在低温下可 以液化。一氧化氮具有自由基的性质,在空气中容易被氧化成二氧化氮。
二氧化氮
总结词
红棕色有毒气体
详细描述
二氧化氮是一种红棕色的有毒气体,有刺激性气味。它是由一氧化氮在空气中被氧化形成的。二氧化 氮对水有较大的亲和力,会形成硝酸和亚硝酸,具有强腐蚀性和毒性。
土壤污染
氮氧化物会通过大气沉降、 雨水冲刷等方式进入土壤, 造成土壤污染。
土壤生态失衡
氮氧化物的存在会影响土 壤微生物的活性,导致土 壤生态失衡,影响植物的 生长和发育。
PART 04
氮氧化合物的转化与处理
自然转化
01
自然转化是指氮氧化物在自然环境中通过化学反应转化为 其他物质的过程。
02
自然转化过程通常需要较长时间,且转化效率较低,但在某些特 定条件下,如土壤、水体等,自然转化可以起到一定的净化作用。
2023 WORK SUMMARY
氮氧化合物的产生及 转化课件
REPORTING
• 氮氧化合物的产生
CATALOGUE
PART 01
氮氧化合物的产生
自然源产生
自然源产生的氮氧化物主要来自土壤中氮肥的分解、闪电、火
01
山爆发等自然现象。
02
土壤中的微生物可以将有机氮转化为氨,再氧化成硝酸盐,这
个过程中会产生氮氧化物。
政策建议与措施
01
制定严格的氮氧化物排放标准
根据不同行业和地区的特点,制定合理的排放标准,限制氮氧化物的排
放。
02
推广清洁能源和低碳技术
鼓励使用清洁能源和低碳技术,减少化石燃料的消耗,从源头上减少氮
氮氧化物的产生及转化

【拓展视野】
将一充满NO2的试管,倒立于水中, 一段时间后,观察到什么现象?
3NO2 + H2O =2HNO3 + NO
试管中红棕色消失,试管中液面上升。
三、氮氧化物对环境的污染与防治
1.氮氧化物对环境的污染
(1)酸雨(硝酸型酸雨) (2)对臭氧层的破坏 (3)光化学烟雾
2.氮氧化物对环境污染的防治 (1)来源: 氮氧化物主要来源于化石燃料的 燃烧,汽车尾气、工厂废气的排 放,其中,汽车尾气是城市大气 中氮氧化物的主要来源之一。 ①开发使用洁净能源; (2)防治:②对工厂排放的废气进行处理 ③对汽车尾气进行净化处理。
பைடு நூலகம்
【随堂练习】
1.在常温常压下,下列各组气体不能共存 的是( D)
A.SO2与O2
C.O2与N2
B.NO2与NO
D.NO与O2
2 .下列气体溶解于水,发生了氧化还原反 B、D ) 应的是 ( A.SO2溶解于水 B.NO2溶解于水
C.CO2溶解于水
D.Cl2溶解于水
3NO2 + H2O =2HNO3 + NO
专题4
硫、氮和可持续发展
第二单元 生产生活中的含氮化合物 氮氧化物的产生及转化
一、氮的固定
1、定义 将空气中游离态的氮元素转变为化 合态的氮元素的方法。
生物固氮:豆科植物的根瘤菌固 氮 2、途径:人工固氮:化肥的生产
雷雨固氮:
氮 氧 化 物 的 产 生
“一场雷雨一场肥”
N2+O2 放电
2NO
高中化学专题复习 氮氧化物的产生及转化

3.用电子守恒法判断 当NO2或NO转化为HNO3时要失去电子,若上述 两种气体与O2混合,O2得电子,且得失电子数必然相 等,这是电子守恒法解答此类题目的依据。
[例1] 将充满NO2和O2混合气体的10 mL量筒,倒立 在盛有水的水槽中,充分反应后,最后剩余1 mL气体,问
原混合气体中NO2和O2的体积各是多少? [解析] NO2和O2混合物溶于水后发生如下反应: 4NO2+O2+2H2O===4HNO3 当V(NO2)∶V(O2)=4∶1时恰好反应完全。现剩余1
mL气体,可能是O2也可能是NO,NO是发生反应3NO2+ H2O===2HNO3+NO所生成的,所以有两种可能的情况:
①若O2剩余,则参加反应的NO2和O2为9 mL。
根据4NO2+O2+2H2O===4HNO3, 得V(NO2)=9 mL×=7.2 mL, V(O2)=9 mL×+1 mL=2.8 mL。 ②若NO剩余,即NO2过量,则由3NO2+ H2O===HNO3+NO知,过量的NO2为3 mL,则4NO2+O2 +2H2O===4HNO3中反应的NO2和O2共7 mL。
+O2
VVNOO22>4∶1
② ③
NO
13[V(NO2)-4V(2)]序 气体号
反 剩余 剩余气体的量
应 气体
VVNOO2=4∶3 ④ 无
0
Ⅳ NO+O2 VVNOO2>4∶3 ④ NO V(NO)-43V(O2)
VVNOO2<4∶3 ④ O2 V(O2)-34V(NO)
(7)水俣病——含汞的工业废水引起的水体污染,可使 鱼类中毒,人食用中毒后的鱼会造成人体汞中毒。
[例2] 光化学烟雾形成的化学过程是:当汽车尾气产生 的NO2在日光照射下分解成NO和O时,即开始光化学烟雾的 循环,不断地产生O3,这个循环包括下列三个化学方程式, 请补充化学方程式②。
2020-2021高中化学苏教版1学案:专题4 第二单元 第1课时氮氧化物的产生与转化含解析

2020-2021学年高中化学苏教版必修1学案:专题4 第二单元第1课时氮氧化物的产生与转化含解析第二单元生产生活中的含氮化合物第1课时氮氧化物的产生与转化一、氮气、一氧化氮和二氧化氮1.氮气(1)物理性质:无色、无味,难溶于水,密度与空气相近,约占空气体积的4/5。
(2)化学性质:①通常情况下,较稳定,与其他物质不反应.②放电或高温下,能与氧气反应生成NO。
化学方程式为N2+O2错误!2NO2.一氧化氮和二氧化氮(1)物理性质:(2)化学性质:①常温下,NO不稳定,易与O2化合。
化学方程式为2NO+O2===2NO2。
②NO2溶于水时与水发生反应。
化学方程式为3NO2+H2O===2HNO3+NO。
二、氮氧化物的来源、危害及防治措施1.来源(1)氮肥的生产,金属的冶炼和汽车等交通工具尾气的排放.(2)自然界中火山爆发、电闪雷鸣。
2.危害①酸雨;②光化学烟雾;③破坏臭氧层。
3.防治措施(1)①使用洁净能源,减少氮氧化物的排放。
②为汽车安装尾气转化装置,将汽车尾气中的一氧化碳和一氧化氮转化为二氧化碳和氮气。
(2)对生产化肥、硝酸的工厂排放的废气进行处理。
探究点一氮的氧化物溶于水的有关计算问题1.解题思路(1)要明确试题要求,如反应后容器内是否有剩余气体?剩余气体可能是什么?注意剩余气体不可能是NO2,也不可能是NO与O2的混合气体。
(2)计算中可能用到的化学反应:3NO2+H2O===2HNO3+NO4NO2+O2+2H2O===4HNO34NO+3O2+2H2O===4HNO3(3)要对试题中产生的结果进行可能情况的讨论,如NO2与O2的混合气体溶于水时,剩余的气体是NO还是O2要进行讨论。
2.氮的氧化物溶于水的几种情况(1)NO2或NO2与N2(非O2)的混合气体溶于水。
根据3NO2+H2O===2HNO3+NO①利用气体体积变化差值进行计算。
(2)NO2和O2的混合气体溶于水.根据4NO2+O2+2H2O===4HNO3②可知:当体积比(3)NO和O2的混合气体溶于水。
1氮氧化物的产生及转化

2NO(无色)
2NO+O2=2NO2(红棕色) 3NO2+H2O=2HNO3+NO 硝酸与土壤中的矿物质作用生成硝酸盐,其中的NO3被植物根部吸收,转化为生长所需的养料 在新疆和青海交界处有一狭长山谷,风和日丽的晴天 顷刻间也会电闪雷鸣、狂风大作,过往的人畜常被雷 电击倒。但是那里牧草茂盛,四季常青,被牧民称为 “魔鬼谷”。请解释“魔鬼谷”牧草茂盛的原因。
氮的几种重要氧化物
HNO2:亚硝酸 氧化物 N2O
化合价 +1
HNO3:硝酸 N2O3 +3
亚硝酐 NO2
NO +2
----
N2O4 +4
----
N2O5 +5
硝酐
+4 ----
酸酐? ----
1、一氧化氮(NO) (1)物理性质: 常温下为无色、无味的气味,不溶于水。在大气中 达到一定浓度时有毒,NO使人体中毒的原理与CO相似,都 是与血红蛋白结合,使其失去输送氧气的功能。 (2)化学性质: 2NO + O2 = 2NO 2 (3)用途: 在生物学方面有独特作用,人体中极少量的NO会促 进血管扩张,防止血栓塞等。 2、二氧化氮(NO2) (1)物理性质: 常温下为红棕色、有刺激性气味的气体,与水反 应。在大气中达到一定浓度时有毒。 (2)化学性质: 3NO2+H2O = 2HNO3+NO
灰霾:
PM2.5:
“大量极细微的干尘粒等均匀地浮游在空中, 使水平能见度小于10千米的空气普遍有混浊现象”
是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。
光化学烟雾:
汽车、工厂等污染源排入大气的碳氢化合物(HC)和氮氧化物(NOx)等一
氮氧化物产生与控制分析

氮氧化物产生与控制分析引言氮氧化物(NOx)是指氮气和氧气在高温燃烧过程中生成的一类气体。
它们包括一氧化氮(NO)和二氧化氮(NO2),其中NO2是NO和氧气在大气中发生反应生成的主要产物。
氮氧化物的来源主要包括工业生产、交通运输、能源消耗等。
由于其对大气环境和人体健康的不良影响,控制氮氧化物的排放已成为环保领域的重要课题。
氮氧化物产生机理氮氧化物的产生与燃烧过程紧密相关。
主要有以下两种机理:热辐射机理在高温条件下,氮气和氧气发生反应生成氮氧化物。
在燃烧区域中,氮气和氧气首先生成一氧化氮(NO),然后氧化为二氧化氮(NO2)。
这个过程主要发生在火焰核心区域,是燃烧时主要产生氮氧化物的机制。
燃烧温度和燃料类型燃烧温度是影响氮氧化物生成的重要因素。
在高温燃烧条件下,氮气和氧气的反应速度增加,从而增加了氮氧化物的生成。
此外,不同燃料中氮的含量也会影响氮氧化物的产生量。
例如,含有高氮含量的煤炭和重油燃烧时会产生更多的氮氧化物。
氮氧化物控制方法为了减少氮氧化物的排放,我们可以采取以下控制方法:燃烧过程优化通过优化燃烧过程可以降低燃料中氮的反应温度和时间,从而减少氮氧化物的生成。
这可以通过调整燃烧设备的工作参数,如燃料喷射、空气供应等来实现。
氮氧化物净化技术氮氧化物净化技术主要包括选择性催化还原(SCR)和选择性非催化还原(SNCR)。
SCR技术是通过在废气中加入还原剂(如氨水或尿素溶液),与氮氧化物发生反应生成氨气,并通过催化剂催化还原氮氧化物为氮气和水。
而SNCR技术是在废气中直接加入还原剂,通过高温作用使氮氧化物发生非催化还原,从而减少氮氧化物的排放。
燃烧前后处理燃烧前后处理是通过在烟气中加入吸收剂或催化剂,使氮氧化物与之发生化学反应,并转化为无害物质。
例如,燃煤锅炉可以使用石灰石等材料来吸收废气中的氮氧化物,而汽车尾气中的氮氧化物可以通过装置催化转化为氮气和水。
氮氧化物的监测与控制为了有效监测和控制氮氧化物的排放,我们需要建立完善的监测系统和控制方案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、Murad等三位教授最早提出NO分子在人体内 有独特功能,近年来此领域研究有很大进展,因 此这三位教授荣获了1998年诺贝尔医学及生理 学奖,关于NO的下列叙述不正确的是( D ) A.NO可以是某些含低价N物质的氧化产物 B.NO可以与血红蛋白结合 C.NO可以是某些含高价N物质的还原产物 D.NO是红棕色气体
能力提升
1、汽车尾气(含一氧化碳、二氧化硫、二氧化氮 等)是城市空气的污染源之一,治理的方法之一 是在汽车的排气管装一个“催化转化器”,它能 使一氧化碳与一氧化氮反应生成可参与大气生态 循环的无毒气体。 ①汽车尾气中污染空气的主要物质 _________. CO 、 SO2 、 NO2 ②写出一氧化碳与一氧化氮反应的化学方程式 催化剂 _______________________ 2NO+2CO== N2+2CO2。 2、汽车所排放出来的废气中含有NO 污染环境。 现在通过氨催化还原法将它转化为无毒气体___ N2, 直接排入空气中。试着写出该反应的化学方程式。 并分析该反应电子转移情况 催化剂 6NO+ 4NH3==5N2+6H2O
氮氧化物的产生及转化
课前准备: 1、查找氮循环的资料,小组合 作画出氮循环图示,写出短文。
2、氮循环中涉及到哪些物质,写出 化学式,并从不同的角度对这些含氮 物质分类。
天上
N2
NO NO2
人间
地下
NH3
HNO3
NH3 、NH4
+、 NO
—
3
-3 0 +2 +4 NH3 N2 NO NO2
氢化物 单质 氧化物
1、NO、NO2的物理性质如何? 2、 NO、NO2典型反应为?用双线桥法分析 NO2与水的反应。 填入表格中
概括· 整合:
2、一氧化氮和二氧化氮
NO
物 理 性 质 化 学 性 质 无色气体 难溶于水,剧毒!
NO2
红棕色有刺激性气味 气体,易溶于水,剧毒!
2NO+O2=2NO
2
3NO2+H2O= 2HNO3+NO
2、通过预习写出反应的化学方程式。 判断N2是做了氧化剂还是还原剂? 3、什么是氮的固定?有哪两种形式?
概括· 整合:
氮气是无色无味难溶于水的气体
氮的固定 游离态
化学性质 如:N2+O2 很稳定
放电
化合态 2NO
N2+3H2
2NH3
有关氨的合 成史你了解 吗?
高能固氮 自然固氮 生物固氮 氮的固定 合成氨 人工固氮 仿生固氮
+5 HNO3
酸
-3 +5 NH4NO3
盐
教学目标
1、认识氮循环中的重要物质,认识氮 及其两种氧化物在生产生活中的应用和 对生态环境的影响。 2、通过了解固氮的两种形式,认识氮 在一定条件下能够与氧气、氢气发生反 应。 3、了解氮的两种氧化物性质及在自然界 中形成硝酸的过程。
探究一 氮气的性质
1、根据研究物质性质的方法和程序及氮气 的化合价并联系生活实际,预测N2性质如何?
3NO2+H2O=2HNO3+NO
2、若使试管中液面上升,可采取什么措施? 2NO+O2=2NO2 通入氧气
3NO2+H2O=2HNO3+NO 4NO+3O2+2H2O=4HNO3
3、以上两问对工业上生产硝酸有什么启示?
信息提示: 工业制硝酸共三步反应 第一步为:氨的催化氧化制NO 第二步为: 2NO+O2=2NO2 第三步为: 3NO2+H2O=2HNO3+NO
合作讨论1:NO分子的功与过
化学与生活
雷电交加时,空气中的氮气和有关的 含氮化合物发生了哪些化学反应?你能 说明吗?
放电 N2+O2==2NO
2NO+O2=2NO2 3NO2+H2O=2HNO3+NO “雷雨发庄稼”
合作讨论2:雷雨闪电的利与弊
化学与化工生产
1、现有一试管二氧化氮,将其倒置于盛 满水的水槽中,足够长的时间后,有什 么现象? 试管中气体的颜色褪去,液面上升, 剩余气体大约占试管总体积的1/3。
尽量使一氧化氮全部转化为 硝酸,减少对环境污染。
化学与生活环境
1、人类如何减少氮氧化合物对环境的影 响? 2、根据一氧化氮和二氧化氮中氮的化合 价分析思考如何处理一氧化氮和二氧化 氮尾气?
酸雨 的 危 害
洛杉 矶光 化学 烟雾
光化学烟雾:氮氧化物和碳氢化合物受到太阳紫外 线的照射,会发生一系列由光引起的复杂的化学变 化即光化学反应,产生大量的有毒物质。这些有毒 物质混合在一起形成的一种浅蓝色烟雾,称为光化 学烟雾。有特殊气味。光化学烟雾给人类和自然环 境带来了巨大的危害。刺激眼睛,伤害植物,并使 大气能见度降低,刺激人的呼吸系统而引发病变, 引发皮肤癌。1955年,洛杉矶因光化学烟雾引起的 呼吸系统衰竭死亡的人数达到400多人,这是最早 出现的由汽车尾气造成的大气污染事件。
NH3 人工 固氮
①雷电(自然固氮)
雷雨发庄稼
空气中N2
NO
NO2
HNO3
②化工、汽车尾气
酸雨、光化 学烟雾
作业:1、83页课后练习1(2)、(4)
2、新课堂88页1—7 3、查阅有关资料,了解大气 中氮氧化 物的来源,进一步了解氮氧 化合物的功与过、如何减少氮氧化合 物的排放等,写一篇小论文。
(3) 据你所知,氮气有哪些用途?
致冷剂 保护气、冷藏食品
制氨气、硝酸、化肥
1、 下列过程属于人工固氮的是( C )
A. 分离液态空气制氮气
B. 闪电时N2 转化为NO
C. 合成氨
D. 豆科作物根瘤菌将N2 转化为NH3
探究二 氮的氧化物性质
观察实验,你看到什么现象?得出 什么结论? 通过以上实验并结合课本概括:
