山东省武城县第二中学高中化学鲁科版必修二第一章基础知识回顾二(无答案)
鲁科版化学必修2知识点-高三化学笔记

化学必修2知识点归纳与总结第一章 原子结构与元素周期律第一节 原子结构 第1课时 原子核 核素 一、原子的构成:(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽略。
(3)带电特点:微粒 质子中子 电子带电特点一个质子带一个单位的正电荷不带电一个电子带一个单位的负电荷原子序数=核电核数=质子数=核外电子数(4)质量数(A )=质子数(Z )+中子数(N )(5)在化学上,我们用符号AZ X 来表示一个质量数为A ,质子数为Z 的具体的X 原子。
二、核素1.元素、核素、同位素、同素异形体的比较元素核素同位素同素异形体定义具有相同核电荷数(质子数)的同一类原子的总称 把具有一定数目的质子和一定数目的中子的一种原子称为核素。
一种原子即为一种核素 质子数相同而中子数不同的同一元素的不同原子互称为同位素(同一种元素的不同核素间互称为同位素)。
相同元素组成,不同形态的单质 本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的一类原子质子数相同、中子数不同的核素的互称同种元素形成的不同单质 范畴 同类原子,存在游离态、化合态两种形式 原子 原子单质 特性只有种类,没有个数 化学反应中的最小微粒物理性质不同,化学性质相同 由一种元素组成,可独立存在 决定因素 质子数 质子数、中子数质子数、中子数组成元素、结构 举例H 、C 、N 三种元素11H 、21H 、31H 三种核素23492U 、23592U 、23892U互为同位O 2与O 3原子AZX原子核质子 Z 个中子 N 个=(A -Z )个核外电子 Z 个素2.元素、核素、同位素、同素异形体的联系三、原子或离子中微粒间的数量关系1.原子或离子中核电荷数、质子数、中子数及核外电子数之间的关系(1)质子数+ 中子数= 质量数= 原子的近似相对原子质量(2)原子的核外电子数= 核内质子数= 核电荷数(3)阳离子核外电子数= 核内质子数–电荷数(4)阴离子核外电子数= 核内质子数+ 电荷数(5)除11H外,其它元素的原子中,中子数≥质子数2.原子的质量数与原子的相对原子质量及元素的相对原子质量的关系原子的质量数原子的相对原子质量元素的相对原子质量区别原子的质量数是该原子内所有质子和中子数的代数和,都是正整数原子的相对原子质量,是指该原子的真实质量与126C质量的121的比值,一般不是正整数元素的相对原子质量是由天然元素的各种同位素的相对原子质量与其在自然界中所占原子个数的百分比的积的加和得来的。
鲁科版高一化学必修二知识点总结归纳总复习提纲
②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。
④根据原电池中的反应类型:
负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
非金属性:F>Cl>Br>I
氧化性:F2>Cl2>Br2>I2
还原性:F-<Cl-<Br-<I-
酸性(无氧酸):HF<HCl<HBr<HI
注意:
比较粒子(包括原子、离子)半径的方法:(1)先比较电子层数,电子层数多的半径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
元素化合价规律
分子或共价化合物电子式,正确标出共用电子对数目。
CCl4
离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。阴离子电荷总数与阳离子电荷总数相等,因为化合物本身是电中性的。
鲁科版高一化学必修二知识点归纳_doc

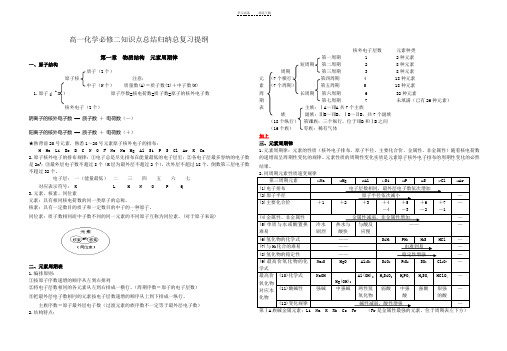
Z 高一化学必修二知识点总结归纳总复习提纲第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子( A X )原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)阴离子的核外电子数== 质子数+电荷数(—)阳离子的核外电子数== 质子数- 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号:K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
鲁科版高一化学必修二知识点归纳

高一化学必修二知识点总结归纳总复习提纲第一章 物质结构 元素周期律一、原子结构质子(Z 个)原子核注意:中子(N 个)质量数(A)=质子数(Z)+中子数(N)1.X ) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)阴离子的核外电子数 == 质子数 + 电荷数(—)阳离子的核外电子数 == 质子数 - 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低)二 三 四 五 六 七 对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数) 2.结构特点:核外电子层数 元素种类第一周期1 2种元素短周期 第二周期 2 8种元素第三周期 3 8种元素元 (7个横行) 第四周期 种元素素 (7个周期) 第五周期5 18种元素周 长周期 第六周期 6 32种元素 期 第七周期 7 未填满(已有26种元素)表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族(18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间(16个族) 零族:稀有气体 三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
武城县第二中学高中化学 第一章知识清单及基本方法汇总

山东省武城县第二中学高中化学必修一第一章知识清单及基本方法汇总第一节1.化学学科概念2、化学科学特征3、化学发展史上的成就和近代化学史4个重要人物及其贡献4、有关环境问题如温室效应、水华赤潮、酸雨、臭氧空洞等5、与生活相关的化学知识第二节第一课时第二课时1、氯气的物理性质,氯气的收集、尾气处理、氯气泄露的处理,氯水的成分及保存2、氯气与铁、铜、氢气反应实验现象及反应方程式、产物状态、溶于水后所得溶液颜色3、氯气溶于水和溶于氢氧化钠溶液的现象及解释4、氯气漂白性的实验探究5、氯水性质的实验探究及解释6、次氯酸及漂白粉和84消毒液成分及发挥作用、失效的解释基本题型见必修一第一章第二节题型梳理提纲第三节1.物质的量等相关概念2.阿伏伽德罗定律相关3.物质的量在化学方程式计算中的应用见步步高12页4.物质的量概念的理解和使用(不是质量,描述微粒多少但与个数不同,后面跟化学式,物质的量的单位及其符号)5.1mol任何指定粒子含N A(6 02×1023)个粒子6.结合化学式实现n⇔n N⇔N N⇔n(原子数,电子数,质子数,离子数等)之间的互相推导7.具有相同原子数或分子数的两种物质之间的物质的量或个数关系8.摩尔质量的含义及使用,与质量、相对原子、分子质量的区别,定义式a×N A((a为一个分子的质量)9.n、N、m、M、N A的互相推导及结合化学式的换算10.标况下气体摩尔体积的使用(气体或混合气体、0℃、101 kPa、22.4)11.阿伏加德罗定律的使用PV = nRT PM =ρRT 三同定一同、两同成比例12.的互相推导使用,注意V g→n有条件(使用22.4 L·mol-1必须是标况,体积相同推出物质的量相同必须是相同状况);n→m或N无条件13.一定物质的量浓度溶液配置的过程,所需的仪器,托盘天平及容量瓶、量筒的使用14.误差分析包括称量或量取过程,是否恢复室温及洗涤,转移和定容过程15.物质的量浓度的含义、使用及结合化学式推导离子浓度,注意浓度大小与体积无关16.物质的量浓度与质量分数的区别和联系,换算关系17.溶液混合、稀释浓度的计算注意浓度计算的起点通常有三种:Ⅰ从“定义式”出发,Ⅱ从“换算式”出发,Ⅲ从“守恒”的观点出发指1.稀释前后“溶质的物质的量守恒”,即c1V1=c2V2(其中c1、c2是稀释前后溶质的物质的量浓度,V1、V2是稀释前后溶液的体积)。
(完整版)鲁科版高一化学必修二知识点总结归纳总复习提纲
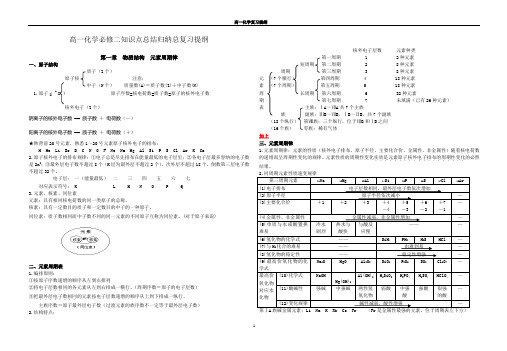
Z 高一化学必修二知识点总结归纳总复习提纲第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子( A X )原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)阴离子的核外电子数== 质子数+电荷数(—)阳离子的核外电子数== 质子数+电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体加上三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
山东省武城县第二中学高中化学 第一章 基础知识回顾练习(无答案)鲁科版必修2
一、几个概念
(1)元素:
注:①元素是一类“原子”;②质子数决定元素种类
(2)核素:
注:①研究对象为原子。
②质子数和中子数决定核素,只有二者都相同才是相同核素
(3)同位素:
注:①研究对象为原子。②物性不同,化学性质几乎相同,因为相同。
③不是所有元素都存在同位素。
④重要同位素用途:14C用于测定文物的年代。
——
——
——
——
——
实验室制NH3
实验室制Cl2
(4)同素异形体:
注:①研究对象为。②物理性质不同,化学性质相似。
(5)同分异构体
注:①分子式相同(若改为分子量不同则不正确)
②研究对 象:化合物
③物性不同,化学性质不一定相同。
【练习】
下列互为同素异形体 的是
互为同位素的是
互为同分异构体的是
属于同种元素的是
①235U和238U;②红磷和白磷;③C60与石 墨;
核外电子层:n=1,2,3,4,5,6,7
电子层符号:
能量依次
原子结构示意图
写出下;ClCl-
OO2-SS2-
MgMg2+AlAl3+
四、元素周期律与元 素周期表
1.元素周期律:
实质
2.元素周期表:
(1)在下列表格中标出族序数,画出周期表的边界,标出金属与非金属的分界线,写出前18号、稀有气体、IA、ⅡA、ⅤA、ⅥA、ⅦA元素符号(默写),。
(2)mg 中所含质子的物质的量为,所含质子数为
所含电子的物质的量为,1mol OH-中含电子数为
三、核外电子排布
一般规律:①各层最多容纳的电子数为(用n表示电子层)
鲁科版化学必修二知识点总结
Z 鲁科版化学必修2知识点归纳与总结 第一章原子结构与元素周期律一、原子结构质子(Z 个)原子核注意:中子(N 个)质量数(A)=质子数(Z)+中子数(N)1.原子(AX ) 核外电子(Z 个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:HHeLiBeBCNOFNeNaMgAlSiPSClArKCa 2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里; ②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一二三四五六七 对应表示符号:KLMNOPQ 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 质量数:质子数与中子数之和,为整数,不同于相对原子质量。
含有10电子数目的微粒: NeHFH 2ONH 3CH 4(五分子) Na +Mg 2+Al 3+H 3O +NH 4+(五阳离子) F -O 2-N 3-OH -NH 2-(五阴离子)含有18电子数目的微粒: ArHClH 2SPH 3SiH 4 F 2H 2O 2N 2H 4 C 2H 6CH 3OH K +Ca 2+Cl -S 2-P 3-HS - 二、核外电子排布2.核外电子排布规律:①?最外层最多只能容纳8个电子(氦原子是2个); ②?次外层最多只能容纳18个电子;③倒数第三层最多只能容纳32个电子; ④?每个电子层最多只能容纳2n 2个电子。
离核较近的区域内运动的电子能量较低,离核较远的区域内运动的电子能量较高。
另外,电子总是尽可能地先从内层排起,当一层充满后再填充下一层。
1~18号元素的原子结构示意图三、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。
山东省德州市武城第二中学高中化学鲁科练习 必修二 第一二章复习题
1.含硒(Se)的保健品已开始进入市场。
已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是( )A.非金属性比硫强B.氢化物比HBr稳定C.原子序数为34D.最高价氧化物的水化物显碱性2.下列反应前后物质的总能量变化可用右图表示的是()A.生石灰加水生成熟石灰B.C+H2O=CO+H2C.金属钠与水反应D.HNO3+NaOH=NaNO3+H2O3.对于100mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用100mL3mol/L 盐酸;③多用300mL1mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸;⑥等量的铁片上连接小块铜。
其中能使反应速率加快的是()A.①②④⑤ B.①②④⑥ C.①②③④ D.①②③⑤4.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是 ( )A.X的氢化物比R的氢化物稳定B.原子半径大小顺序是Z>Y>X>RC.Z的单质能与Y的某些化合物发生置换反应D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构5.下列有关叙述:① 非金属单质M能从N的化合物中置换出非金属单质N;② M原子比N 原子容易得到电子;③单质M跟H2反应比N跟H2反应容易得多;④气态氢化物水溶液的酸性H m M>H n N;⑤氧化物水化物的酸性H m MO x>H n NO y;⑥熔点M>N。
能说明非金属元素M比N的非金属性强的是()A.②⑤B.①②③C.①②③⑤D.全部6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的()A.氢氧化钠固体B. 硝酸钠溶液C. 硫酸钾溶液D.碳酸钠固体7.下列相关实验不能达到预期目的的是()相关实验预期目的①将SO2通入溴水,溴水褪色后加热观察能否恢复原色验证SO2漂白的可逆性②将氯气通入淀粉KⅠ溶液中验证Cl的非金属性比Ⅰ强③在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率。
山东省武城县第二中学高中化学 第一章 原子结构与元素周期律基础知识 鲁科版必修2
第一章 原子结构与元素周期律基础知识复 习【教学目的】1. 熟悉原子核、核外电子排布的综合知识2. 掌握元素周期律内容、元素周期表的结构,理解“位-性-构”的关系 【重点、难点】原子核结构、元素周期律和周期表 【知识分析】1. 原子结构..c.o.m原子原子核质子个,带正电荷中子个,不带电荷质子数质子数中子数决定原子种类核素:、至少一项不同同位素:同异质子数决定元素的种类核外电子电子数个最外层电子数决定主族元素的化学性质最高正价、族序数质子数和电子数决定原子呈电中性运动特征体积小运动速率高接近光速无固定轨道电子云比喻小黑点的意义原子轨道轨道球形、轨道纺锤形、轨道梅花形等排布规律Z A X Z N A Z N Z N Z N Z s p d ()()()()(),()(),(),()()()()()()⎧⎨⎪⎪⎩⎪⎪⎫⎬⎪⎪⎭⎪⎪⎧⎨⎪⎩⎪⎧⎨⎪⎩⎪⎧⎨⎪⎪⎩⎪⎪→=+→→→→12123():()()(),,12223821832能量最低原理核外电子排布总是尽先排布在能量最低的电子层里各电子层最多容纳的电子数是个最外层电子数不超过个层不超过个次外层电子数不超过个倒数第三层电子数不超过个n K ⎧⎨⎪⎪⎪⎪⎩⎪⎪⎪⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪附:10电子结构的微粒:Ne 、CH 4、NH 3、H 2O 、 HF ; N 3-、O 2-、F -、OH -;Na +、Mg 2+、Al 3+、18电子结构的微粒:Ar 、HCl 、H 2S 、PH 3;F 2、H 2O 2、N 2H 4、C 2H 6、CH 3OH ;Cl -、S 2-、HS -;K +、Ca 2+2. 元素周期律和元素周期表w.w.w.zxxk.c.o.m注意11H 中无中子。
元素周期律随着原子序数的递增:原子结构呈周期性变化最外层电子数原子半径呈周期性变化大小元素主要化合价呈周期性变化正价:,负价:--元素的得失电子能力呈周期性变化金属非金属,稀有气体()()()()()()()()1182317 414→→+→+→→⎧⎨⎪⎪⎪⎪⎩⎪⎪⎪⎪元素周期表排列原则按原子序数递增的顺序从左到右排成横行将电子层数相同的元素排成一个横行把最外层电子数相同的元素个别除外按电子层数递增的顺序从上到下排成纵列结构周期个短周期、、周期-含、、种元素长周期、、周期-含、、种元素不完全周期周期最多容纳种元素族个主族由长周期、短周期共同构成共个副族完全由长周期构成共个族,,纵列族稀有气体()()()()()()()()()()(~)()(~)()()123712328845618183273216778910⎧⎨⎪⎪⎩⎪⎪-⎧⎨⎪⎩⎪--⎧⎨⎪⎪⎪IA VIIAIB VIIBVIII⎩⎪⎪⎪⎧⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎧⎨⎪⎩⎪⎫⎬⎪⎭⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪元素性质递变规律原子半径化合价金属性和非金属性同周期同主族()()123. 元素周期表中的周期、同主族元素性质递变规律性质同周期(左→右)同主族(上→下)原子序数小→大(依次递增1)小→大电子层结构电子层数相同最外层电子数依次增加电子层数递增1 最外层电子数相同原子半径逐渐减小(0族除外)逐渐增大失电子能力得电子能力逐渐减弱逐渐增强逐渐增强逐渐减弱金属性非金属性逐渐减弱逐渐增强逐渐增强逐渐减弱主要化合价最高正价(+1→+7)非金属元素负价(-4→-1)负价=-(8-族序数)主族元素最高正价数=族序数稀有气体化合价为0最高价氧化物对应水化物的酸碱性酸性逐渐增强碱性逐渐减弱酸性逐渐减弱碱性逐渐增强非金属气态氢化物形成难易及其稳定性形成逐渐变容易稳定性逐渐增强形成逐渐变困难稳定性逐渐减弱附:1、判断元素金属性和非金属性强弱的方法:(1)金属性强(弱):①单质与水或酸反应生成氢气容易(难);②元素最高价氧化物对应水化物的碱性强(弱);③置换反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015.5
必修Ⅱ第一章基础知识回顾(二)
一、几个概念
(1)元素:
注:①元素是一类“原子”;②质子数决定元素种类
(2)核素:
注:①研究对象为原子。
②质子数和中子数决定核素,只有二者都相同才是相同核素
(3)同位素:
注:①研究对象为原子。
②物性不同,化学性质几乎相同,因为相同。
③不是所有元素都存在同位素。
④重要同位素用途:14C用于测定文物的年代。
(4)同素异形体:
注:①研究对象为。
②物理性质不同,化学性质相似。
(5)同分异构体
注:①分子式相同(若改为分子量不同则不正确)
②研究对象:化合物
③物性不同,化学性质不一定相同。
【练习】
下列互为同素异形体的是
互为同位素的是
互为同分异构体的是
属于同种元素的是
①235U和238U;②红磷和白磷;③C60与石墨;
CH3 CH3
④CH3CH2CHCH3和CH3CH-CH2CH3
⑤CH3CH2OH和CH3OCH3;⑥37Cl2和35Cl2
二、原子构成微粒的数量关系
质量数=近似相对质子质量(A=Z N)
原子:核电荷数===原子序数
阳离子:Z X n+中核外电子数=
X n-中核外电子数=
Z
【练习】
(1)131
I的原核内中子数与质子数的差为。
53
(2)mg A n
X 中所含质子的物质的量为,所含质子数为
Z
所含电子的物质的量为,1mol OH-中含电子数为
三、核外电子排布
一般规律:①各层最多容纳的电子数为(用n表示电子层)
②最外层电子数不超过。
(K为最外层时,不超过个)
③次外层不超过个电子
④核外电子总是尽先排布在能量最(填低或高)、离核最(填远或近)的电子层里,然后由
向(填内或外)依次排在能量逐步(填升高或降低)的电子层里。
核外电子层:n=1,2,3,4,5,6,7
电子层符号:
能量依次
原子结构示意图
写出下列原子或离子结构示意图
Na Na+Cl Cl-
O O2-S S2-
Mg Mg2+Al Al3+
四、元素周期律与元素周期表
1.元素周期律:
实质
2.元素周期表:
(1)在下列表格中标出族序数,画出周期表的边界,标出金属与非金属的分界线,写出前18号、稀有气体、IA、ⅡA、ⅤA、ⅥA、ⅦA元素符号(默写),。
(2)据表回答下列问题
各周期元素的种类
第一周期种元素;第二、三周期种元素;第四、五周期种元素;第六周期种元素。
(3)周期表中元素的相关信息:Array
以Fe为例
3.元素周期表中的递变性
(1)性质递变
非金属性:从左→右逐渐;从上→下逐渐
与非金属性一致的递变性:
气态氢化物稳定性、气态氢化物生成的难易、最高价氧化物的水化物的酸性、单质的氧化性、原子得电子能力。
与非金属性有关且相反的递变性:氢化物的还原性,阴离子的还原性。
金属性从左→右逐渐;从上→下逐渐
与金属性递变规律一致的:
金属原子失e-的能力、金属活泼性、置换氢的难易,最高价氧化物的水化物的碱性。
与金属性递变规律有关且相反的:金属阳离子的氧化性。
2.半径递变
原子半径:从左→右;从上→下
离子半径:
同周期从左→右:阳离子半径阴离子半径,同为阳离子:半径逐渐,同为阴离子:半径逐渐。
同主族从上→下
半径比较规律:一看,二看,三看
比较半径大小:Na Cl Na+Cl-Cl-Cl Na+Na
O2-、F-、Na+、Cl-、S2-
4.比较熔沸点:根据状态:固液气
五、元素周期表的应用
1.元素推断推断元素及其化合物的常用知识点
(1)族序数与周期数相同的元素有;族序数是周期数2倍的元素有;族序数是周期数3倍的元素是;族序数是周期数3倍多1的元素是。
同主族两元素原子序数是2倍关系的是
(2)周期数是族序数2倍的元素是和;周期数是族序数3倍的元素是。
(3)最外层电子数是次外层电子数3倍的元素是。
最外层电子数是次外层电子数2倍的元素是;最外层电子数等于次外层电子数的元素是。
最外层电子数是内层电子数一半的是
(4)没有中子、只由质子和电子构成的原子是,相对原子质量相差1倍或2倍的同位素是的3种同位素(、、).
(5)原子半径(密度)最小的元素是,它们构成的单质都可以用来填充气球。
(6)地壳中含量最多的元素是,其次是;地壳中含量最多的金属元素是,其次是。
(7)最难得到电子、又难失去电子的原子位于族。
(8)短周期,最高化合价与最低化合价绝对值之差为4的元素是;最高化合价与最低化合价绝对值之差为0的元素是和。
(9)上一周期元素原子所形成的离子和下一周期元素最高价离子的电子层结构相同。
都与与上一周期的0族元素原子的电子层结构相同。
(10)是构成有机物骨架的元素,所形成的化合物种类最多。
该元素有多种不同的同素异形体,其中一种硬度最大。
(11)常温下能跟H2O反应放出O2的化合物是;与H2O反应放出H2的单质有。
(12)能导电的非金属单质是。
(13)常温下呈液态的非金属单质是。
(14)某元素的氢化物可与其最高价氧化物对应水化物的浓溶液发生氧化还原反应的元素是
(15)既能在CO2中燃烧,又能在N2中燃烧的金属是;既能与酸又能与碱反应放出气体的金属是。
(16)含10个电子的分子有,离子有
等。
(17)同一元素的气态氢化物,和最高价氧化物对应水化物反应生成盐,则该元素一定是。
(18)既能与酸反应,又能与碱反应的化合物可能是、、、等。
A、B、C三元素的最高价氧化物的水化物之间两两反应,则其中一种一定是,另两种最高价氧化物的水化物为强酸或强碱。
(19)A物质加到B物质中,先生成沉淀,后沉淀又溶解,A、B可能分别是CO2与、NaOH与
等。
(20)能使溴水褪色的物质有、、不饱和烃、等。
(21)特殊的实验现象
①焰色反应:钠元素为黄色,钾元素为(透过蓝色钴玻璃观察)。
②遇酚酞溶液变红的气体必是。
③在空气中迅速由无色变为红棕色的气体是。
④向一溶液中加入碱液,产生白色沉淀,进而沉淀颜色变成灰绿色,最后变成红褐色,则该溶液中一定含。
⑤遇SCN -显红色或遇OH -生成红褐色沉淀的离子是 。
⑥遇BaCl 2溶液生成不溶于酸的白色沉淀的溶液中可能含有。
⑦遇HCl 生成沉淀的溶液中可能含有
、。
⑧使品红褪色的气体可能是
或
,固体可能是次氯酸盐
、
等,液体可能为。
(22)、黄绿色气体 淡黄色固体 短周期元素形成的气体单质 2.注意元素推断题的限定条件 (1)短周期元素前
号。
前20号则一般含。
(2)原子序数依次增大。
若原子序数增大,半径也增大,则为不同周期,若原子序数A >B ,原子半径A <B ,
则为同周期。
3.注意要求:
由大到小还是由小到大
写原子结构示意图还是离子结构示意图 写化学式、名称、元素符号 化学方程式还是离子方程式 原子半径还是离子半径 3.常考到的方程式
3()Al OH 与24H SO (4HClO )反应离子方程式 3()Al OH 与NaOH 反应的离子方程式
33NH HNO +—— 3NH HCl +—— 2Na H O +—— 22H S SO +—— 222Cl SO H O ++——
实验室制NH 3 实验室制Cl 2。
