太原理工大学物理化学
太原理工大学考研化工原理复习题

化工第一章流体力学一、单选题1.单位体积流体所具有的()称为流体的密度。
AA质量;B粘度;C位能;D动能。
2.单位体积流体所具有的质量称为流体的()。
AA密度;B粘度;C位能;D动能。
3.层流与湍流的本质区别是()。
DA湍流流速〉层流流速;B流道截面大的为湍流,截面小的为层流;C层流的雷诺数〈湍流的雷诺数;D层流无径向脉动,而湍流有径向脉动。
4.气体是()的流体。
BA可移动;B可压缩;C可流动;D可测量。
5.在静止的流体内,单位面积上所受的压力称为流体的()。
C A绝对压力;B表压力;C静压力;D真空度。
6.以绝对零压作起点计算的压力,称为()。
AA绝对压力;B表压力;C静压力;D真空度。
7.当被测流体的()大丁外界大气压力时,所用的测压仪表称为压力表。
DA真空度;B表压力;C相对压力;D绝对压力。
/8.当被测流体的绝对压力()外界大气压力时,所用的测压仪表称为压力表。
A A大丁;B小丁;C等于;D近似丁。
9.()上的读数表示被测流体的绝对压力比大气压力高出的数值,称为表压力。
A A压力表;B真空表;C局度表;D速度表。
10.被测流体的()小丁外界大气压力时,所用测压仪表称为真空表。
DA大气压;B表压力;C相对压力;D绝对压力。
11.流体在园管内流动时,管中心流速最大,若为湍流时,平■均流速与管中心的最大流速的关系为()o I BA.Um = 1/2Umax;B. Um = 0.8Umax;C. Um = 3/2Umax。
12.从流体静力学基本方程了解到U型管压力计测量其压强差是()。
AA.与指示液密度、液面高度有关,与U形管粗细无关;B.与指小液密度、液面周度无关,与U形管粗细有关;C.与指示液密度、液面高度无关,与U形管粗细无关。
13.层流底层越薄()。
CA.近壁面速度梯度越小;B.流动阻力越小;C.流动阻力越大;D.流体湍动程度越小。
14.双液体U形差压计要求指示液的密度差()CA.大;B.中等;C.小;D.越大越好。
太原理工大学化工学院考研复试全过程

考研论坛tibet雄鹰 2011-05-311.总体流程:4月9日报道(主要是交复试费120块,需注意事项:先去研究生院报道再去所报考的院所报道)4月10日面试今年共来复试183人,其中化学工程与技术来了130+ 专硕化学工程10- 化工机械10- 物理化学20+ 高分子化学与物理10最后录取人数170-30+ =130+ 170为2010届硕士计划招生人数(包括保送生和全国统考生)30+ 为保送生(保送生不参加全国统考初试,已于2009年录取完毕)所以我们全国统考的考生就是183个人来竞争130+ 的名额。
竞争还是很激烈的。
复试比例也超过了1:1.2 达到1:1.34月11日上午体检,下午笔试。
2. 面试经过考生183人按专业被分为6组,每组35人,最后一组不足35人,上午8:30 开始面试每组面试博导级的教授3名,记录员1名。
面试就考英语口语和专业知识。
(1 )口语考法:面试的分组不一样考法不一样,主要看面试的教授怎么考。
时间3分钟左右。
主要有:1.随机的让你用英语介绍你比较熟悉的话题,如:介绍一下你的家乡,介绍一下你本科所读的大学,往届生介绍一下你以前的工作等等,总之随机性很大,完全靠平时积累。
对策:在和老师谈话时尽量往你准备过的话题引 2.给你一段化工专业英语材料,让你朗读完后翻译。
难道较大,主要是有一些专业词汇不认识,好多人都读不下来。
对策:看本科时的专业英语教材,背背重点的专业词汇总结:初试完后,一定要练练口语,最起码要达到在陌生人面前敢讲英语的程度。
今年考生情况:大家口语都很一般,有的人甚至连一句完整的话都说不了。
口语考试在复试中的重要性:很低,因为大家都很一般,你不要连一个英语单词都蹦出来就行。
(2)专业知识考法:由教授随机的问你关于化工原理,物理化学,有机化学,无机化学,分析化学等专业课的最重要也是最基础的知识。
如:换热器设计的依据是什么?熵增原理是什么?热力学第一,第二,第三定律是什么?等等。
太原理工大学专业名称一览表
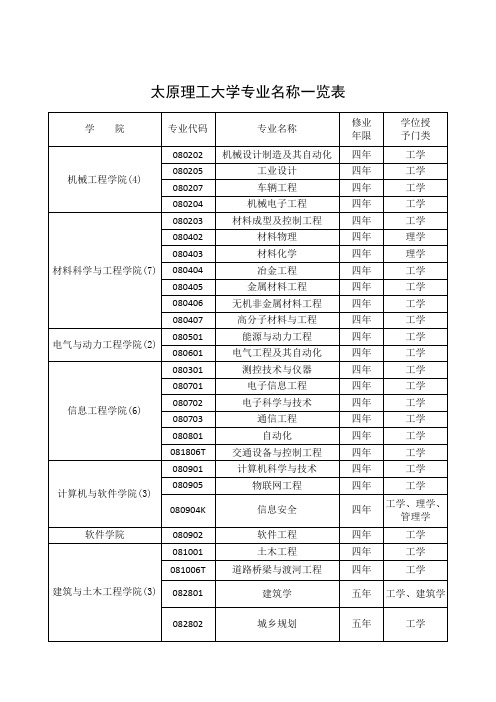
工学
矿业工程学院(10)
081401
地质工程
四年
工学
070502
自然地理与资源环境
四年
理学
070504
地理信息科学
四年
理学
081005T
城市地下空间工程
四年
工学
081201
测绘工程
四年
工学
081402
勘查技术与工程
四年
工学
081403
资源勘查工程
四年
工学
081501
采矿工程
四年
工学
081503
矿物加工工程
环境工程
四年
工学
水利科学与工程学院(3)
081101
水利水电工程
四年
工学
081102
水文与水资源工程
四年
工学
082305
农业水利工程
四年
工学
化学化工学院(5)
070302
应用化学
四年
理学
080206
过程装备与控制工程
四年
工学
081301
化学工程与工艺
四年
工学
081302
制药工程
四年
工学
083001
生物工程
四年
工学
082901
安全工程
四年
工学
经济管理学院(7)
020401
国际经济与贸易
四年
经济学
020106T
能源经济
四年
经济学
120103
工程管理
四年
管理学
120202
市场营销
四年
管理学
120203K
太原理工大学研究生考试参考书目

日语翻译基础
汉日翻译教程(重排版),苏琦,商务印书馆2008;日汉翻译教程,陶振孝,高等教育出版社2007
448
汉语写作与百科知识
中国文化读本,叶朗,外研社2008
501
建筑设计
建筑设计、城市设计、城市景观设计、室内设计类参考书
502
历史建筑复原设计
历史建筑设计类参考书;城市设计、建筑设计、室内设计类参考书
827
电路及电力电子技术
《电路》邱关源主编,高等教育出版社;《电力电子技术》(第五版)王兆安主编,机械工业出版社
828
大学物理
《大学物理》第三版,王纪龙编,科学出版社
829
模拟与数字电子技术
1.《模拟电子技术基础简明教程》(第三版),杨素行主编,高等教育出版社;
2.《数字电路逻辑设计》(第二版),王毓银主编,高等教育出版社
710
艺术史论
美术领域:
1.中央美术学院人文美术系外国史教研室:《外国美术简史》,北京,2014年10月01日,中国青年出版社;
2.中央美术学院美术史系,中国美术史教研室:《中国美术简史》,北京,2010年06月01日,中国青年出版社;
3.彭吉象:《艺术学概论》(第4版),北京,2015年05月01日,北京大学出版社;4.叶朗:《美学原理》,北京,2016年1月,北京大学出版社。
816
发动机原理
《汽车发动机原理》,清华大学出版社,王建昕、帅石金主编
819
材料科学基础(含金属\高分子\无机)
《材料科学基础》徐恒钧编,北京工业大学出版社
820
物理化学C
《物理化学》天津大学物理化学教研室编(第四版),天津大学出版社
821
固体物理
化学类高校考研参考书目汇总——物理化学

曲阜师范大学化学与化工学院
浙江师范大学生化学院
山西大学分子科学研究所、化学化工学院
电子科技大学微电子与固体电子学院、光电信息学院
西北大学化学与材料科学学院、分科所、化学所
武汉理工大学理学院
南昌大学理学院
重庆大学化学化工学院、生物工程学院
江西师范大学化学化工学院
湖北大学材料学与工程学院、化学化工学院
新疆大学化学化工学院
兰州理工大学石油化工学院
燕山大学环境与化学工程学院
西北工业大学理学院、生命科学院
《物理化学》,天津大学物理化学教研室编,高等教育出版社
北京理工大学机电学院、化工与环境学院
厦门大学材料学院2010年
北京交通大学理学院
上海交通大学药学院
北京工商大学化学与环境工程学院
浙江大学理学院、材料与化学工程学院2007年
北京工业大学环境与能源工程学院
华南理工大学材料科学与工程学院、化学与化工学院、生物科学与工程学院
中科院研究生院材料科学与光电技术学院、化学与化学工程学院
天津大学材料科学与工程学院、环境科学与工程学院、理学院、管理与经济学部、电子信息工程学院、化工学院
吉林大学材料科学与工程学院
中山大学工学院
东华大学材料科学与工程学院
西安建筑科技大学理学院、材料科学与工程学院
浙江理工大学理学院
合肥工业大学化学工程
武汉理工大学理学院
安徽理工大学热能工程、化学工程、应用化学
武汉科技大学材料与冶金学院、化学工程与技术学院、资源与环境学院
安徽工业大学化学与化工学院、分子工程与应用化学研究所、材料科学与工程学院
湖北工业大学化学与环境工程学院、生物工程学院
教学改革创新项目拟资助项目

序号 1 2 3 4 5 6 7 8 9 项目名称
MOOC时代下《物理化学》教学改革与实践 工程结构抗震与防灾课程教学实验的改革探索 基于《工程水文学》课程的教学改革研究 勘查技术与工程专业“地球物理位场理论”的教学方法研究 实践教学管理系统在实验教学中的应用与完善 基于多元化教学模式的建筑节能新技术课程建设与改革 基于山西省特色专业建设的材料科学基础课程改革与实践 信息环境下《机械制造装备设计》课程混合式教学模式的探索及教学效果评价体系 的构建 车辆专业工程教育专业认证的专业工程实践体系建设研究
在高校实施方式的探索 大学生体育锻炼习惯形成的影响因素测量建构及干预研究
任鸿瑞 桑莉君 盛清涛 石文萍 宋志伟 苏 民
48 《西方经济学》课程案例式教学改革研究 49 “电工电子技术”实验教学方法及实验成绩评价方式改革的探索与实践 50 “主客观”相结合的体育课堂教学设计研究 51 动态热身方案在普通高校大学生体育课中的应用研究 52 普及高校非化学专业学生日常化学知识的探索与实践 53 安全工程专业卓越工程师培养中协同式教学模式的探索 54 应用物理类“嵌入式系统”项目演示性实践教学与大学生创新能力训练研究 55 《理论力学》本科生课程的讨论式教学实施 56 《马克思主义基本原理概论》课程实践教学改革研究 57 计算机基础课考试改革的研究与实践 58 化学工程与工艺专业大学生化工安全素质培养的探索与研究 59 化工类专业化工过程安全教学体系建设 60 C语言程序设计立体滚筒式数学与数字化评估方法研究 61 新形势下地方高校创新创业教育体系构建研究 62 水分析化学双语教学在本科教学中的探索与实践 63 基于卓越工程师培养计划的“矿山防尘技术”课程教学改革 64 基于学生自主创新能力培养的流体力学实验教学的研究与探讨 65 生物医学工程专业课程模块化人才培养体系的探索与研究
(NEW)太原理工大学物理化学(含705物理化学A、807物理化学B)历年考研真题汇编
2013年太原理工大学807物理化学B考研真 题
2013年太原理工大学705物理化学A考研真 题
2009年太原理工大学807物理化学B考研真 题
2008年太原理工大学807物理化学B考研真 题
2007年太原理工大学705物理化学A考研真 题
2006年太原理工大学405物理化学A考
2013年太原理工大学807物理化学B考研真题 2013年太原理工大学705物理化学A考研真题 2009年太原理工大学807物理化学B考研真题 2008年太原理工大学807物理化学B考研真题 2007年太原理工大学705物理化学A考研真题 2006年太原理工大学405物理化学A考研真题 2005年太原理工大学354物理化学A考研真题
太原理工大学各学院及专业方向中英文对照表
太原理工大学各学院及专业(方向)中英文对照表【机械工程学院】College of Mechanical Engineering机械设计制造及其自动化Mechanical Design & Manufacturing and Automation1.机械制造及其自动化Mechanical Manufacturing and Automation2.机械设计及理论Mechanical Design and Theory3.机械电子工程Mechatronics Electronics Engineering4.车辆工程Vehicle Engineering工业设计Industrial Design机械系Department of Mechanical Engineering机械制造工艺及设备Machinery Manufacturing Process and Equipment【材料科学与工程学院】College of Materials Science and Engineering材料成型及控制工程Materials Processing and Controlling Engineering金属材料工程Metallic Materials Engineering无机非金属材料工程Inorganic Non-metallic Materials Engineering冶金工程Metallurgical Engineering高分子材料与工程Macromolecular Materials and Engineering材料物理Materials Physics材料化学Materials Chemistry1.材料物理与化学Materials Physics and Chemistry2.材料科学与工程Materials Science and Engineering3.材料加工工程Materials Processing Engineering4.钢铁冶金Iron and Steel Metallurgy5.有色金属冶金Nonferrous Metallurgy【电气与动力工程学院】College of Electrical and Power Engineering电气工程及其自动化Electrical Engineering and Automation热能与动力工程Thermal Energy and Power Engineering培养方向:1.热动力工程Thermo Power Engineering2.动力机械及工程Power Machinery and Engineering3.电机与电器Electrical Machinery and Appliances4.电力系统及其自动化Electrical System and its Automation5.高压电绝缘技术High-V oltage Electricity an Insulation Technology6.电气,电子和传动装置Electrical, Electronics and Transmission7.电工理论与新技术Theory and New Technology of Electrical Engineering 【信息工程学院】College of Information Engineering自动化Automation培养方向:电路系统Electric Circuit and System电子信息工程Electronic Information Engineering测控技术与仪器Measurement Control Technology and Instruments培养方向:1.检测技术与自动化设备Detecting Technology and Automatic Equipment2.系统工程Systems Engineering3.模式识别与智能系统Pattern Recognition and Intellectual System通讯工程Telecommunication Engineering培养方向:1.通信与信息系统Communication and Information System2.信号与信息处理Signal and Information Processing电子科学与技术Electronic Science and Technology培养方向:控制理论与控制工程Control Theory and Control Engineering 【计算机科学与技术学院】College of Computer Engineering and Software 计算机科学与技术Computer Science and Technology物联网工程Internet of Things Engineering【软件学院】College of Software软件工程Software Engineering【建筑与土木工程学院】College of Architecture and Civil Engineering建筑学Architecture城市规划Urban Planning土木工程Civil Engineering【水利科学与工程学院】College of Water Conservancy Science and Engineering水利水电工程Water Conservancy and Hydroelectric Engineering农业水利工程(含水利信息化方向)Agricultural Water Conservancy Engineering水文与水资源工程Hydrology and Water Resources EngineeringAgricultural Soil and Water EngineeringHydrology and Water ResourcesHydraulics and River DynamicsWater Engineering and Structural EngineeringWater Conservancy and Hydroelectric EngineeringHarbor Beach and Inshore Engineering【化学化工学院】College of Chemistry and Chemical Engineering化学工程与工艺Chemical Engineering and Technology(化学工艺、能源化工、精细化工、高分子化工方向)Chemical Engineering and Technology (Chemical Process、Chemical Energy、Fine Chemical、Polymer Chemistry)应用化学Applied Chemistry生物工程Bioengineering制药工程(化学与生物制药工程方向)Pharmaceutical Engineering过程装备与控制工程Process Equipment and Control Engineering化学和生物制药工程方向Chemical and Biological Pharmaceutical Engineering Direction【矿业工程学院】College of Mining Engineering采矿工程Mining Engineering安全工程Safety Engineering资源勘查工程Resource Prospecting Engineering测绘工程Geodesy and Geomatics Engineering地理信息系统工程Geographical Information System Engineering矿物加工工程Mineral Processing Engineering城市地下空间工程City Underground Space Engineering勘查技术与工程Exploration Technology and Engineering【轻纺工程学院】College of Textile Engineering with Academy of Fine Arts 纺织工程Textile Engineering服装设计与工程Apparel Design and Engineering艺术设计Artistic Design(2012级以前学生)服装与服饰设计Fashion Design【艺术学院】艺术设计Artistic Design(2012级以前学生)摄影Photography(2012级以前学生)绘画Painting动画Animation数字媒体艺术Digital Media Art文化产业管理Cultural Industry Management视觉传达设计Visual Communication Design环境设计Environment Design影视摄影与制作Photography and Video Production【环境科学与工程学院】College of Environmental Science and Engineering 给水排水工程Water Supply and Drainage Engineering环境工程Environmental Engineering建筑环境与设备工程Constructing Environment and Equipment Engineering 【数学学院】College of Mathematics数学与应用数学Mathematics and Applied Mathematics信息与计算科学Information and Computing Science统计学Statistics【物理与光电工程学院】College of Physics and Photo Electricity Engineering 光信息科学与技术Optical Information Science and Technology应用物理Applied Physics光源与照明Light Source and Lighting【力学学院】College of Mechanics工程力学Engineering Mechanics【外国语学院】College of Foreign Languages英语English【政法学院】College of Politics and Law法学Law行政管理Public Administration思想政治教育Ideological and Political Education【经济管理学院】College of Economics and Management 市场营销Marketing and Sales工程管理Construction Management会计学Accounting国际经济与贸易International Economics and Trade物流管理Logistics Management电子商务Electronic Business【体育学院】College of Physical Education体育教育Physical Education。
界面现象
太原理工大学物理化学第八章界面现象界面是指相互接触的两相的交界面。
自然界中的物质一般以三种聚集状态存在,三种相态相互接触可 以形成五种界面:液-气、固-气、液-固、液-液和固-固界面。
习惯上将液-气和固-气界面称为表面;而其余 的相界面都称为界面。
由于历史的原因, “表面”和“界面”这两个词经常混用。
界面并不是一个几何平 面,它是从一个相到另一个相的过渡层,有一定的厚度,通常称为界面相或界面层,与界面层相邻的两相 称为体相。
界面现象就是在相界面上所发生的物理化学现象。
许多自然现象、生理现象、工农业生产以至日常生 活上的许多问题都与界面现象有密切的关系,如:液滴呈球形、活性炭能脱色、粉尘容易爆炸等都与界面 现象有关。
产生界面现象的根本原因是由于界面相中的分子与体相中的分子所处的力场不同,因此界面相 的性质和两个体相的性质就会不一样。
在一般情况下,系统所具有的比表面积相当小,表面上的物质、能 量都比体相小得多, 故表面的特殊性质可不考虑。
但当系统的表面积很大时,表面分子所占的比例就很大, 它的特殊性质就成为矛盾的主要方面而表现出各种界面现象。
为了便于比较不同物质的表面性质,提出了比表面积的概念。
比表面积(as)是指单位质量或单位体 积的物质所具有的表面积,用公式表示为: as = As / m 或 as = As / V通常用比表面积来表示物质的分散程度,即分散度。
比表面积越大,分散度越高,表面效应就越明显, 这必然对系统的物理化学性质产生影响,此时就必须考虑界面的特殊性。
这种特殊性反映出的宏观现象就 是人们观察到的界面现象,其具体体现就是界面张力。
§ 8.11.液体的表面吉布斯函数和表面功界面张力界面现象产生的根本原因是由于两相界面上的分子与体相分子所 处环境不同引起的,以液-气界面为例说明之。
如图 8.1.1 所示,处于液 体内部的分子,受周围各分子对它的作用力是对称的,可以相互抵消, 这些分子在液体内部运动时无须对它做功。
太原理工考研物理化学C历年真题合集
A:CV(T1-T2) B:CP(T1-T2) C:(P1V1-P2V2)/(γ﹣1) D:R(T1-T2)/(γ﹣1) (13、11、10、09)一定量的理想气体从同一初态分别经历(1)等温可逆膨胀(2)绝热可逆
膨胀 到具有相同压力的终态,终态体积分别为 V1 和 V2,则
A:V1>V2
B:V1<V2
D:小于任何一纯组分的蒸汽压
(11、10)在α、β 两相中都含有 A 和 B 两种物质,达到平衡时,下列正确的是
A:������A������ = ������B������
B:������A������ = ������������������
C:������A������ = ������B������
大功的 20 % ,则体系的熵变为:
A:∆S=5 Q/T
B:∆S=Q/T
C:∆S=Q/5 T
D:∆S=﹣Q体系经过自发过程并在该条件下达到平衡,则
体系的吉布斯自由能 G 值:
A:达最大
B:达最小
C:不能确定
D:不变
(12)dU=TdS﹣PdV 适用条件是
C:K p < K c
(11、10、09、08、07)关系式:PVγ=常数 只适合于
D:K p = K c
A:理想气体的可逆过程
B:理想气体的绝热过程
C:理想气体的可逆绝热过程
D:任何气体的绝热过程
(13、12、11、10、09)1mol 理想气体经历绝热可逆过程,下列几种功的计算中,哪种是错误
的
������T V
������T T
(13)热力学第一定律说明,封闭体系的
C: (������U) = 0
������P T
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a− = γ − b− b \
平均离子活度 平均离子活度因子 平均离子质量摩尔浓度
1
a±
=
(aν++
aν − −
)ν
1
γ±
=
(γ
ν+ +
γ
ν− −
)ν
1
b±
=
(b+ν +
bν − −
)ν
a± = γ ± b± b \
当b → 0时 γ± →1
(6)德拜—休克尔极限公式 (Debye-Hückel Limiting Law)
Λ∞ m
ν = Λ∞ + m,+
+ν −Λ∞m,−
同时
t
∞ +
=
ν
Λ∞
+ m,+
Λ∞
m
t
∞ −
ν∞ = Λ − m,−
Λ∞
m
④电导测定的应用
Λ∞ m,+
=
z
+
u
∞ +
F
Λ∞ m, −
=
z−
u
∞ −
F
a. 计算弱电解质的解离度及解离平衡常数。 b. 计算难溶盐的溶解度和溶度积。 c. 计算液体中所含杂质的浓度。
太原理工大学物理化学
电化学
电化学是研究电能和化学能相互转换规律的科学,通过学习本章,应当了解和掌握以下的基 本概念和基本原理,并能熟练地进行电化学的各种计算。 一、 内容提要
1、 电解质溶液(electrolyte solution) (1) 电解质溶液的导电机理(mechanism of conduction in electrolyte solution)
E = − RT ln p2 2F p1
当p1 > p2时
对负离子可逆的电极浓差电池
E>0
Pt Cl2 (g, p1 ) Cl − (a) Cl2 (g, p2 ) Pt
电池反应 Cl2 ( p2 ) = Cl2 ( p1)
E = − RT ln p1 2F p2
当p1 < p2时
E>0
②电解质浓差电池(电极相同,电解质溶液浓度不同)
t+
=
I+ I+ + I−
= Q+ Q+ + Q−
= υ+ υ+ +υ−
= u+ u+ + u−
t−
=
I− I+ + I−
= Q− Q+ + Q−
= υ− υ+ +υ−
= u− u+ + u−
u:电迁移率,电场强度为 1V·m-1时离子的运动速率,单位:m2·V-1·s-1
测定迁移数的实验方法有希托夫法和界面移动法,在希托夫法中,我们要对阴极区或阳极区的
由于有电流通过电极,使电极电势偏离平衡电极电势,产生超电势η。根据极化产生的原因,
将极化分为浓差极化和电化学极化。阳极极化将使电极电势变得更正,阴极极化将使电极电势变得 更负。
6 太原理工大学物理化学
太原理工大学物理化学
阳极:η阳=E阳-E阳,平 阴极:η阴=E阴,平-E阴
从能量上讲,电极极化对原电池和电解池都是不利的。 (3)电解时的电极反应 阴极反应:若电解液中含有多种金属离子,电极电势高的离子,越易获得电子而优先还原成金 属。 阳极反应:电极电势越低的离子,越易在阳极上放出电子而氧化,此时要虑电极也可能参与阳极反 应。
某离子进行物料衡算,并利用以下公式计算迁移数。
阳离子迁出阳极区的物质的量 t+ = 发生电极反应的物质的量
阴离子迁出阴极区的物质的量 t− = 发生电极反应的物质的量
注意,分子、分母应选取元电荷为标准或选取同一物质的变化的物质的量为标准。
(4)电导(electrical conduction)
① 电导
7 太原理工大学物理化学
再写出正极反应 AgCl(s) + e- → Ag(s) + Cl-
所以原电池可写为 Ag(s) Ag + MMCl − AgCl(s) Ag(s)
3、电解与极化(electrolysis and polarization) (1) 分解电压
在电解池中进行电解操作时,使电解质在两个电极上连续不断地进行分解时所需的最小外 加电压,即为分解电压。 分解电压大于相应原电池的电动势,这是由于极化的原因。 (2)极化作用
Λm=κ/c
单位:S·m2·mol-1
②Λm与c的关系
Λ m = Λ∞m − A c
(稀强电解质溶液)
Λ∞ :电解质无限稀释时的摩尔电导率。 m
③柯尔劳施离子独立运动定律 在无限稀释溶液中,离子彼此独立运动,互不影响,无限稀释电解质的摩尔电导率等于无限稀
释时阴离子、阳离子的摩尔电导率之和。
电解质
Cν + Aν − → ν +C z+ +ν − Az−
电解质溶液的导电是由溶液中的离子作定向迁移运动和电极上发生氧化还原反应共同完成的。 (2)法拉第定律(Faraday's law)
对于一个电极反应 氧化态+ze- = 还原态 通过电极的电量正比于电极反应的反应进度与电极反应电荷数的乘积。即:Q=zF ξ
z:电极反应的电荷数 ξ :反应进度
F:法拉第常数 F=Le=96485C·mol-1 (3) 离子的迁移数(transference number) 当溶液中只有一种阳离子和一种阴离子时
电导是描述导体的导电能力 G = 1 单位:S R
1 太原理工大学物理化学
太原理工大学物理化学
电导率 κ = G ⋅ l
As
单位:S·m-1
电导池常数
K cell =
l As
对于电解质溶液,电导率为相距单位长度、单位面积的两平行板电极间充满电解质溶液时的电
导。
摩尔电导率是电解质溶液的电导率与其浓度之比。
对于反应 0 = ∑ν B B B
3 太原理工大学物理化学
太原理工大学物理化学
∏ E=E\ − RT ln
zF
B
aν B B
——能斯特方程
其中E\ = RT ln K \ zF
K\ 为电池反应的标准平衡常数。
(4)电极(electrode)
电极可分为三类电极:第一类电极,第二类电极,氧化还原电极。
由离子氛模型,结合其它方面的知识,得出
lgγ i
=
−
Az
2 i
I
lgγ ± = − Az+ z− I
(稀溶液)
对于 25℃的水溶液
A
=
0.509(mol
−1
⋅
kg
)
1 2
∑ 其中离子强度 I = 1
2
bB
z
2 B
若求算混合电解质溶液中某电解质的平均活度因子,离子强度 I 是所有正、负离子的贡献之和,
=
−
RT F
ln
ap1 2 12
a p1 2 21
(7)设计原电池(designing of the electrochemical cells)
根据提供的化学反应,确定两个电极的电极反应,再书写出电池表示式,这需要一定的
知识积累和经验。
如将反应 AgCl → Ag++Cl-设计成电池
先确定负极反应 Ag(s)→Ag+ + e-
5 太原理工大学物理化学
太原理工大学物理化学
电池反应 Cl − (a1 ) = Cl − (a2 )
E = − RT ln a2 F a1
当a1 > a2 时 E > 0
③浓度不同的相同电池并联形成的浓差电池
Pt H 2 (g, p1 ) HCl(a1 ) AgCl Ag − Ag AgCl HCl(a2 ) H 2 (g, p2 ) Pt
电池反应
1 2
H2
(
p1 )
+
HCl(a2
)
=
1 2
H2
(
p2
)
+
HCl(a1
)
当p1=p2时,电池反应
HCl(a2 ) = HCl(a1 )
E = − RT ln a1 F a2
当a1=a2时,电池反应
1 2
H2(
p1 )
=
1 2
H2(
p2 )
E = − RT ln p2 2F p1
当a1≠a2,p1≠p2时, E
选用什么做盐桥,取决于作为盐桥的电解质的正、负离子的迁移数尽量接近,而且不参加电池反 应,常用的有饱和 KCl 溶液。
对于 1-1 型电解质M+A-
-) M + A− (a±,1 )MM + A− (a±,2 ) (+
E(液接) = (t +
−
t−
)
⋅
RT F
ln
a ± ,1 a ±,2
有液体接界电势的浓差电池,当电极对正离子可逆
E
=
2t +
RT F
ln
a±,1 a±,2
(6)浓差电池(concentration cell)
由浓度不同的同种电极所组成的原电池。可区分为
①电极浓差电池(电极相同,但浓度不同)
对正离子可逆的电极浓差电池
Pt H 2 (g, p1 ) H + (a) H 2 (g, p2 ) Pt
电池反应 H 2 (g, p1 ) = H 2 (g, p2 )
对正离子可逆 Pt H 2 (g, p) H + (a1 )MMH + (a2 ) H 2 (g, p) Pt
