无菌液体制剂
药剂学之液体制剂-灭菌与无菌操作相关知识

灭菌与无菌操作的基础理论概述灭菌与无菌操作是注射剂、输液、滴眼剂等灭菌与无菌制剂用药安全性的重要保证,也是制备这些制剂必不可少的单元操作。
微生物的种类不同、灭菌方法不同,灭菌效果也不同。
细菌的芽孢具有较强的抗热能力,因此灭菌效果,常以杀灭芽孢为准。
在实际生产中,以无菌保证水平(sterility assurance level,SAL)表示,最终无菌产品的微生物存活概率不得高于10-6。
根据各种制剂或生产环境对微生物的要求不同采取不同措施,如灭菌、无菌操作、消毒、防腐等。
灭菌(sterilization)系指用适当的物理或化学等方法杀灭或除去所有致病和非致病微生物、繁殖体和芽孢的手段。
无菌操作(aseptic processing)系指整个操作过程在无菌环境中制备无菌制剂的方法或技术。
无菌(sterility)系指在任一制定物体、介质或环境中,不得存在任何活的微生物。
防腐(antisepsis)系指用物理或化学方法抑制微生物的生长和繁殖的手段,亦称抑菌。
对微生物的生长与繁殖具有抑制作用的物质称抑菌剂或防腐剂。
消毒(disinfection)系指用物理或化学方法杀灭或除去除了细菌芽孢以外的病原微生物的手段。
对病原微生物具有杀灭或除去作用的物质称消毒剂。
药剂学中采取灭菌与无菌技术的主要目的是:杀灭或除去所有微生物繁殖体和芽孢,最大限度地提高药物制剂的安全性,保护制剂的稳定性,保证制剂的临床疗效。
因此,研究、选择有效的灭菌方法,对保证产品质量有着重要意义。
灭菌方法药剂学中将灭菌方法可分为三大类:即物理灭菌法、化学灭菌法、无菌操作法。
1丨物理灭菌法物理灭菌法(physical sterilization)系指利用蛋白质与核酸具有遇热、射线不稳定的特性,采用加热、射线和过滤方法杀灭或除去微生物的技术,亦称物理灭菌技术。
1.1|热灭菌法热灭菌法(heat sterilization)是采用加热的方法,破坏蛋白质与核酸中的氢键,导致蛋白质变性或凝固,核酸破坏,酶失去活性,致使微生物死亡,从而达到灭菌的目的。
无菌制剂名词解释

无菌制剂名词解释什么是无菌制剂?无菌制剂是指通过滤过滤,辐照,化学清洗,高温杀菌等方法处理后,经过验证可以除去或较大限度地减少营养介质中的非定制菌的物质作为药物的一种制剂。
也就是说,无菌制剂是指在不含细菌的情况下使用的制剂。
无菌制剂是一种纯净的制剂,其中没有任何杂质、微生物或细菌。
它们主要用于生产、分离和存储抗生素,也可用于补充营养介质。
无菌制剂由一种或多种特定成分(如蛋白质、酶、营养素)和稳定剂(如二氧化硅粉)组成,这些成分可以通过蒸馏、离心、无菌过滤和高温处理的方式制备而成。
无菌制剂的产品形式多种多样,有悬浮剂、乳液、乳剂和胶囊等等,被用于补充营养介质,生产大规模抗生素和免疫球蛋白等制剂。
无菌制剂在临床诊断和治疗中具有重要作用,它们可以用于治疗细菌性感染、改善免疫功能和改善营养状况。
它们也可以用于治疗慢性疾病,如哮喘,糖尿病,类风湿性关节炎,肝炎和抑郁症等。
无菌制剂主要通过补充必需的营养素和细胞因子来改善生物体的免疫力,使其能够有效地抵抗到达身体的病原体。
无菌制剂的生产过程在现代分子生物学和生物工程中非常重要,这些过程是保证其质量和安全性的关键所在。
一般来说,无菌制剂的生产过程涉及以下步骤:先进行清洗,然后将药物母液和其他成分混合溶解,接着进行灭菌处理,最后将无菌液体或固体放入封闭的容器中。
在药物生产过程中,无菌制剂的生产是必不可少的环节,它提供了一种可靠、安全和有效的制造方式,保证了质量和安全性。
此外,无菌制剂还可以用于医院、药房、诊所和实验室中治疗及诊断疾病,有助于改善患者的健康状态和治疗效果。
总之,无菌制剂具有诸多优势,在医疗和治疗领域中占据重要地位。
它们的生产过程非常复杂,但凭借技术的进步和改进,我们可以生产出质量更高、效果更好的无菌制剂,有助于更好地保护人类健康。
2020版药典制剂通则之眼用制剂

2020版药典制剂通则之眼用制剂眼用制剂系指直接用于眼部发挥治疗作用的无菌制剂。
眼用制剂可分为眼用液体制剂(滴眼剂、洗眼剂、眼内注射溶液等)、眼用半固体制剂(眼膏剂、眼用乳膏剂、眼用凝胶剂等)、眼用固体制剂(眼膜剂、眼丸剂、眼内插入剂等)。
眼用液体制剂也可以固态形式包装,另备溶剂,在临用前配成溶液或混悬液。
滴眼剂系指由原料药物与适宜辅料制成的供滴入眼内的无菌液体制剂。
可分为溶液、混悬液或乳状液。
洗眼剂系指由原料药物制成的无菌澄明水溶液,供冲洗眼部异物或分泌液、中和外来化学物质的眼用液体制剂。
眼内注射溶液系指由原料药物与适宜辅料制成的无菌液体,供眼周围组织(包括球结膜下、筋膜下及球后)或眼内注射(包括前房注射、前房冲洗、玻璃体内注射、玻璃体内灌注等)的无菌眼用液体制剂。
眼膏剂系指由原料药物与适宜基质均匀混合,制成溶液型或混悬型膏状的无菌眼用半固体制剂。
眼用乳膏剂系指由原料药物与适宜基质均匀混合,制成乳膏状的无菌眼用半固体制剂。
眼用凝胶剂系指原料药物与适宜辅料制成的凝胶状无菌眼用半固体制剂。
眼膜剂系指原料药物与高分子聚合物制成的无菌药膜,可置于结膜囊内缓慢释放药物的眼用固体制剂。
眼丸剂系指原料药物与适宜辅料制成的球形、类球形的无菌眼用固体制剂。
眼内插入剂系指原料药物与适宜辅料制成的适当大小和形状、供插入结膜囊内缓慢释放药物的无菌眼用固体制剂。
眼用制剂在生产和贮藏期间应符合下列规定。
一、眼用制剂一般可用溶解、乳化、分散等方法制备。
二、滴眼剂中可加入调节渗透压、pH值、黏度以及增加原料药物溶解度和制剂稳定的辅料,所用辅料不应降低药效或产生局部刺激。
三、除另有规定外,滴眼剂应与泪液等渗。
混悬型滴眼剂的沉降物不应结块或聚集,经振摇应易再分散,并应检查沉降体积比。
除另有规定外,每个容器的装量应不超过10ml。
四、洗眼剂属用量较大的眼用制剂,应尽可能与泪液等渗并具有相近的pH值。
除另有规定外,每个容器的装量应不超过200ml。
液体制剂的制剂流程

液体制剂的制剂流程
液体制剂的制作过程主要包括以下步骤:
1. 原辅料预处理:首先对原料药及辅料进行严格的称量和质量检查,必要时进行粉碎、溶解、过滤等预处理操作。
2. 溶解配制:按照处方比例,将固体药物溶于适宜的溶剂中,或将液体药物混合均匀,确保药物充分溶解或分散。
3. 混合与过滤:将溶解后的药物溶液与其他辅料(如稳定剂、防腐剂等)进行均匀混合,并通过滤器进行除菌过滤,去除杂质颗粒。
4. 调配与pH调整:根据需要调配至合适的浓度,并调节pH值至稳定且适合药物活性与稳定性的范围。
5. 灭菌与灌装:将调配好的溶液在无菌条件下进行灌装,并采用适当的灭菌方法(如热压灭菌、流通蒸汽灭菌等)保证制剂无菌。
6. 包装与质检:灌装后的液体制剂进行密封包装,贴签标识,并进行严格的质量检测,确认各项指标符合药典要求后方可出厂。
无菌液体制剂—粉针剂(药物制剂技术)
注射用冷冻干燥制品
是指将药物制成无菌水溶液,无菌分装后,再通 过冷冻干燥法制成无菌粉末的工艺技术。
适用于:在水中稳定,但加热即失效的药物 例如:酶制剂、血浆、蛋白质等生物制品;难以
干燥的药物。
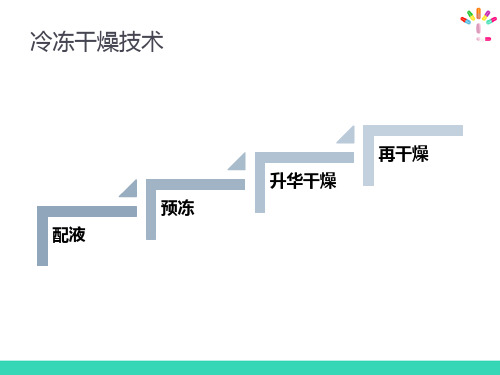
(二)冷冻干燥技术
优点: 1. 不耐热的药物可避免因高热而分解变质; 2. 所得产品质地疏松,加水后迅速溶解; 3. 含水量低,在1%-3%之间; 4. 产生污染的机会相对少; 5. 剂量准确,外观优良。 缺点: 溶剂的选择受限,需要特殊设备,成本较高。
注射用无菌分装制品 注射用冷冻干燥制品 冻干粉针
脑蛋白水解物
重组人促甲状腺素α粉针
双黄连粉针剂
注射用头孢呋辛钠
二、注射用无菌分装制品
将原料用溶剂结晶法或喷雾干燥法精制成无菌粉 末,再无菌分装于容器中制得成品的工艺技术。
药物 无菌 粉末
分装
加塞
压盖
质检
包装
(一)原辅料的质量要求:质量要求高 产品的无菌水平依赖于原辅料的无菌水平。 ① 粉末无异物; ② 细度和结晶适宜; ③ 无菌、无热原。
冷冻干燥设备
(一)冷冻干燥的原理
压力
610.5 Pa 固
液 气
0.01℃
三相平衡点 温度
(二)冻干粉针的制备
1. 药液配制、过滤及灌装 溶解:含有部分有机溶剂的水性溶液 过滤:0.22μm级微孔滤膜 灌注:液面深度为1-2cm 冷冻
(二)冻干粉针的制备
2. 冷冻干燥
首先应检测产品的最低共熔点。 最低共熔点:在水溶液冷却过程中,冰和溶质同时析出
(二)冷冻干燥技术 – (3)再干燥
预冻 压力
升华 再干燥
液 固
气 缓慢恢复室温
常压 负压
无菌液体制剂—滴眼剂(药物制剂技术)

抑菌剂 助悬剂 润湿剂
注意事项
①醋酸氢化可的松微晶的粒径应在5~20μm之间,过粗容易产 生刺激性,降低疗效、损伤角膜;
②本品为混悬型滴眼剂,为防止产品结块,灭菌过程应振摇或 选用旋转式灭菌设备。本品静置后会有细微颗粒下沉,但经振 摇后应为均匀的乳白色混悬液;
③因氯化钠能使羧甲基纤维素钠溶液的黏度显著下降,促使结 块沉降,故处方中改用硼酸,既能克服降低黏度的缺点,又能 减轻药液对眼黏膜的刺激性。
糊状物中再少量分次加入上述溶液研匀。
加注射用水至1000ml,过200~250目筛,在搅拌下分装。
经100℃流通蒸汽30min灭菌。
醋酸氢化可的松滴眼液处方分析
醋酸氢化可的松(微晶) 硼酸
5.0g 20.维素钠 聚山梨酯80 注射用水
0.02g 2.0g 0.8g 加至1000ml
醋酸氢化可的松滴眼液处方
醋酸氢化可的松(微晶) 硼酸 硝酸苯汞 羧甲基纤维素钠 聚山梨酯80 注射用水
5.0g 20.0g 0.02g 2.0g 0.8g 加至1000ml
醋酸氢化可的松滴眼液的制备方法
取硼酸、硝酸苯汞、羧甲基纤维素钠溶于300ml热注射用水 中,过滤后备用。
另取醋酸氢化可的松微晶,置干燥灭菌容器中,加聚山梨酯 80研匀,然后加入少量上述溶液,研成糊状。检查糊状物中 微粒细度,80%以上微粒达5~20μm符合要求。
药物制剂技术 第七章 无菌液体制剂

氯化钠等渗当量法
氯化钠等渗当量:指与1g药物呈等渗效应 的氯化钠的量,一般用E表示
如硼酸的E值0.47,是指——? 低渗溶液调为等渗溶液,需加入等渗调节剂
的量: W=0.009×V-C ×V ×E
C:药物百分浓度 E:药物的氯化钠等渗当量 V:所配溶液的体积
37
例题
配制2%盐酸普鲁卡因注射液150ml,问需 加氯化钠多少克使成等渗溶液?
称量、配制、过滤、灌封、灭菌、质量检 查、包装等 总流程由制水、安瓿前处理、配料及成品 四个部分组成,其中环境区域划分为控制 区与洁净区。
42
(一)安瓿的洗涤
1、安瓿的种类与式样
注射剂容器:有颈安瓿、粉末安瓿、 青霉素小瓶等 国标GB2637-1995规定水针剂使用 的安瓿一律为曲颈易折安瓿。 易折安瓿分为色环易折安瓿和点刻 痕易折安瓿。
27
四、注射剂常用的附加剂
为确保注射剂的安全、有效和稳定性,除主 药和溶剂外还可以加入其他物质,这些物 质即为附加剂
28
(一)增加主药的溶解度
增溶剂
包裹 定向穿插 吸附或氢键
助溶剂
原理
无机化合物 有机酸及其盐
酰胺化合物
注射剂的 增溶剂与 助熔剂的
选择
毒性、臭味、 刺激性
29
(二)防止主药氧化
1.加入抗氧剂、金属螯合剂等 注意:注射剂的给药方法和安全性
24
(二)热原的污染途径
① 注射用水---热原污染的主要来源 ② 原辅料---生物方法制备的药物和辅料 ③ 容器、设备、管道污染---彻底清洗 ④ 制备过程与生产环境---卫生状况差 ⑤ 临床输液器具污染
25
(三)除去热原的方法-器具中热原
(干货)执业中药师中药学专业知识点“外用制剂、无菌制剂、其他制剂、液体制剂、浸出制剂、中药制剂与剂”

(干货)执业中药师中药学专业知识点“外用制剂、无菌制剂、其他制剂、液体制剂、浸出制剂、中药制剂与剂型、眼用液体制剂的附加剂”外用制剂1、油脂性基质的分类为:(1)油脂类,如动、植物油,氢化植物油;(2)类脂类,如羊毛脂、蜂蜡;(4)烃类,如凡士林、石蜡与液状石蜡;(5)硅酮类,如二甲硅油。
2、水溶性基质包括聚乙二醇、纤维素衍生物等。
3、组成与皮脂分泌物相近,可提高软膏中药物的渗透性的基质是羊毛脂。
4、常与凡士林合用,调节凡士林渗透性和吸水性的是羊毛脂。
5、对眼睛有刺激,不宜作为眼膏基质的是二甲硅油。
6、外用膏剂的检查项目有:(1)膏药检查软化点;(2)软膏、乳膏检查黏稠度;(3)橡胶贴膏检查耐热性;(4)凝胶贴膏检查赋形性;(5)贴剂检查释放度。
7、除另有规定外,糊剂应避光密闭贮存;置25℃以下贮存,不得冷冻。
8、除另有规定外,涂剂应避光、密闭贮存。
对热敏感的品种,应在2℃~8℃保存和运输,涂剂在启用后最多可使用4周。
9、涂膜剂应避光、密闭贮存,在启用后最多可使用4周。
无菌制剂1、不宜制成缓释、控释制剂的药物有:(1)单服剂量很大(大于1g)的药物;(2)生物半衰期(t1/2)很短(小于1h)或很长(大于24h)的药物;(3)需在肠道中特定部位主动吸收的药物;(4)药效剧烈、溶解度小、吸收无规律、吸收差或吸收易受影响的药物。
2、骨架型缓释、控释制剂靠扩散、溶蚀或扩散与溶蚀共同作用而释放药物。
3、胃滞留型缓、控释制剂可提高在胃内及十二指肠部位吸收的药物的生物利用度。
4、缓释膜剂为将药物包裹在多聚物薄膜隔室内或溶解分散在多聚物膜片中而制成缓释膜状制剂。
5、渗透泵式控释制剂的释药速度与pH无关,在胃与在小肠释药速度相等。
6、靶向制剂按靶向部位分类为:(1)一级靶向制剂,进入靶部位的毛细血管床释药;(2)二级靶向制剂,进入靶部位的特殊细胞(如肿瘤细胞)释药;(3)三级靶向制剂,作用于细胞内某些特定靶点的靶向制剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
38
例题
配制2%盐酸普鲁卡因注射液150ml,问需 加氯化钠多少克使成等渗溶液?
第七章 无菌液体制剂
1
学习要求
掌握无菌制剂、注射剂的概念、特 点、质量要求 掌握热原性质、污染途径、除去方 法及其检查方法
2
第一节
概 述
3
一、无菌制剂
无菌制剂:指采用无菌操作方法或技术制备
的不含任何活的微生物繁殖体和芽孢的; 或采用物理、化学方法杀灭或除去所有活 的微生物繁殖体和芽孢的一类药物制剂。
78
输液容器
输液瓶以硬质中性玻璃瓶为主
输液瓶的洗涤一般有直接水洗、酸洗和碱
洗等方法。
能否用洗涤剂洗?
79
(三)输液的配制与过滤
可加0.01~0.5%针用活性炭,吸附热原、
杂质和色素
多用浓配法
80
滤过
与小容量注射剂类似
预滤→精滤→终端过滤(三级滤过)
81
(四)输液的灌封
解答:查表知盐酸普鲁卡因的氯化钠等渗 当量为0.18,已知需配制盐酸普鲁卡因注 射液的浓度为2% ,体积为150ml,则需 加入的氯化钠的量为: X= 0.009×150-0.18× 2%×150 = 0.81 (g)
39
(六)其他
1、局部止痛剂
2%苯甲醇
0.5%三氯叔丁醇
2、助悬与乳化
60
热原检查法
② 细菌内毒素检查法
用鲎试剂与细菌内
毒素产生凝集反应
的机理,判断供试品中细菌内毒素的 限量是否符合规定的一种方法
61
62
(四)其他检查项目
无菌检查
装量、装量差异
降压物质的检查
鉴别、含量测定、pH测定、毒性试验、刺 激性试验等
63
七、水针剂的包装
安瓿上印字至少包括品名、批号、规格等,
分类——按分散系统 a. 溶液型注射液 b. 混悬型注射液 c. 乳液型注射液
d. 注射用无菌粉末
14
注射剂的给药途径
① 皮内注射i.d.
② 皮下注射s.c. (i.h.) ③ 肌肉注射i.m. ④ 静脉注射i.v./滴注if.
⑤ 脊椎腔注射it.
⑥ 动脉注射、心内注射、关节注射等
15
上皮 真皮 皮下 组织
第三节 大容量注射剂
67
一、概述
将配制好的药液灌入不小于100ml的输液瓶
或袋内,密封后灭菌制得的注射剂
不含有抑菌剂
68
(一)种类
1. 电解质输液:NaCl注射液
2.
胶体溶液可被迅速补充到血循 环中,由于其渗透压和血液相 营养输液:糖类、氨基酸、脂肪乳 似,不会“漏”到周围组织中, 能保证血容量和血压
低渗:红细胞破裂,溶血
33
34
调节等渗的方法
(1)冰点降低法
冰点相同的稀溶液都具有相等的渗透压
血浆和泪液的冰点均为-0.52℃
35
冰点降低数据法
低渗溶液调整为等渗溶液,需加入等渗调 节剂的量:
W=(0.52-a)/b× V/100
a:药物溶液的冰点降低数 关于a的两点说明:加和;浓度 b: 1%(g/ml)等渗调节液的冰点降低数 V:所配低渗溶液的体积数
47
二、安瓿的干燥灭菌
1、安瓿的干燥灭菌
干燥灭菌:350℃ 5分钟
设备:远红外隧道式烘箱
2、安瓿的存放
净化空气保护
时间<24h
48
三、配液与过滤
(一)原辅料质量要求与投料
原辅料符合国家标准或企业内部质量标准
附加剂和活性炭应用注射规格
投料量按公式计算后,再乘以105%
49
HPMC
卵磷脂、泊洛沙姆188
40
第二节 小容量注射剂
41
概念
小容量注射剂也称为水针剂
装量小于50ml
D
C
A
43
安瓿的洗涤
(一)水针容器
1、安瓿的种类与式样
现在国内易折安瓿强制使用
无色容器,对光敏感药物使用 棕色瓶
44
安瓿的质量要求
(1)质量要求 透明 耐热、物理强度
灭菌注射用水为注射用水按照注射剂生产
工艺制备所得,稀释无菌粉末或浓注射液
28
2、注射用油
a. 大豆油、芝麻油、茶油等,须精制
b. 应无异臭,无酸败味
29
3、其他溶剂
乙醇
甘油
丙二醇
聚乙二醇
30
(二)注射剂的其它附加剂
① 增加主药的溶解度:“注射用”
② 防止主药氧化:抗氧、惰性气体 ③ 抑制微生物生长:大于15ml,不能加抑菌剂 ④ 调节pH:4-9 ⑤ 等渗调节剂
3. 胶体输液(血浆增容剂):右旋糖酐注射
液、羟乙基淀粉注射液(HAES)
4. 含药输液
69
(二)质量要求
a. pH尽量接近人体血液
b. 渗透压 等渗或偏高渗
c. 无菌、无热原要求更严
d. 不溶性微粒检查 e. 无抑菌剂
70
二、输液的制备
(一)生产工艺流程
71
D
C
A
72
(二)输液容器
静脉输液应用于疾病治疗以来,其容器经
历了几代变化
73
第一代-----全开放式
输液容器为广口玻璃瓶
广口玻璃瓶使用时需打开瓶盖倾注液体,
故液体大量暴露与空气中,微生物及微粒
可严重污染液体
已淘汰
74
第二代----半开放式
输液容器为玻璃瓶(或塑料瓶)。
在使用过程中需插入空气针, 建立空气通路,使得输液能 够顺利滴注 包括玻璃瓶、隔离膜、橡胶 塞和铝盖几部分
75
第三代----封闭式
输液容器为全封闭塑料软袋
软袋输液是利用大气压力在袋外
压缩袋体,无需引入外界空气即
可顺利滴注
加药口和输注口分开,防止污染
76
77
返回
第四代--自动输注泵
使用加速通路特征设计程 序,自动计算流速,可使 用1-60ml的全部注射器, 具有间断给药的自动化释 放功能 可用于麻醉科、儿科、重 症监护室和肿瘤科
36
例题:
配制2%盐酸普鲁卡因注射液200ml,需加 多少氯化钠,使成为等渗溶液?
解:查表知1%盐酸普鲁卡因溶液冰点降低 为0.12℃,1%氯化钠溶液冰点降低为0.58 ℃,则需加入的氯化钠的量为: W=(0.52-0.12×2)/0.58×200/100=0.96g
37
氯化钠等渗当量法
2)药液不沾瓶
3)易氧化药物灌封前后通入惰性气体防止氧化
现国内大多采用洗灌封联动机器
拉丝灌封
55
56
五、水针剂的检漏与灭菌
药液从灌封到灭菌(或除菌过滤)的时间
间隔应有规定 :4h 为确保安全,灭菌后的安瓿应进行检漏
57
六、水针剂的质量检查
注射液、注射用无菌粉末、无菌 原料药、滴眼剂
(二)配制用具
性质稳定,耐腐蚀
装有搅拌器的加热配液罐
使用前清洗
50
不锈钢加热型搅拌真空配液罐
51
(三)配液方法(洁净级别不同)
稀配法:将原料加入溶剂一次配成
浓配法:将原料加入部分溶剂中配成浓溶液, 滤除杂质,再稀释到需要的浓度 油性注射液:150℃1-2h→冷却→配制、过滤 (四)半成品检验
84
三、输液生产中存在问题
无菌制剂的分类:据除去活微生物的工艺不同
1、最终灭菌制剂——灭菌制剂
2、非最终灭菌制剂——无菌制剂
4
无菌制剂常见种类★
1、注射制剂 如水针、粉针、输液剂
2、眼用制剂 如滴眼剂、眼膏剂、眼用膜剂
3、植入型制剂 如植入小丸、植入片
4、创面用制剂
气雾剂等
如溃疡、外伤、烧伤用溶液、软膏、 如止血海绵海绵剂、骨蜡
皮下 脂肪 组织
肌肉和静脉
16
三、热
原
PYROGEN
17
热原的定义
热原 指能引起恒温动物体温异常升高的
致热性物质
大多数细菌都能产生热原,致热能力 最强的是G—杆菌所产生的热原,真 菌与病毒也能产生热原
18
热原的组成
热原是能引起动物体温异常升高的物质
总称,是微生物产生的一种内毒素
细菌胞壁上的脂多糖和微量蛋白的复合
熔点较低
化学性质稳定
无气泡、麻点和砂粒
45
(2)安瓿的材质
低硼硅酸盐玻璃:中性 含钡玻璃:耐碱性能好 含锆玻璃:耐酸、耐碱性均好
46
(二)安瓿的洗涤技术与设备
割圆→圆口→洗瓶→干燥灭菌→冷却→存放
(1)汽水喷射洗涤法
气→水→气→水→气 (2)超声波安瓿洗涤 灌满水后经超声波前处理
5、手术用制剂
5
体内植入制剂
返回
6
海绵剂
7
二、注射剂概述★
注射剂 (Injections),指将药物制成的供
注入体内的灭菌溶液、乳剂液或混悬液,
以及供临用前配成溶液或混悬液的无菌
粉末或浓缩液
8
(一)注射剂的特点★
药效迅速、作用可靠
适于不宜口服给药的患者
适于不宜口服的药物,青霉素、胰岛素
物,细菌死亡或解体后才释放出来
一般可认为:热原=内毒素=脂多糖
