2019年上半年浙江省化学联考试卷专题汇编--无机推断
2019年上半年浙江省化学联考试卷专题汇编--无机推断

姓名:__________ 班级:__________一、选择题1.以下情况能说明Cl比S的非金属性强是()①Cl2比S容易与H2化合;②Cl2能从Na2S溶液中置换出S;③HCl酸性比H2S的酸性强;④HCl比H2S稳定⑤Cl2熔沸点比S的低A. ②③⑤B. ③⑤C. ①②④D.①②③④2.如图是中学化学中常见四种物质在一定条件下的转化关系(其他产物已略去)。
根据所学知识,回答下列问题:(1)若B、X都是气体单质,C遇空气变为红棕色气体,A遇湿润的红色石蕊试纸变蓝,A在纯氧气中点燃可生成单质B,则A是____。
写出反应A→C的化学方程式_______(2)若A是地壳中含量第二位的金属单质,X是一种常见最高价易挥发的含氧酸,常温下,发生如图转化关系,则X是____(填化学名称),B是____,写出反应A→C的离子方程式:______;C→B的离子方程式:_______。
3.若将15P原子电子排布式写成1s22s22p63s23p x23p y1,它违背了()A. 能量守恒原理B. 泡利不相容原理C. 能量最低原理D. 洪特规则4.下列关于有机物的说法正确的是()A. 地沟油与矿物油均属于酯类物质B. 疫苗一般应冷藏存放,以避免蛋白质变性C. 直馏汽油、裂化汽油、植物油均能使溴的四氯化碳溶液褪色D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 5.为检验某卤代烃中的X 元素,下列操作:(1)加热煮沸;(2)加入AgNO 3溶液;(3)取少量该卤代烃;(4)加入足量稀硝酸酸化;(5)加入NaOH 溶液;(6)冷却。
正确的操作顺序是 A. (3) (1) (5) (6) (2) (4) B. (3) (5) (1) (6) (4) (2)C. (3) (2) (1) (6) (4) (5)D. (3) (5) (1) (6) (2)(4)6.A N 为阿伏加德罗常数的值。
下列叙述正确的是 A. 34g 22H O 中含有的化学键数目为3A NB. 1mol 2SO 溶于足量水,溶液中23H SO 、3HSO -与23SO -粒子的物质的量之和为A NC. 常温常压下,17g 甲基(143CH -)所含的中子数为11A ND. 22.4L 2Cl 在一定条件下与铁粉完全反应,转移电子数为2A N 7.用N A 表示阿伏伽德罗常数的值。
第28题无机推断题-2023年7月浙江省普通高中学业水平考试化学分题(原卷版)

浙江省普通高中学业水平考试选择题第28题无机推断题【题前知道】常见物质的物理性质(物质的颜色、溶解性、密度等)、化学性质、氧化还原反应、分解反应、物质的检验、物质的量计算、质量守恒定律等知识。
具体考查卤族元素的单质及化合物、钠镁铝单质及化合物、氧硫单质及化合物、铁铜单质及化合物的性质及转变。
考查内容:推导物质的化学式、某一转化过程的化学方程式或离子方程式、某一步在操作时要注意的问题等。
一般要推导的无机物不太常见。
如:K2FeO4,KFeO2,Na2S2O3,S2Cl2,KO2,K2S2O8,CuCl,NaN3,CuH,K2S X(X=16),KI3,FeC2O4,Cu2(OH)2SO4,FeC2O4·2H2O,Na2S2O8等。
解题思路:先审题,阅读题目所给的流程图,找到有用的信息,如物质的颜色、性质等,确定物质是什么,根据已知物质确定要推导物质的组成元素是什么,根据给出物质一般为沉淀如硫酸钡,氧化铜,氧化铁等或气体如NH3、CO2的质量算出物质的量,推导出未知物质的组成元素或原子团的物质的量,再根据质量守恒,计算出各元素或原子团的物质的量,物质的量之比就是物质组成各元素原子或原子团的个数之比,推导出该物质的化学式。
如果求算出原子团或原子个数之比不符合电荷守恒,则所推导的物质中还有其它原子或原子团,如碱性盐还有OH等。
沉淀的颜色是一个重要的信息,可以推导出组成的元素或离子。
常考有颜色的离子或物质有:含Cu2+物质的水溶液或含有结晶水的物质为蓝色。
含Fe2+的水溶液为浅绿色,该溶液能使酸性高锰酸钾溶液或氯水溴水褪色。
Fe3+的水溶液为黄色,与KSCN溶液变血红色溶液,通入SO2气体黄色变浅绿色。
Fe2O3为红色(红棕色固体)。
CuO为黑色固体。
Cu2O为砖红色固体。
FeS2为黄色固体。
BaSO4和AgCl白色沉淀。
【真题回顾】1.(2022年7月浙江学考)盐X为某种矿石的主要成分,仅含四种元素,不含结晶水。
浙江化学学考历年真题分类汇编(无机推断题)

浙江化学学考历年真题分类汇编(无机推断题)16.4.27.(6分)下图中,固体A是铁锈的主要成分。
请回答:(1)白色沉淀E的化学式(2)写出A的化学方程式(3)写出C在溶液中发生氧化还原反应的离子方程式15.7.34(4分)某混合物X由A12O3、Fe2O3和Cu组成。
进行如下实验:步骤I:取5.56 g混合物X,加入过量NaOH溶液,充分反应后,经过滤、洗涤、干燥,称量得3.52 g固体Y。
步骤Ⅱ:向3.52 g固体Y中加入过量稀硫酸,充分反应,形成蓝色溶液,不溶物经过滤、洗涤、干燥,称量得1.28 g固体Z。
请回答下列问题:▲。
(1)固体Z的成分是________▲。
(2)混合物X中n(A12O3):n(Fe2O3):n(Cu)=________15.1.33.(4分)向炭粉、Cu和Fe2O3组成的混合粉末中加入一定量的稀硫酸,充分反应后过滤,得到溶液A,将沉淀物洗涤、干燥,得到固体B。
(1)溶液A中一定存在的金属阳离子是_______________________。
(2)关于固体B的成分,下列选项中可能的有_______________________。
A.炭粉 B.炭粉和Cu C.炭粉和Fe2O3 D.Cu和Fe2O3 E.炭粉、Cu和Fe2O314.7.33.[4分]将有Mg、Al、Cu组成的粉末状混合物按下图所示进行实验。
根据实验流程回答下列问题:(1)固体C是________________。
(2)溶液D中溶质是____________________。
参考答案:16.4.15.7.34 ⑴Cu(或铜) ⑵2︰1︰315.1.33(1)Fe2+、Cu2+ (2)ABCE14.7.33(1)Cu (2)NaAlO2、NaCl、NaOH。
浙江省2019~2020年高中化学非选择题专题汇编(有机推断大题)
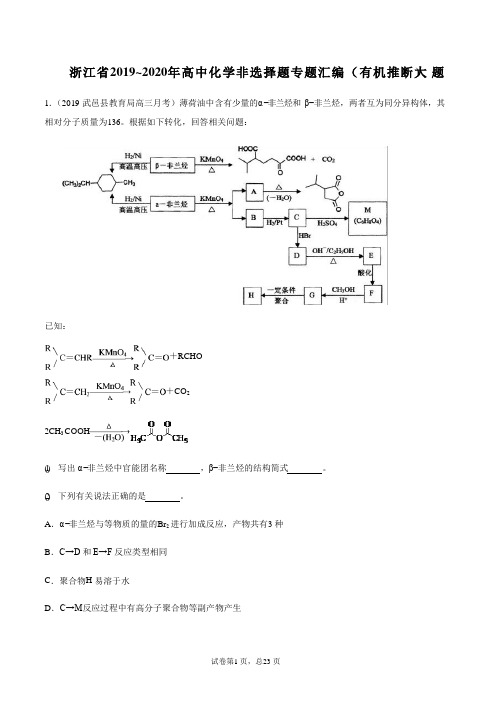
浙江省2019~2020年高中化学非选择题专题汇编( 有机推断大) 题1.(2019·武邑县教育局高三月考)薄荷油中含有少量的α −非兰烃和 β−非兰烃,两者互为同分异构体,其相对分子质量为136。
根据如下转化,回答相关问题:已知:(1) 写出 α −非兰烃中官能团名称,β−非兰烃的结构简式 。
(2) 下列有关说法正确的是。
A .α −非兰烃与等物质的量的Br 2 进行加成反应,产物共有3 种B .C→D 和E→F 反应类型相同C .聚合物H 易溶于水D .C→M 反应过程中有高分子聚合物等副产物产生+RCHO+CO 22CH 3 COOH(3)写出F→G的化学方程式。
(4)写出符合下列条件的A 的同分异构体。
①含有4 个-CH3 ;②1 mol 此同分异构体在碱性条件下水解需2 mol NaOH。
2.(2019·浙江高三)依折麦布是目前唯一的胆固醇吸收抑制剂,合成它的一种重要中间体M 的结构如图所示。
某兴趣小组以甲苯和戊二酸酐为原料,设计了以下合成路线,部分条件和产物已略去。
(5) 以甲苯和丙烯为基本原料合成(用流程图表示,其他无机试剂任选)。
已知:①②③请回答:(1)物质K 的结构简式为。
(2)下列说法正确的是。
A.由甲苯制B 需用Fe 作催化剂B.物质H 水解后产物的最简单同系物为乙酸C.反应①②③ 均为取代反应D.1mol物质K 最多能与2mol NaOH反应(3)写出反应②的化学方程式:。
(4)写出同时符合下列条件的G 的所有同分异构体的结构简式:。
①分子中含有3 个苯环;②能发生银镜反应;③酸性条件下能发生水解反应;④1H−NMR谱显示分子中含有6 种氢原子。
(5) 设计以苯和乙烯为原料制备另一种医药中间体二苯甲酮( ) 的合成路线:。
( 用流程图表示,无机试剂任选) 3.(2018·浙江镇海中学高三)化合物物G是一种用于合成γ- 分泌调节剂的药物中间体,其合成路线流程图如下:请回答:(1) B的结构简式为。
2019年10月浙江省学考选考浙江省五校联考2019学年第一学期五校联考高三年级化学试题

化学试题卷
命题:效实中学
考生须知: 1.本卷满分 100 分,考试时间 90 分钟; 2.答题前,在答题卷指定范围区域填写学校、班级、姓名、试场号、座位号及准考证号; 3.所有答案必须写在答题卷上,写在试卷上无效; 4.考试结束后,只需上交答题卷。 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35. 5 K 39 Ca 40 Cr 52 Fe 56 Cu 64 Ag 108 I 127 Ba 137
溶液中,有 c(Na+)>c(A-)>c(B-)>c(OH-)>c(HB)>c(HA)>c(H+) D. pH 相同的 CH3COONa 溶液、C6H5ONa 溶液、Na2CO3 溶液、NaOH 溶液,其浓度大小关系为:
c(C6H5ONa)>c(CH3COONa)> c(Na2CO3)>c(NaOH)
重金属离子较强的物理吸附 2. 下列对应的离子反应方程式不.正.确.的是
A. 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O===2I2+4OH- B. 硅酸钠溶液与醋酸溶液混合:SiO32-+2CH3COOH===H2SiO3↓+2CH3COO- C. 向 NaHCO3 溶液中加入过量澄清石灰水:2HCO-3 +Ca2++2OH-===CaCO3↓+2H2O D. 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO-3 ===3Ag++NO↑+2H2O 3. 下列有关化学实验说法不.正.确.的是 A.用纸层析法分离 Fe3+和 Cu2+的实验中,展开剂要沿着大试管壁慢慢地注入大试管的底部 B.用 pH 计、电导率仪(一种测量溶液导电能力的仪器)均可检测乙酸乙酯的水解程度 C.邻苯二甲酸氢钾可用于标定 NaOH 溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量
2019年上半年浙江省化学联考试卷专题汇编----化学反应原理

2019年上半年浙江省化学联考试卷专题汇编化学反应原理1、(2019年03月宁波适应)(1)甲醇水蒸气催化重整反应是生产氢气的有效方法之一。
△CH 3OH(g)+H2O(g)CO2(g)+3H2(g)H该反应包括如下两个过程:Ⅰ.甲醇分解:CH 3OH(g)CO(g)+2H2(g)△1HHⅡ.水蒸气变换:CO(g)+H 2O(g)CO2(g)+H2(g)△2P)代替物质的量浓度(B c)也可表示平衡常数(记作对于气相反应,用某组分(B)的平衡压强(BK),甲醇分解与水蒸气变换反应P K随温度变化见下表P反应398K498K598K698K798K898K 甲醇分解0.50185.89939.5 1.8×105 1.6×1069.3×106水蒸气变换1577137.528.149.339 4.180 2.276(1)398K时,CH 3OH(g)+H2O(g)CO2(g)+3H2(g)的P K=。
(2)△H0(填“>”、“=”或“<”)(3)下列关于甲醇水蒸气催化重整反应的理解,正确的是。
A.398K时,水蒸气变换反应的△S等于零B.当温度、压强一定时,在原料气(CH3OH和H2O的比例不变)中添加少量惰性气体,有利于提高催化重整反应的平衡转化率C.提高催化剂的活性和选择性、减少副产物是工艺的关键D.恒温恒容条件下,假设反应Ⅰ的速率大于反应II的速率,说明反应I的活化能更高(4)某研究小组对催化重整反应温度(T)与水醇比(水与甲醇的物质的量之比,用S/M表示)进行优化,得到图(a)、(b)。
①结合图(a)分析温度、水醇比与甲醇的平衡转化率的关系。
②结合图(b)分析,当水醇比一定,随着温度升高,平衡体系中CO含量增大,请分析原因。
③图(c)是将图(a)、图(b)组合形成的平面图,图中实线代表甲醇平衡转化率,虚线代表CO 的物质的量分数。
请在图(c)中用阴影画出最优化的反应条件区域:(二)雾霾中含有大量的污染物NO、CO,其中NO可通过“化学一电解”法进行处理。
2019年4月浙江省普通高校招生选考化学试卷和答案解析
2019年4月浙江省普通高校招生选考化学试卷1. 下列属于碱的是( )A. B. C. D.2. 下列属于强电解质的是( )A. 硫酸钡B. 食盐水C. 二氧化硅D. 醋酸3. 下列图示表示过滤的是( )A. B. C. D.4. 下列属于置换反应的是( )A. B.C. D.5. 下列溶液呈碱性的是( )A. B. C.KCl D.6. 反应,被氧化的与被还原的的物质的量之比为( )A. 2:3B. 8:3C. 6:3D. 3:27. 下列表示不正确的是( )A. 次氯酸的电子式B. 丁烷的球棍模型C. 乙烯的结构简式D. 原子核内有8个中子的碳原子8. 下列说法不正确的是( )A. 液氯可以储存在钢瓶中B. 天然气的主要成分是甲烷的水合物C. 天然石英和水晶的主要成分都是二氧化硅D. 硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等9. 下列说法不正确的是( )A. 蒸馏时可通过加碎瓷片防暴沸B. 可用精密pH试纸区分和的两种溶液C. 用加水后再分液的方法可将苯和四氯化碳分离D. 根据燃烧产生的气昧,可区分棉纤绵和蛋白质纤维10. 下列说法正确的是( )A. 和互为同位素B. 正己烷和2,二甲基丙烷互为同系物C. 和是具有相同质子数的不同核素D. 和是同分异构体11. 针对下列实验现象表述不正确的是( )A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成12. 化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )A. 甲:向Cu电极方向移动,Cu电极附近溶液中浓度增加B. 乙:正极的电极反应式为C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄D. 丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降13. 不能正确表示下列变化的离子方程式是( )A. 二氧化硫与酸性高锰酸钾溶液反应:B. 酸性碘化钾溶液中滴加适量双氧水:C. 硅酸钠溶液和盐酸反应:D. 硫酸铜溶液中加少量的铁粉:14. 2019年是门捷列夫提出元素周期表150周年。
浙江高考化学试题(2019)
【点评】本题考查了常见仪器的构造,明确常见仪器的构造即可解答,试题侧重基础知识的考查,有利于提高学生的化学实验能力。
3.(2019•浙江)下列属于非电解质的是
A.葡萄糖B.氢氧化钠C.氯化钾D.铁
【答案】A
【解析】在水溶液里或熔融状态下都不导电的化合物是非电解质,在水溶液里或熔融状态下能导电的化合物是电解质。A、葡萄糖在水溶液里或熔融状态下以分子存在导致不导电,所以葡萄糖是非电解质,故A正确;B、氢氧化钠是化合物,水溶液中或熔融状态下电离出离子导电,故氢氧化钠是电解质,故B错误;C、氯化钾是化合物,水溶液中或熔融状态下电离出离子导电,所以氯化钾是电解质,故C错误;
A.食盐B.蔗糖C.酒精D.生石灰
【答案】D
【解析】选项中只有生石灰溶于水,放出大量的热,其它溶于水水热效应不明显,以此来解答。A、B、C中物质均溶于水,热效应不明显,但CaO与水反应,放出热量的热,热效应明显。
【考点】反应热和焓变菁优网版权所有
【专题】化学反应中的能量变化
【点评】本题考查反应中能量变化,为高频考点,把握物质的性质、反应中能量变化为解答的关键,侧重分析与应用能力的考查,题目难度不大,注意溶解热与反应中能量变化的区别.
B.氕、氘、氚是质子数相同,中子数不同的同元素的不同原子,三者是氢元素的三种核素,质子数都是1,故B正确;
C.乙醇和二甲醚不属于一类物质,官能团不同,不是同系物,故C错误;
D.分子式为C4H10的烷烃为丁烷,丁烷存在正丁烷和异丁烷两种同分异构体,
正丁烷CH3CH2CH2CH3有2氢原子,所以其一氯代物有2;
【考点】胶体的重要性质菁优网版权所有
【专题】溶液和胶体专题
【点评】本题考查了分散系的分类以及丁达尔效应的特有的性质,应注意丁达尔效应只是胶体的特有性质,但不是其本质特征。
考点28 浙江省高中化学学考专题练习
考点28 浙江省高中化学学考专题练习考点28 定量无机推断1.(浙江202001学考)28.(4分)为了探究某带结晶水的固体X(含四种短周期元素)的组成和性质,设计并完成如下实验:请回答:(1) 白色固体D是________。
(2) 无色溶液E→白色沉淀F的离子方程式是________。
(3) X的化学式是________。
2.(浙江201906学考)28.(4 分)为探究固体化合物X(仅含四种元素)的组成和性质,某同学设计并完成如下实验。
请回答:(1)蓝色溶液中的金属阳离子是。
(2)黑色化合物→砖红色化合物的化学方程式是。
(3)X 的化学式是。
3.(浙江201901学考)28.为了探究某固体化合物X(仅含3种元素,相对分子质量小于200)的组成和性质,设计并完成如下实验,其中X、A、B、C、D均为常见化合物。
请回答:(1)黄色溶液中的金属阳离子是 。
(2)固体A→白色沉淀B 的离子方程式是 。
(3)X 的化学式是 。
4.(浙江201806学考)28.(4分)为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:(1)X 中的非金属元素是________。
(2)黑色化合物高温空气红棕色化合物的化学方程式是______________________________。
(3)设计实验方案检验黄色溶液中的金属阳离子_____________________________________。
5.(浙江201804学考)27.(6分)某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验: 实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取110溶液丙,恰好中和需消耗0.00200 mol NaOH ;另取一定量的溶液丙,加入少量K 2FeO 4固体,产生黄绿色气体。
请回答:(1) X 的化学式是________,步骤①的化学方程式是________。
2019备考化学有机推断真题汇编浙江新高考含答案
浙江2017.11题目:某研究小组按下列路线合成药物胃复安:请回答:(1) __________________________ 化合物A 的结构简式 。
⑵ 下列说法不正确的是 __________ 。
A .化合物B 能发生加成反应B .化合物D 能与FeCb 溶液发生显色反应C .化合物E 具有碱性D .胃复安的分子式是 63H 22CIN 3O 2(3)设计化合物C 经两步反应转变为 D 的合成路线(用流程图表示,试剂任 选) ⑷ 写出D + E -F 的化学方程式 ________ ________________________________(5)写出化合物E 可能的同分异构体的结构简式 ____________ ,须同时符合: ① 1H-NMR 谱表明分子中有 3种氢原子,IR 谱显示有N — H 键存在; N-C-N ② 分子中没有同一个碳上连两个氮 c )的结构结构。
浙江2017.11题目:已知:一」_: 1; RCOOR'RCONHR”某研究小组按下列路线合成药物胃复安:请回答:(2) 化合物A 的结构简式 __________ 。
⑵ 下列说法不正确的是 _________ 。
A .化合物B 能发生加成反应B .化合物D 能与FeCb 溶液发生显色反应C .化合物E 具有碱性D .胃复安的分子式是 C 13H 22CIN 3O 2 (3) 设计化合物C 经两步反应转变为 D 的合成路线(用流程图表示,试剂任选)⑷ 写出D + E -F 的化学方程式 ________ ________________________________(5)写出化合物E 可能的同分异构体的结构简式 ____________ ,须同时符合: ① 1H-NMR 谱表明分子中有 3种氢原子,IR 谱显示有N — H 键存在;W-N② 分子中没有同一个碳上连两个氮 (一)的结构结构。
浙江2017.11答案:B;RCOOR'RCONHR”CHiOHOH (1BD⑶⑷COOCH 3OH (C——COOCH 3OCH 3ClClCOOCH 3OCH 3NHCOCH 3NHCOCH 3 COOCH 3OCH 3+ HzNCHCHN(CHCH) 2NHCOCH 3ClNHCOCH 3CONHCH 2CH 2N(CH 2CH 3)2OCH 3Cl+ CHOHNHCOCH 3(CH3) 2CH- NH- NH- CH(CH) 2(CH3) 3C- NH- N(CH B)2HzN-/ CH(CH)2I CH(CH)2浙江2017.11归纳与总结:日期:耗时:浙江20仃.4题目:某研究小组按下列路线合成镇痛药哌替啶:L C 8H 7N JRX + H —卡―CN ————仝 R —卡―CN 请回答: (1) A —B 的反应类型是(2) 下列说法不正确的是A .化合物A 的官能团是硝基B .化合物B 可发生消去反应r1 ASOCl 2rI.C5H 13NO 2」〔C 5H 11NCI 2 丿NaNH 21 ----- 1,F .-.E,已知:RX —-—^ RCN^―0^ RCOOHCCH 3NH 2O1— H2OH +O哌替啶C .化合物E能发生加成反应D .哌替啶的分子式是C15H21NO2(3)_________________________________ 写出B + C-D的化学反应方程式________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019年上半年浙江省化学联考试卷专题汇编无机推断题1、(1903宁波适应)某同学用固体X(四种元素组成的纯净物)进行了如下实验:请回答:(1)X的化学式是。
(2)步骤①的化学方程式是。
(3)一定条件下,往溶液丙中加入H2O2,观察到溶液黄色褪去,并产生无色无味的气体,写出该反应的离子方程式。
2、(1902超级全能生)已知化合物X是由四种元素组成的无色液体,溶于水产生两种强酸;其蒸气密度是相同条件下氢气的58.25倍。
某学习小组进行了如下实验:①取0.10molX,加入到含0.15molBa(OH)2的溶液中恰好中和,同时得到23.3g不溶于盐酸的白色沉淀。
②上述中和后的溶液与过量的AgNO3溶液反应,得到14.35g不溶于硝酸的白色沉淀和溶液Y,经检验,溶液Y中只含有两种溶质。
请回答:(1)仅根据实验中产生的两种白色沉淀可知,X中必定含有的两种元素是(用元素符合表示)。
(2)①中X与Ba(OH)2溶液反应的化学方程式是。
(3)由X中原子序数较大的两种元素组成的A2B2型化合物,与水反应生成使品红褪色的无色气体、淡黄色沉淀以及一种常见强酸,写出该反应的化学方程式:。
3、(1902温州适应)为探究某盐X(仅含四种元素,其摩尔质量小于300g·mol-1)设计并完成如下实验:已知:气体A为单质,标准状况下的密度为1.25g·L-1。
请回答:(1)盐X的组成元素为H、O和(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式。
(3)写出盐X隔绝空气加热分解的化学方程式。
4、(1903稽阳联考)石油铁储罐久置未清洗易引发火灾,经初步分析研究,事故由罐体内附着的氧化物甲与溶于石油中的气体乙(乙在标准状况下的密度为1.52g·L-1)反应生成的黑色物质丙自燃引起。
为进一步探究黑色物质丙的成分,某学习小组取一定量的丙进行了如下实验:请回答:(1)乙的结构式为。
(2)写出丙与足量盐酸反应的离子方程式。
(3)请设计实验证明不同温度对丙与盐酸的化学反应速率的快慢。
5、(1903嘉丽二模)已知化合物X由4种元素组成,某学习小组进行了如下实验:已知:步骤②中消耗KI 0.15mol请回答:(1)X的化学式是,黄色溶液乙与SO2反应的离子方程式是。
(2)X中一种元素对应的单质,与足量的K2CO3溶液反应得到的产物中含溶液甲中溶质,写出该反应的化学方程式:。
6、(1903绍兴适应)某学生对固体A(两种元素组成的纯净物)进行了如下实验。
已知C 在医疗上可以用作检查肠胃的内服药剂,不易被X射线透过。
请回答:(1)固体A的化学式是,步骤③的参加反应离子方程式是(足量KMnO4)。
(2)写出步骤④的化学反应方程式。
7、(1903十校联盟)固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:(1)X中金属元素的名称是。
(2)化合物X与足量盐酸反应离子方程式。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式。
8、(1903台州选考)某同学为探究浅黄色液体X (仅含三种常见元素)的组成和性质,设计并完成如下实验:混合气体AX气体体积相当于标况下0.448 L浅黄色液体X过量O2中燃烧加热至103℃红色固体A气体B足量澄清石灰水白色沉淀BKSCN(aq)足量盐酸黄色溶液C3.92 g1.60 g血红色溶液D10.0 g请回答如下问题:(1) X的化学式是。
(2) X在过量氧气中燃烧的化学方程式是。
(3)溶液C滴在淀粉KI试纸上,试纸显蓝色,写出该变化中发生的离子方程式。
9、(1809“G12”返校考)化合物X(只含两种短周期元素)是一种重要的还原剂。
某同学取X做了如下实验:请回答:(1)X的电子式是(2)写出X与水反应的化学方程式。
(3)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式。
10、(1902“Z20”联盟)为探究不含结晶水的白色正盐X(仅含三种元素)的组成和性质,设计并完成如下实验:已知:M(X)=270g·mol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰。
请回答:(1)无色液体B的化学式是。
(2)固体X加热分解的化学方程式是。
(3)将X加入MnSO4溶液中,溶液变成紫红色,该反应的离子方程式为。
11、(1901杭州高三检测)将2.84g化合物A的粉末(含两种元素)投入足量水中剧烈反应后微热至无气泡现象,标准状况下共收集到0.672L能使带火星木条复燃的气体B,同时得到溶液C(溶液C中只含三种元素);所得C溶液能被含0.04molHCl的盐酸溶液恰好中和,取中和后溶液进行焰色反应火焰显浅紫色(隔蓝色钴玻璃观察)。
试回答:(1)A的化学式是。
(2)A的粉末与水反应的离子方程式为。
(3)某些特殊场合下A可用作供氧剂,供氧过程中呼吸面具里有酸式盐生成,写出相关反应的化学方程式。
12、(1902金丽衢二次联考)为探究不含结晶水盐A(仅含三种元素)组成和性质,设计并完成如下实验:①取少量A,加水,A由白色变为蓝色,加热蓝色又变成白色:②另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,C能使盐酸酸化的BaCl2溶液产生白色沉淀。
B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO2溶于水(1)A组成元素是_____(用元素符号表示)(2)B的化学式是_________(3)B与水反应的化学方程式是___________13、(1903金丽衢三次联考)某化合物M(仅含三种短周期元素)是一种储氢材料。
为探究M的组成和性质,设计并完成如下实验:已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是(用元素符号表示)。
(2)化合物A与水反应的化学方程式是。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是。
14、(1902名校协作返校考)化合物A由两种元素组成,两元素质量比为3:16,能发生如下反应:产物B、C的物质的量之比为1:1,D、E均为气体,D能使湿润的红色石蕊试纸变蓝,E中含有18个电子。
回答下列问题:(1)写出B的化学式;(2)过量C加入到FeCl3溶液反应的离子方程式;(3)A与足量氨水反应的化学方程式。
15、(1902宁波“十校联考”)已知化合物X由三种短周期元素组成,学习小组设计了如下实验,其中单质A是黄绿色气体,化合物X的焰色反应为黄色。
请回答:(1)化合物X的化学式;(2)X在酸性条件下生成A的离子方程式是▲ ;(3)已知酸性:H2CO3>HClO>HCO3-,气体A与Na2CO3溶液反应(反应物物质的量之比为1:1)的化学方程式是。
16、(1901浙南名校联盟期末)为探究无机盐X(仅含两种元素,相对分子质量为206)的组成和性质,设计并完成如下实验(步骤中所加试剂均足量):已知气体A在标准状况下的密度约为1.52g·L-1。
请回答下列问题:(1)写出X中含有的元素:。
(2)X与足量盐酸反应的化学方程式为。
(3)X溶液在强碱性条件下可与过量次氯酸钠溶液反应生成两种盐,写出该反应的离子方程式。
2019年上半年浙江省化学联考试卷专题汇编无机推断题参考答案1、(1)Fe(OH)2Cl 或FeCl 3・2Fe(OH)3(2)Fe(OH)22O 3 + 2HC1 + H 2O(3)2Fe 3+ + H 2O 2 = 2Fe 2+ + O 2↑ + 2H + 2、(1)S 、Cl(2)2HSO 3Cl + 3Ba(OH)2 = 2BaSO 4↓ + BaCl 2 + 4H 2O (3)2S 2Cl 2 + 2H 2O= SO 2↑ + 3S↓ + 4HC1 3、(1)N 、Fe(2)Fe 2O 3 + 6H + + 2I - = 2Fe 2+ + I 2 + 3H 2O(3)2(NH 4)2FeO 4 2O 3 + 2NH 3↑ + N 2↑ + 5H 2O↑4、(1)H-S-H(2)Fe 3S 4 + 6H + = 3Fe 2+ + S↓ + 3H 2S ↑(3)将盛有等浓度、等体积的盐酸的两个反应容器置于不同温度的水浴中,加入等量的Fe 3S 4,观察黑色物质消失的快慢5、(1) KIO 3•2HIO 3 I 2 + SO 2 + 2H 2O = 2I - + SO 42- + 4H +(2) I 2 + 6K 2CO 3 + 3H 2O = KIO 3 + 5KI + 6KHCO 36、(1)BaO 5H 2O 2 + 2MnO 4- + 6H + = 2Mn + + 5O 2↑ + 8H 2O(2)BaSO 4 + 2C BaS + 2CO 2 或 BaSO 4 + 4CBaS + 4CO7、(1)镁、钙(2)3MgSiO 3•CaSiO 3 + 8H + =4H 2SiO 3 + 3Mg 2+ + Ca 2+ (盐也可写成CaO •3MgO •4SiO 2)(3)2Mg + SiO 2Si + 2MgO8、(1)Fe(CO)5或FeC 5O 5(2)4Fe(CO)5+13O 2====== 点燃2Fe 2O 3+20CO 2 (3)2Fe 3++2I -=2Fe 2++I 29、(1)Na+[:H]- (2)NaH+H2O=NaOH+H2 (3)3NaH+Fe2O3=2Fe+3NaOH10、(1)SO3(2)2K2S2O82K2SO4 + 2SO3 + O2 (3)5S2O82- + 2Mn2+ + 8H2O =2MnO4- + 10SO42- + 16H+11、(1)KO2(2)4KO2 + 2H2O = 4K+ + 4OH- + 3O2↑ (3)4KO2 + 4CO2 + 2H2O2KHCO3 + 3O2↑12、(1)Cu、S、O (2分)(写出两种元素给1分,全对2分)(2)Cu2OSO4(2分)(写成Cu2SO5或CuO•CuSO4给1 分)(3)3Cu2OSO4 + 4H2O =3Cu(OH)2•CuSO4 •H2O + 2CuSO4或3Cu2OSO4 + 3H2O =3Cu(OH)2•CuSO4 + 2CuSO4或3Cu2OSO4 + 3H2O =Cu4(OH)6•CuSO4 + 2CuSO4(2分)(未配平或配平错误给1分)13、(1)Mg、N、H (写出两种给1分,全对给2分)(2)Mg3N2 + 6H2O 3Mg(OH)2↓+ 2NH3↑ (2 分)(3)Mg+2NH3Mg(NH2)2 +H2↑ (2 分)14、(1)NH4SCN (2)3S2- + Fe3+ = 2FeS↓ + S ↓ (3)4NH3 + CS2 = NH4SCN + (NH4)2S (或4NH3•H2O + CS2 = NH4SCN + (NH4)2S + 4H2O也可以)15、(1)2NaCl•NaClO(Na3Cl3O)(2)ClO- + 2H+ + Cl- = Cl2↑ + H2O (2 分,配平错扣1 分)(3)Cl2 + Na2CO3 + H2O = NaCl + NaHCO3 + HClO16、(1)Na 、S (或写元素名称钠、硫也给分)(2)Na2S5 + 2HCl = 2NaCl + 4S↓ + H2S↑(3)S52+ + 16ClO- + 8OH- = 16Cl- + 5SO42- + 4H2O。
