武大三版无机化学下习题答案
武汉大学版无机化学课后习题答案(第三版)第09章 化学反应的速率

化学反应的速率1. 什么是化学反应的平均速率,瞬时速率?两种反应速率之间有何区别与联系?答:平均速率是指在时间间隔Δt 内,反应物或生成物浓度的变化量。
而瞬时速率是指某一时刻的反应速率;前者是一个平均概念,相对于一个时间段而言,而后者是一个瞬时概念,是相对于某一时刻而言。
2. 分别用反应物浓度和生成物浓度的变化表示下列各反应的平均速率和瞬时速率,并表示出用不同物质浓度变化所示的反应速率之间的关系。
这种关系对平均速率和瞬时速率是否均适用?(1) N 2 + 3H 2 → 2NH 3(2) 2SO 2 + O 2 →2SO 3(3) aA + Bb → gG + hH解 (1)V =tN △△][2= t H △△][2=t NH △△][3 V 瞬=0lim →t △t N △△][2 = 0lim →t △t H △△][2 =0lim →t △t NH △△][3 V 2N =31V 2H =21V 3NH 两种速率均适用。
(2)(3)同(1)。
3. 简述反应速率的碰撞理论的理论要点。
答:碰撞理论认为:(1)、反应物分子之间的相互碰撞是反应进行的先决条件,碰撞频率越高,反应速率越大。
(2)、碰撞中能发生反应的一组分子首先必须具备足够的能量,以克服分子无限接近时,电子云之间的斥力,从而导致分子中原子的重排,即发生化学反应。
(3)、能量是有效碰撞的一个必要条件,但不充分,只有当活化分子组中的各个分子采取合适的取向进行碰撞时,反应才能发生。
(4)、活化能:发生有效碰撞的最低能量。
4. 简述反应速率的过渡状态理论的理论要点。
答:过渡状态理论认为:(1)、当两个具有足够的平均能量的反应物分子相互接近时,分子中的化学键要经过重排,能量要重新分配。
在反应过程中,要经过中间的一个过渡状态,即反应物分子要先形成活化配合物。
(2)。
反应速率与下列三个因素有关:活化配合物的浓度,活化配合物分解的几率,活化配合物的分解速率。
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(硼组元素)【圣才出品】

第16章硼组元素一、选择题1.下列酸中属于一元酸的是()。
【答案】A【解析】H3BO3在水中电离的方程式为:H3BO3+H2O =B(OH)4-+H+,而B(OH)4-不再电离,所以H3BO3为一元酸。
2.硼酸的分子式常写成H3BO3,它是()。
A.二元弱酸B.一元弱酸C.三元弱酸D.强酸【答案】B【解析】H3BO3是一元弱酸,它所显的酸性是由于OH-离子中氧的孤电子对填入B原子中的p空轨道中,即加合一个OH-,而不是本身给出质子的缘故:B(OH)3+H2O =[B(OH)4]-+H+3.()不是CO的等电子体。
A.NO B.NO+C.N2D.CN一【答案】A【解析】等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。
4.下列化合物不属子缺电子化合物的是( )。
A .BCl 3 B .HBF 4 C .B 2H 6D .Al (OH )3 【答案】B【解析】缺电子化合物是由价电子数少于价层轨道的缺电子原子形成的化合物。
A 项和D 项是由缺电子原子与多电子原子化合物形成的配键化合物;C 项为缺电子原子与等电子原子化合形成的缺电子分子。
5.在硼砂珠试验中,硼砂与氧化钴(Ⅱ)产生的颜色是( )。
A .蓝色 B .棕色 C .黑色 D .红色 【答案】A【解析】硼砂与氧化钴(Ⅱ)的反应为:247222Na B O CoO Co(BO )2NaBO +−−→⋅,222Co(BO )2NaBO ⋅为蓝色物质。
6.某硼氢合物(B x H y 与过量的水反应,得到30.9mg 硼酸和30.26mL 干燥氢气(在22℃,730mmHg 柱),该硼氢化物的实验式为(B 的原子量为10.811)( )。
【答案】C【解析】B x H y + H 2O → H 3BO 3 + H 2,由n (H 3BO 3) = 0.0005 mol ,n (H 2)= 0.0012 mol 得n (H 3BO 3):n (H 2) = 5:12。
武汉大学、吉林大学《无机化学》(第3版)(下册)配套题库【章节题库】-第14~16章【圣才出品】

15.将 NCl3 通入 NaOH 溶液,得到的产物是( )。 A.NH3 和 NaCl B.NH3 和 NaClO C.NO2 和 NaCl D.NH4Cl
2.在
溶液中加入
溶液后主要产物是( )。
【答案】C 【解析】因为磷酸银不溶于水,也不溶于硝酸,反应向正反应方向移动,溶液成酸性。 反应方程式为:NaH2PO4+3AgNO3=Ag3PO4↓+2HNO3+NaNO3。
3.硝酸盐热分解可以得到单质的是( )。
【答案】A 【解析】AgNO3 热分解的反应方程式为 2AgNO3→2Ag+2NO2+O2↑
9.硝酸钠的氧化性表现较强的状态是( )。 A.在酸性溶液中 B.在碱性溶液中 C.在高温熔融状态 D.与所处的状态无关 【答案】A 【解析】酸性状态下,溶液中有 H+,硝硝酸根本身氧化性不强,有 H+存在形成硝酸, 硝酸具有强氧化性。
10.下列酸中是一元酸的是( )。 A.H4P2O7 B.H3PO4 C.H3PO3 D.H3PO2 【答案】D
12.对于 H2O2 和 N2H4,下列叙述中正确的是( )。 A.都是二元弱酸 B.都是二元弱碱 C.都具有氧化性和还原性 D.都可做氧化剂 【答案】C 【解析】H2O2 为二元弱酸,而 N2H4 为二元弱碱。两者均既有氧化性又有还原性。但 N2H4 作为氧化剂时反应速率极慢而没有实际意义。
13.下列路易斯碱中,碱性最强的是( )。 (A)NH2-
7.下列化合物中肯定不存在的是( )。 A.NCl5 B.POCl3 C.BN D.SiF4 【答案】A
武大吉大第三版无机化学教材课后习题答案

第十二章1.卤素中哪些元素最开朗?为何有氟至氯开朗性变化有一个突变?答:单质的开朗性序次为:F2>>Cl 2>Br 2>I 2—从 F2到 Cl 2开朗性突变,其原由归纳为 F 原子和 F 离子的半径特别小。
r/pmF Cl Br I F64 99 114 133 136181—Cl —195216Br—I—(1)因为 F 的原子半径特别小,F—F原子间的斥力和非键电子对的斥力较大,使解离能( 155KJ/mol )远小于Cl 2的解离能( 240KJ/mol )。
F2的(2)因为 F-离子半径特别小,所以在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
因为 F-离子半径特别小,F-的水合放热比其余卤素离子多。
2.举例说明卤素单质氧化性和卤离子X-复原性递变规律,并说明原由。
答:氧化性次序为:F2> Cl 2 >Br2>I 2; 复原性次序为:I ->Br- >Cl - >F- .只管在同族中氯的电子亲合能最高,但最强的氧化剂倒是氟卤素单质是很强的氧化剂, 跟着原子半径的增大, 卤素的氧化能力挨次减弱。
只管在同族中氯的电子亲合能最高, 但最强的氧化剂倒是氟。
一种氧化剂在常温下, 在水溶液中氧化能力的强弱 , 可用其标准电极电势值来表示,值的大小和以下过程相关(见课本P524)3.写出氯气与钛、铝、氢、水和碳酸钾作用的反响式,并注明必需的反响条件。
答:( 1) 2Cl 2+Ti =TiCl4( 2) 3Cl 2+2Al =2AlCl3( 3) Cl 2+H2 =2HCl( 4) 3Cl 2+2P(过度 )=2PCl 35Cl 2( 过度 )+2P=2PCl 5加热,干燥加热,干燥点燃干燥干燥(5) Cl 2+H2O=HClO +HCl(6)Cl 2+2KCO3+H2O=KCl+KClO+2KHCO34.试解说以下现象:( 1)I 2溶解在 CCl4中获取紫色溶液,而I 2在乙醚中倒是红棕色。
武汉大学版无机化学课后习题答案(第三版)第13章配位化学原理

武汉大学版无机化学课后习题答案(第三版)第13章配位化学原理配位化学基础1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3亦不产生沉淀,以强碱处理并没有NH3放出,写出它的配位化学式。
解[Pt(NH3)2Cl4]2.下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?(1)CuSO4·5H2O (2)K2PtCl6(3)Co(NH3)6Cl3(4)Ni(en)2Cl2(5)(NH4)2SO4·FeSO4·6H2O (6)Cu(NH2CH2COO)2(7)Cu(OOCCH3)2(8)KCl·MgCl2·6H2O解配合物:K2PtCl6, Co(NH3)6Cl3, CuSO4·5H2O螯合物:Ni(en)2Cl2, Cu(NH2CH2COO)2复盐:(NH4)2SO4·FeSO4·6H2O KCl·MgCl2·6H2O简单盐:Cu(OOCH3)23.命名下列各配合物和配离子:(1)(NH4)3[SbCl6] (2)Li[AlH4](3)[Co(en)3]Cl3(4)[Co(H2O)4Cl2]Cl(5)[Cr(H2O)4Br2]Br·2H2O (6)[Cr(H2O)(en)(C2O4)(OH)(7)Co(NO2)6]3-(8)[Co(NH3)4(NO2)C]+(9)[Cr(Py)2(H2O)Cl3] (10)[Ni(NH3)2(C2O4)] 解(1)六氯合锑(III)酸铵(2)四氢合铝(III)酸锂(3)三氯化三(乙二胺)合钴(III)(4)氯化二氯·四水合钴(III)(5)二水合溴化二溴·四水合钴(III)(6)羟·水·草酸根·乙二胺合铬(III)(7)六硝基合钴(III)配阴离子(8)氯·硝基·四氨合钴(III)配阳离子(9)三氯·水·二吡啶合铬(III)(10)二氨·草酸根合镍(II)4.指出下列配合物的空间构型并画出它们可能存在的立体异构体:(1)[Pt(NH3)2(NO2)Cl] (2)Pt(Py)(NH3)ClBr](3)Pt(NH3)2(OH)2Cl2] (4)NH4[Co(NH3)2(NO2)4] (5)[Co(NH3)3(OH)3] (6)[Ni(NH3)2Cl2] (7)[Cr(en)2(SCN)2]SCN (8)[Co(en)3]Cl3(9)[Co(NH3)(en)Cl3] (10)[Co(en)2(NO2)2]Cl2解(1)[Pt(NH3)2(NO2)Cl] 平面正方形2种异构体H3N NO2H3N NO2Pt PtH3N Cl H3N Cl(2)[Pt(Py)(NH3)ClBr] 平面正方形3种异构体Cl Py Cl NH3Pt PtBr NH3 Br PyCl NH3PtPy Br(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体NH3NH3HOCl OH HO 3 NH3OH NH3OH3Cl NH3HO NH3OH Cl(4)[Co(NH3)2(NO2)4]-八面体2种异构体NH3NH3O2O2NO2N 2O2N 2NH3NO2(5)[Co(NH3)3(OH)3] 八面体2种异构体H3NH3N H3N NH3NH3 OH(6)[Ni(NH3)2Cl2] 四面体无异构体(7)[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体2种异构体SCNNCSSCN en(8)[Co(en)3]Cl3[Co(en)3]3+八面体2种异构体(9)[Co(NH3)(en)Cl3] 八面体2种异构体(10)[Co(en)2(NO2)2]Cl2[Co(en)2(NO2)2]2+八面体2种异构体5.某金属离子在八面体弱场中的磁距为4.90B.M。
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(氧族元素)【圣才出品】
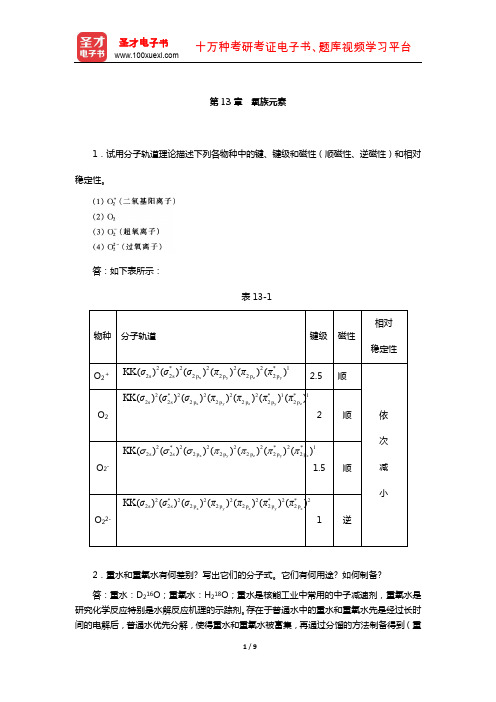
第13章氧族元素1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
答:如下表所示:表13-12.重水和重氧水有何差别? 写出它们的分子式。
它们有何用途? 如何制备?答:重水:D216O;重氧水:H218O;重水是核能工业中常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
存在于普通水中的重水和重氧水先是经过长时间的电解后,普通水优先分解,使得重水和重氧水被富集,再通过分馏的方法制备得到(重水和重氧水的沸点都高于普通水)。
3.解释为什么O 2分子具有顺磁性,O 3具有反磁性?答:O 2的分子轨道式为:2*2222*1*12222222()()()()()()()x y z y z s s p p p p p KK σσσππππ,可见O 2分子中有2个单电子,因而具有顺磁性。
O 3分子中没有单电子,只存在大π键43Π,因而具有反磁性。
4.在实验室怎样制备O 3? 它有什么重要性?答:在实验室里制备臭氧主要靠紫外光(<185 nm )照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,臭氧的含量可达10%,反应方程式为:3O 2=2O 3(放电条件下)。
O 3是大气层中主要的吸收紫外线的物质,使人类避免受到紫外线照射的伤害。
5.油画放置久后为什么会发暗、发黑? 为什么可用H 2O 2来处理? 写出反应方程式。
答:油画放置久后会变黑,发暗,原因是油画中的白色颜料中含有PbSO 4,遇到空气中的H 2S 生成黑色的PbS 造成的,反应方程式为:PbSO 4 +H 2S = PbS (黑)+ H 2SO 4。
用H 2O 2处理又重新变白,是因为发生以下反应:2242PbS 4H O PbSO 4H O +=+。
6.比较氧族元素和卤族元素氢化物在酸性、还原性、热稳定性方面的递变规律。
答:氧族元素的氢化物有H 2O ,H 2S ,H 2Se 和H 2T e 。
武大吉大第三版无机化学教材课后习题答案

1.什么叫稀溶液的依数性?试用分子运动论说明分子的几种依数性?答2.利用溶液的依数性设计一个测定溶质分子量的方法。
答3.溶液与化合物有什么不同?溶液与普通混合物又有什么不同?答4.试述溶质、溶剂、溶液、稀溶液、浓溶液、不饱和溶液、饱和溶液、过饱和溶液的含意。
答为溶质。
体系叫溶液。
5.什么叫做溶液的浓度?浓度和溶解度有什么区别和联系?固体溶解在液体中的浓度有哪些表示方法?比较各种浓度表示方法在实际使用中的优缺点。
答6.如何绘制溶解度曲线?比较KNO3、NaCl和NaSO4的溶解度曲线,说明为什么着三条曲线的变化趋势(及斜率)不一样?答以溶解度为纵坐标,以温度为横坐标所做出的溶解度随温度变化的曲线叫做溶解度曲线。
KNO3溶解度随温度升高而增大;NaCl溶解度随温度升高几乎不变; NaSO4溶解度随温度升高而减小。
7.为什么NaOH溶解于水时,所得的碱液是热的,而NH4NO3溶解与水时,所得溶液是冷的?答8.把相同质量的葡萄糖和甘油分别溶于100g水中,问所得溶液的沸点、凝固点、蒸汽压和渗透压相同否?为什么?如果把相同物质的量的葡萄糖和甘油溶于100g水中,结果又怎样?说明之。
答9.回答下列问题:(a)提高水的沸点可采用什么方法?(b)为什么海水鱼不能生活在淡水中?(c)气体压强和溶液渗透压有何差别?(d)为什么临床常用质量分数为%生理食盐水和用质量分数为5%葡萄糖溶液作输液?(e)为什么浮在海面上的冰山其中含盐极少?(f)试述亨利(Henry)定律和拉乌尔(Raoult)定律的适用范围是。
答(a)增大水的蒸气压;(b)因为渗透压不同;(c) =CRT稀溶液的渗透压与溶液的浓度和温度的关系同理想气体方程式一致。
(d)在一定条件下,难挥发非电解质稀溶液的渗透压与溶液中溶质的浓度成正比,而与溶质的本性无(e)非极性或弱极性的固态物质溶于弱极性溶剂而难溶于强极性溶剂。
(f)亨利(Henry)定律的适用范围是中等强度;拉乌尔(Raoult)定律的适用范围是任何强度。
(完整word版)武汉大学版无机化学课后习题答案(第三版)第08章 原电池和氧化还原反应习题(wor

原电池和氧化还原反应1. 用离子电子法配平下列反应式:(1) PbO 2+ Cl - −→−Pb +2+ Cl 2 (酸性介质) (2) Br 2 −→−BrO -3+Br - (酸性介质) (3) HgS+2NO -3+Cl -−→−HgCl -24+2NO 2 (碱性介质) (4) CrO -24+HSnO -2 −→−HSnO -3+CrO -2 (碱性介质) (5) CuS +CN -+OH - −→−Cu(CN)-34+NCO -+S (碱性介质)解:(1)PbO 2+2Cl -+4H +=Pb 2++Cl 2+2H 2O(2)3Br 2+3H 2O=BrO 3-+5Br -+6H +(3)HgS+2NO 3-+4Cl -+4H +=HgCl 42-+2NO 2+S+2H 2O(4)2CrO 42-+3HSnO 2-+H 2O=2CrO 2-+3HSnO 3-+2OH -(5)2CuS +9CN -+2OH - =2Cu(CN)-34+NCO -+2S -2+H 2O2. 用离子电子法配平下列电极反应: (1)MnO -4−→−MnO 2 (碱性介质) (2)CrO -24−→−Cr(OH)3 (碱性介质) (3)H 2O 2−→−H 2O (酸性介质) (4)H 3AsO 4−→−H 3AsO 3 (酸性介质) (5)O 2−→−H 2O 2(aq) (酸性介质) 解:(1)MnO 4-+2H 2O+3e -=MnO 2+4OH -(2)CrO 42-+4H 2O+3e -=Cr(OH)3+5OH -(3)H 2O 2+2e -=2OH -(4)H 3AsO 4+2H ++2e -=H 3AsO 3+H 2O(5)O 2+2H ++2e -=H 2O 23. 现有下列物质:KMnO 4, K 2Cr 2O 7, CuCl 2, FeCl 2, I 2, Br 2, Cl 2, F 2在一定条件下它们都能作为氧化剂,试根据电极电势表,把这些物质按氧化本领的大小排列成顺序,并写出它们在酸性介质中的还原产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十三章氧族元素
第十五章碳族元素
碱金属和碱土金属
第十九章配位化合物
无机化学(武汉大学等校编第三版)教材习题第二十一章过渡元素
(II)
无机化学(武
汉大学等校编
第十六章硼族元素第三版)教材
习题
例3:分析癸硼烷-14(B10H14)分子成键的情况
(1) 价轨道数:4×10 + 1×14 = 54
10B 14H
(2) 价电子数:3×10 + 1×14 = 44
10B 14H
10个 B-H 2c-2e: 2e×10 = 20e
4个 B-H-B 2c-2e: 2e×4 = 8e
4个 3c-2e: 2e×4 = 8e
2个 B-B-B 2c-2e:2e×2 = 4e
2个 B-B 2c-2e:2e×2 = 4e
合计有44个价电子,成键轨道22个,反键轨道22个。
无机化学(武汉大学等校编第三版)教材习题第十八章铜族和锌族
金属
无机化学(武汉大学等校编 第三版)教材习题 第二十章 过渡元素(I)。
