高中化学无机推断题带答案
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1.(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
请填写下列空白:(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为。
反应⑦属于。
A.吸热反应B.放热反应C.置换反应D.氧化还原反应(3)反应⑩的离子方程式为。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。
该反应的化学方程式是:。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为。
【答案】(1)B SO3 E Fe(OH)3;(2) Fe2O3+ 2Al Al2O3+2Fe 。
反应⑦属于BCD 。
(3) 3Fe+2NO3-+8H+ = 3Fe2++2NO↑+4H2O 。
(4) Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
(5) FeS2。
【解析】(1)甲矿石是FeS2,矿石煅烧得到A:SO2和D:Fe2O3;SO2与O2发生反应得到B:SO3,SO3与水作用得到C:硫酸;I是Al,Al与Fe2O3发生铝热反应:Fe2O3+ 2Al Al2O3+2Fe,得到的G的Fe;H是Al2O3。
E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。
(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。
因此选项是B、C、D。
第28题无机推断题-2023年7月浙江省普通高中学业水平考试化学分题(原卷版)

浙江省普通高中学业水平考试选择题第28题无机推断题【题前知道】常见物质的物理性质(物质的颜色、溶解性、密度等)、化学性质、氧化还原反应、分解反应、物质的检验、物质的量计算、质量守恒定律等知识。
具体考查卤族元素的单质及化合物、钠镁铝单质及化合物、氧硫单质及化合物、铁铜单质及化合物的性质及转变。
考查内容:推导物质的化学式、某一转化过程的化学方程式或离子方程式、某一步在操作时要注意的问题等。
一般要推导的无机物不太常见。
如:K2FeO4,KFeO2,Na2S2O3,S2Cl2,KO2,K2S2O8,CuCl,NaN3,CuH,K2S X(X=16),KI3,FeC2O4,Cu2(OH)2SO4,FeC2O4·2H2O,Na2S2O8等。
解题思路:先审题,阅读题目所给的流程图,找到有用的信息,如物质的颜色、性质等,确定物质是什么,根据已知物质确定要推导物质的组成元素是什么,根据给出物质一般为沉淀如硫酸钡,氧化铜,氧化铁等或气体如NH3、CO2的质量算出物质的量,推导出未知物质的组成元素或原子团的物质的量,再根据质量守恒,计算出各元素或原子团的物质的量,物质的量之比就是物质组成各元素原子或原子团的个数之比,推导出该物质的化学式。
如果求算出原子团或原子个数之比不符合电荷守恒,则所推导的物质中还有其它原子或原子团,如碱性盐还有OH等。
沉淀的颜色是一个重要的信息,可以推导出组成的元素或离子。
常考有颜色的离子或物质有:含Cu2+物质的水溶液或含有结晶水的物质为蓝色。
含Fe2+的水溶液为浅绿色,该溶液能使酸性高锰酸钾溶液或氯水溴水褪色。
Fe3+的水溶液为黄色,与KSCN溶液变血红色溶液,通入SO2气体黄色变浅绿色。
Fe2O3为红色(红棕色固体)。
CuO为黑色固体。
Cu2O为砖红色固体。
FeS2为黄色固体。
BaSO4和AgCl白色沉淀。
【真题回顾】1.(2022年7月浙江学考)盐X为某种矿石的主要成分,仅含四种元素,不含结晶水。
高中化学无机推断题带答案
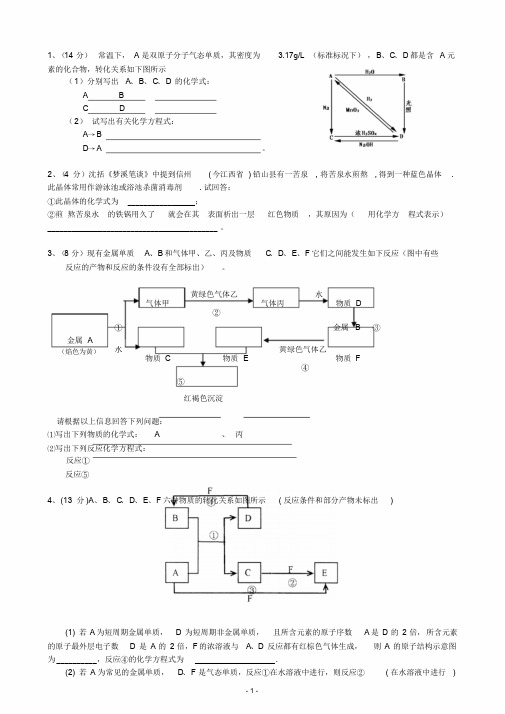
1、(14 分)常温下, A 是双原子分子气态单质,其密度为 3.17g/L (标准标况下),B、C、D 都是含 A 元素的化合物,转化关系如下图所示(1)分别写出A、B、C、D的化学式:A BC D(2)试写出有关化学方程式:A→BD→A 。
2、(4 分)沈括《梦溪笔谈》中提到信州(今江西省) 铅山县有一苦泉, 将苦泉水煎熬, 得到一种蓝色晶体. 此晶体常用作游泳池或浴池杀菌消毒剂. 试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________ 。
3、(8 分)现有金属单质A、B 和气体甲、乙、丙及物质C、D、E、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙水气体甲气体丙物质 D②①金属 B ③金属 A(焰色为黄)水黄绿色气体乙物质 C 物质 E 物质 F④⑤红褐色沉淀请根据以上信息回答下列问题:⑴写出下列物质的化学式: A 、丙⑵写出下列反应化学方程式:反应①反应⑤4、(13 分)A、B、C、D、E、F 六种物质的转化关系如图所示( 反应条件和部分产物未标出)(1) 若A 为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数 A 是D的2 倍,所含元素的原子最外层电子数D是A的2 倍,F 的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________.(2) 若A 为常见的金属单质,D、F 是气态单质,反应①在水溶液中进行,则反应②( 在水溶液中进行)- 1 -的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________ .(3) 若A、D、F 都是短周期非金属元素单质,且A、D所含元素同主族,A、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5. (10 分)短周期常见元素形成的纯净物A、B、C、D、E 的转化关系如下图所示,物质 A 与物质 B 之间的反应不在溶液中进行( E 可.能.与A、B两种物质中的某种相同)。
[实用参考]高中化学无机推断题带答案.doc
![[实用参考]高中化学无机推断题带答案.doc](https://img.taocdn.com/s3/m/cfa3aa29561252d380eb6e88.png)
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式: A B C D(2) 试写出有关化学方程式:A →BD →A 。
2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些⑴写出下列物质的化学式:A 、 丙⑵写出下列反应化学方程式:反应①反应⑤4、(13分)A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________.(3)若A 、D 、F 都是短周期非金属元素单质,且A 、D 所含元素同主族,A 、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5.(10分)短周期常见元素形成的纯净物A 、B 、C 、D 、E 的转化关系如下图所示,物质A 与物质B 之间的反应不在溶液中进行(E 可能..与A 、B 两种物质中的某种相同)。
高考化学无机推断题大汇总

高考化学无机推断题大汇总高考化学无机推断题大汇总高考化学中,无机推断题是一种常见的题型。
在这类题目中,考生需要根据所给的实验现象和化学知识进行推断和判断,从而确定物质的性质、反应方式或溶液中所含物质的种类。
下面是一些常见的无机推断题,供考生参考。
1. 实验室中有一个无色溶液,加入酸性钾高锰酸钾溶液后,溶液的颜色变为粉红色。
这时,我们可以推断原来溶液中是铁离子、铬离子还是锰离子?答案:由于酸性高锰酸钾溶液与铁离子和铬离子无反应,而与锰离子反应生成棕黑色固体,所以可以推断原来溶液中是铁离子。
2. 实验室中有一个无色气体X,能让红色石蕊试纸变蓝和黄色湿润性试纸变红,加入氢氧化钠溶液后溶液变浑浊,并生成一种白色固体Y。
这时,我们可以推断气体X是氯气、二氧化硫还是二氧化氮?答案:气体X能让红色石蕊试纸变蓝和黄色湿润性试纸变红,这表明它具有酸性。
而气体X与氢氧化钠反应生成白色固体Y,所以可以推断气体X是二氧化硫。
3. 实验室中有一个无色固体,热解后生成红色气体,与盐酸反应产生氯气。
这时,我们可以推断无色固体是碘化钠、碘化铅还是碘化汞?答案:无色固体热解后生成红色气体,说明它本身含有硫元素。
而与盐酸反应产生氯气,可以推断无色固体是碘化铅。
4. 实验室中有一个无色气体,不可燃,无味,能使湿润性试纸变红,能与二氧化锰反应生成紫红色物质。
这时,我们可以推断无色气体是氢气、氮气还是氧气?答案:无色气体能使湿润性试纸变红,表明它具有酸性。
而与二氧化锰反应生成紫红色物质,可以推断无色气体是氮气。
5. 实验室中有一种无色溶液,与氯气反应生成浑浊物。
这时,我们可以推断无色溶液是盐酸溶液、硫酸溶液还是硝酸溶液?答案:无色溶液与氯气反应生成浑浊物,这表明无色溶液中有一种物质具有还原性,所以可以推断无色溶液是硫酸溶液。
以上只是一些常见的高考化学无机推断题,希望对考生有所帮助。
在解答无机推断题时,需要考生熟练掌握化学常识和实验现象,构建正确的推理链条,准确推断出物质的性质和反应方式。
高中化学总复习 20无机推断之元素周期表型练习

无机推断 元素周期表(律)1. (10分)(2007海南·13)下表为元素周期表的一部分,请回答有关问题:(1)⑤和⑧的元素符号是 ______ 和 ______ ;(2)表中最活泼的金属是 ______ ,非金属最强的元素是 ______ ;(填写元素符号)(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:, ;(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:。
2. (8分)(08年海南化学·14)根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有_____________________________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是____________________。
(4)第三周期中,原子半径最大的是(稀有气体除外)______________。
(5)推测Si 、N 最简单氢化物的稳定性_________大于_________(填化学式)。
3. (09年福建理综·23)(15分)班级 姓名 座号 装 订 线短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:(1)T的原子结构示意图为 ____________ 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。
(5)R有多种氧化物,其中甲的相对分子质量最小。
在一定条件下,2L的甲气体与0.5L 的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是。
高中化学无机推断题带答案

。
(3) 反应④的化学方程式为:
。
(4) 写出离子方程式分别为:反应②
;
反应⑤
。
(5) 反应①中,每 1.00g C 与足量的 F 作用,恢复到 25℃放出 55.6kJ 热量,写出反应①的热化学方程
式。
。
7、下图是由短周期元素组成的物质之间的转化关系。其中,
A 的相对分子质量为 144,反应①中生成 C、D
物质的量之比为 3 : 1, D 是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,
F、 G 是气态
非金属单质, K 是一种常见的非极性有机溶剂,密度比水大。 (某些生成物和反应条件已略去)
-2-
H 2O A
①
电解 B溶液 ②
F
C
③
K
D
H
E
④
F
I
G
⑤
H
J
D
⑥
⑦
( 1) A 的化学式是
;
( 2) E 中金属阳离子的检验方法
14.( 8 分)已知 A 为常见金属, X、 Y 为常见非金属, X、E、 F、 G常温下为气体, C为液体, B 是一种盐,
受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)
。现用 A 与石墨作电极, B 的浓溶
液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物
10.16g 固体
12、( 10 分)有下列物质之间的相互转化
D
红棕色气体 O2
NaOH E
O 2、△
B
F
A
催化剂
金属
刺激性
C
气体
无色液体
高二化学无机推断试题答案及解析

高二化学无机推断试题答案及解析1.下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。
常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B 是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。
(1)H的化学式为。
(2)F的电子式为。
(3)反应①的化学方程式为。
(4)反应②的离子方程式为。
【答案】(1)NaClO(1分)(2)HCl的电子式(略)(1分)(3)2NaCl+2H2O2NaOH+Cl2↑+H2↑(2分)(4)Fe3++3OH-=Fe(OH)3↓(2分)【解析】A、B、C、D、E、F、G、H、I、G、J分别为NaCl、H2O、NaOH、Cl2、H2、HCl、NaClO、FeCl3、FeCl2、Fe(OH)3。
(3)反应①为电解饱和食盐水,产生NaOH、Cl2、H2;(4)反应②为铁盐与碱反应生成氢氧化铁沉淀。
【考点】考查物质的转化有关问题。
2.A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。
F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。
这些物质之间满足如下图所示的转化关系,图中部分生成物已略去。
(1)写出下列物质的化学式:A______,F______。
(2)B的电子式是______。
根据图中信息,B、C、X的氧化性由强到弱的顺序是_ _____(用化学式表示)。
(3)反应⑥的离子方程式是__ ____。
(4)在反应⑥中,F表现的性质是___ ____,当生成0.75mol C时,被氧化的还原剂的物质的量是___ ____。
【答案】(1)SO2 HCl(各1分)(2);MnO2>Cl2>H2O2(各1分)(3)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)(4)还原性、酸性(2分) 1.5 mol(2分)【解析】化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式:A B C D (2) 试写出有关化学方程式:A →B D →A 。
2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙 水 ②① 金属 水 黄绿色气体乙 ④ ⑤金属气体气体物质D 物质C 物质E 物质F 红褐色沉请根据以上信息回答下列问题:⑴写出下列物质的化学式:A 、丙⑵写出下列反应化学方程式:反应①反应⑤4、(13分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________.(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,B固体属于__________晶体.5.(10分)短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能..与A、B两种物质中的某种相同)。
请回答下列问题:(1)若C是离子化合物,D是一种强碱,写出C的化学式。
(2)若C与水发生复分解反应,E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。
②用等式表示E与NaOH溶液反应生成的正盐溶液中所有离子..浓度之间的关系______________________________________________________。
(3)若C是一种气体,D是一种强酸。
①C与水反应的化学方程式_________________________。
②有人认为“浓H2SO4可以干燥气体C”。
某同学为了验证该观点是否正确,用右图装置进行实验。
实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是__________________________________________________________________ ________。
6、已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性。
反应生成的水均已略去。
它们有如下图所示的关系。
(1)写出化学式:A.,B.,C.。
(2)反应③中每生成lmolF,转移电子的数目为:。
(3)反应④的化学方程式为:。
(4)写出离子方程式分别为:反应反应⑤ 。
(5)反应①中,每1.00g C 与足量的F 作用,恢复到25℃放出55.6kJ 热量,写出反应①的热化学方程式。
。
7、下图是由短周期元素组成的物质之间的转化关系。
其中,A 的相对分子质量为144,反应①中生成C 、D 物质的量之比为3 :1,D 是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,F 、G 是气态非金属单质,K 是一种常见的非极性有机溶剂,密度比水大。
(某些生成物和反应条件已略去)(1)A 的化学式是 ;(2)E 中金属阳离子的检验方法 ; (3)写出反应②的化学方程式 ; (4)写出反应⑦的离子方程式:⑦ ; (5)用离子方程式表示H溶液显碱性的原8.(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答:(1)写出C的电子式,I的化学式;(2)反应③的化学方程式为;(3)反应④的离子方程式为;(4)由C制取E时反应物的状态是,由J制取L时反应的环境是。
9.(10分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。
化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。
C、D、G、I、J、K为气体,其中C、K的温室效应均显着,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。
B为一种白色固体,其化学式可表示为X3Y6M6,E的化学式可表示为X3M4。
请按要求回答下列问题:式分别(3)化合物E是一种新型无机材料,它的一种结构(β- X3M4)具有可与金刚石相媲美的硬度。
请推测该材料可能用途之一是。
10.A是一种重要的矿石,B—I均是中学化学常见物质,其中D、H为气体。
J是有两种元素形成的化合物,它是一种良好的耐热冲击材料,抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料,它还是电绝缘体。
它们在一定条件下有如下转化关系(某些反应产物和反应条件已略去),其中反应①一④是某工业流程的重要组成部分:试回答下列问题:(1)写出反应②和⑤的离子方程式:②_______________________________________,⑤_______________________________________;(2)操作I和操作Ⅱ的实验名称分别是______ ___和___________;(3)H气体在后续反应中必须是干燥的,干燥H气体时所选择的干燥剂可以是________(4)J的化学式为____________,其晶体中存在的化学键类型有共价键和________(5)有人说在反应⑤中选择(NH4)2CO3比NH4HCO3更好,其理由是_____________ ______________________________________________。
11.(10分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的(为(2)反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
(3)若向100 mL 盐X 的溶液中加入10 g 金属单质M 的粉末,充分搅拌后,过滤,烘干得10.16g 固体C 。
则滤液A 中溶质的物质的量浓度为________________________。
(假设体积不变) 12、(10分)有下列物质之间的相互转化已知E 是具有还原性的含氧酸钠盐,回答下列问题(方程式中的物质用对应的元素符号或化学式表示) ⑴写出A 和O 2反应生成B 和C 的方程式: 。
⑵Na 2FO 2和Na 2F 2O 4均为易溶于水的盐。
Na 2FO 2溶于过量的新制氯水后形成黄色溶液,向该溶液中滴入KSCN 溶液出现血红色。
分别写出反应②以及Na 2FO 2溶于过量氯水的离子方程式:、 。
⑶事实上,金属F 放置于一定浓度NaOH 和E 混合溶液中一段时间,发生反应①、②,生成的Na 2FO 2和Na 2F 2O 4能发生可逆反应,在F 表面生成一层致密的氧化物保护层。
试写出Na 2FO 2和Na 2F 2O 4相互反应生成保护层的化学反应方程式为: 。
⑷为防止金属F 的腐蚀,将F 制品放置于一定浓度NaOH 和E 混合溶液中时,NaOH 的浓度不宜(填“太小”或“太大”)。
13.(12分)A ~N 均为中学化学中的常见物质,其中A 是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M 是目前使用量最大的金属,常温下B 、E 、F 为气体,G 为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
回答下列问题:⑴H的化学式为_____________,D的电子式为_________________________;⑵B和N的离子反应方程式为_______________________________________________;⑶D与G反应的离子方程式为_______________________________________________;⑷G与M反应的化学方程式为_______________________________________________;⑸I可用于净化水,其原因是14.(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。
现用A与石墨作电极,B的浓溶液作电解质,构成原电池。
有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)Array请填写下列空白:(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为_____(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为。
(4)反应⑤的化学方程式为。
答案1. (1)A Cl2 B HClO C NaCl D HCl(2)A→B Cl2 +H2O HClO+ HClD→A MnO2+4HCl (浓)MnCl2+Cl2↑+2H2O2、(1)①CuSO4·5H2O,②Fe + CuSO4 = FeSO4 + Cu3、(1)Na HCl (2)2Na + 2H2O = 2NaOH + H2↑ FeCl3 + 3NaOH ==Fe(OH)3↓+ 3NaCl+12 2 8 24.(10分)⑴ (1分) C+4HNO3(浓)△ CO2↑+4NO2↑+2H2O (2分)⑵2Fe2++Cl22Fe3++2Cl-(2分)H2(g )+Cl2 (g)2HCl(g);△H=-184.6kJ·mol-1 (2分)高温 2CO↑+Si (2分) 原子(1分)⑶2C+SiO2════5.(10分,每空2分)(1)Na2O2(2分)(2)① H++H2O+AlO2- Al(OH)3 Al3++3OH-(2分)② c(Na+)+c(H+) = 2c(S2-)+c(HS-)+c(OH-) (2分)(3)①3NO2+H2O = 2HNO3+NO (2分)②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2(2分)6、(1)Al4C3;Na2O2;CH4(2)1.204×1024(3)4NH3+5O2 4NO+6H2O(4)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-);Al(OH)3+3H+=Al3++3H2O(5)CH4(g)+2O2(g)CO2(g)+2H2O(l);△H=-889.6kJ·mol-17、(1)Al4C3(2)取试样,进行焰色反应,若火焰显黄色,说明有Na+存在。
