5.6 分子轨道的对称性和反应机理
结构化学-6

第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
(4)离域能 △E= E小-E大 E大=2E1+2E2
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法 2.环状化合物(苯)
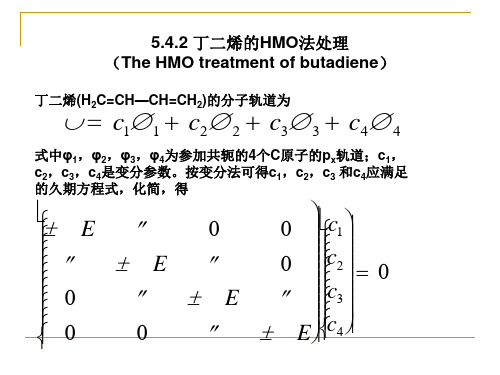
(1)久期行列式
(2)波函数和能级
第一节 休克尔分子轨道法
共振能判断: 定义为π电子总能量 与参考结构总能量之差: RE = E π- ER
第四节 共轭分子其它性质
E π——π电子的总能量 ER——E π中的定域部分 RE——离域部分 RE>0,为芳香性 RE ≈0 为非芳香性 RE<0,为反芳香性
第四节 共轭分子其它性质
第四节 共轭分子其它性质
第四节 共轭分子其它性质
石墨的离域 π键
在石墨中,碳原子排列成层 状结构,在一个平面层片上碳原 子排列成正六角形,碳原子就分 布在各六角环的顶点上,彼此间 的距离是143pm。由许多这样的 相互平行的层片构成。相邻两层 间的距离是335pm 。
第二节 大键形成条件和共轭效应
对每个碳原子来说,原子轨道sp2杂化后, 它的四个电子只有三个与它在同一平面层内的 另外三个碳原子形成共价键(σ键), 剩余一个轨道和一个电子形成大π键。在 层与层之间,由于距离较远,它们不是以化学 键联结,而是以较弱的分子间引力相联结。
Sij = 1 (当i = j)
Sij = 0 (当 i ≠ j)
第一节 休克尔分子轨道法
(2)4个 π 电子进入两个成键轨道, 比原单个p轨道能量低,更加稳定:
-1.62β
-0.62β α
0.62β 1.62β
第一节 休克尔分子轨道法
分子轨道对称守恒原理

分子轨道对称守恒原理小资料:守恒原理的诞生。
分子轨道对称守恒原理认为:化学反应是分子轨道进行重新组合的过程,在一个协同反应中,分子轨道的对称性是守恒的,即反应物的分子轨道具有什么样的对称性,产物的分子轨道也应具有什么样的对称性,从原料到产物,分子轨道的对称性始终不变。
因为只有这样,才能用最低的能量形成反应中的过渡态。
因此,分子过渡的对称性控制着整个反应的进程。
能级相关理论:这种方法考虑了所有参与反应的分子轨道,强调了各分子轨道的对称性的分类,建立了反应物分子和产物分子轨道的能级之间相互转化的关系,分析协同反应进行的方式和条件,并且把能转化的能源(包括热能还是光能)定性地加以说明。
能级相关的方法及其应用:(1)画出反应物和产物分子的有关分子轨道,并按能级排列。
(2)选择一个适当的对称元素对反应物和产物分子的分子轨道进行分类,标上轨道的对称类型,而这个对称元素必须在整个反应过程中始终保持有效。
丁二烯顺旋环化反应只有C2轴始终保持有效,而其对旋环化反应,只有m1面才始终保持有效。
(3)用相关线将反应物和产物的分子轨道连接起来。
相连时,必须遵循2条原则:(a)对称守恒原则,即反应物和产物的分子轨道对称性要一致。
只能SS或AA相连,不能SA或AS相连,同时相连的分子轨道的能量要尽可能相近。
只有这样才符合分子轨道对称性守恒原理。
(b)不相交原则,是指对称性相同的两条相关线不能相互交叉。
即两条SS线或AA线不能相交,但SS连线和AA连线可以相交。
这一原则是根据量子力学原理确定的。
对称允许和对称禁阻:丁二烯加热顺旋环化的协同反应,在基态时,反应就可以进行,这种反应称为对称允许反应,反之,加热对旋环化反应,则称为对称禁阻反应。
这里的"允许"和"禁阻"只表示一个协同反应进程的难易程度。
结构化学第五章2
化学反应的可能性和限度由化学势决定,反应沿化学势降 低的方向进行,直至化学势相等,达到平衡状态。
化学反应的速度决定于活化能的高低:活化能高,反应不 易进行,反应速度慢;活化能低,反应容易进行,反应速度快 。在反应时,若正反应是基元反应,则逆反应也是基元反应, 且经过同一活化体,此即微观可逆原理。
5.6.2前线轨道理论
4 3
4 3
4 3
6 4
6 4
2 3
18 19
注意:上述条件也不是绝对的,根据实验测定的数据,有时虽满 足这两个条件并不一定能形成离域π键,从而也不出现共轭效应 所具有的性质,例如环丁二烯等。 层形(BN)x分子,它虽然和 石墨是等电子体系,满足形成离域π键的两个条件,但它是白色 ,绝缘性很好的固体,其原因是B—N键的极化作用,使其能带分 成两个亚带,带隙宽度达440kJ· -1,所以没有离域π键出现。 mol 在有些分子中,原子并不完全共面,但也有一定的共轭效应。
3.酸碱性 苯酚显酸性,苯胺显碱性,羧酸呈酸性,酰胺呈碱性,这些 均与离域π键的生成与否有关。例如苯酚和羧酸电离出H+后,酸 根
均生成离域π键,稳定存在。而苯胺和酰胺中就已有离域π键存 在:
它们不易电离,苯胺可以接受H+,故呈若碱性。
4.化学反应性
离域π键的存在对体系性质的影响在化学中常用共轭效应 表示,它是化学中最基本的效应之一。芳香化合物的芳香性, 许多游离基的稳定性,丁二烯类的1,4—加成反应性等都和离 域π键有关。
E 2 1.62 2 0.62 4 4.48 4.48
丁烯中2个电子的键能为2β,所以丁二烯离域结果比单 纯两个丁烯的双键能量要低0.48β,这一差值称为离域能。
分子轨道的对称性和反应机理

乙烯加氢反应:
C2H4 H2 C2H6
G0:是热力学允许的反应 乙烯和氢的前线分子轨道:
对称性不匹配,反应很难进行。必须采用催化 剂才能使反应进行。
要想使反应进行,必须借助催化剂。工业上使用
Raney Ni(超细Ni粉) H2 首先吸附在 Ni 表面,Ni 的 d 电子流向 H2 的 1s* 轨道,使氢分子的LUMO变 成HOMO,使氢分子活化解离,就可以反应了。
光照时,电子激发,原来的 LUMO 将成为 HOMO,应分 析LUMO 的相位
例:丁二烯闭环 光照时,考虑LUMO
光照
ψ3
对旋才满足对称性要求
加热时,考虑HOMO 加热
ψ2
顺旋才满足对称性要求
例:己三烯与丁二烯相反,光照顺旋,加热对旋。
轨道形状可以根据 节面个数猜测!红 虚线为节面。
光照,顺旋
R
3 反应条件的判断
若反应物的成键分子轨道只与产物的成键轨道相关 联,则反应是对称性允许的。在这种情况下,反应 物处于基态就可直接转化为产物,活化能低,在加 热()条件下即可进行。 或表述成:反应物与产物的成键轨道中其对称轨道 数目相等,加热即可进行反应。
若反应物的部分成键轨道与产物的反键轨道关联,则 此反应是对称性禁阻的,在这种情况下,反应物必须 处在激发态才能转化为产物的基态,反应的活化能高, 光照才能使反应进行。 或表述成:反应物与产物的成键分子轨道中其对称轨 道数目不相等时,必须在光照下反应才能进行。
S
A
A
S
E
S
A
A
S
S
A
A
C2
S
光照,顺旋
A
A
S
A
A
S
分子轨道对称守恒原理

分子轨道对称守恒原理
分子轨道对称守恒原理是描述分子轨道形成和相互作用的基本规律。
在分子轨
道理论中,分子轨道对称性对于分子结构、光谱性质以及化学反应的理解都具有重要的意义。
本文将从分子轨道对称守恒原理的概念、原理和应用进行阐述。
首先,分子轨道对称守恒原理是指在分子形成过程中,分子轨道的对称性会保
持不变。
这意味着,如果原子轨道的对称性相同,它们将能够相互叠加形成对称性相同的分子轨道。
这一原理是基于量子力学的波函数叠加原理和对称性分析的基础上得出的。
其次,分子轨道对称守恒原理在分子结构和性质的理解中具有重要的作用。
通
过对分子轨道对称性的分析,可以预测分子的形状、键合方式以及分子的光谱性质。
例如,通过对称性分析可以确定分子中存在的π键和σ键的相对能量位置,从而解释分子的化学性质和反应活性。
另外,分子轨道对称守恒原理也在化学反应的研究中发挥着重要的作用。
在分
子轨道理论中,通过对称性分析可以预测分子间的相互作用方式,从而解释化学键的形成和断裂过程。
这对于设计新的催化剂、预测反应的活性以及理解反应机理都具有重要的意义。
总之,分子轨道对称守恒原理是分子轨道理论中的重要概念,它对于理解分子
结构、光谱性质以及化学反应具有重要的意义。
通过对分子轨道对称性的分析,可以预测分子的性质和行为,为理论化学和实验化学的发展提供了重要的指导。
希望本文对于分子轨道对称守恒原理的理解和应用能够有所帮助。
结构化学《结构化学》第5章 第2讲(5.6)5.2 《结构化学》第5章第2讲

13
根据上述考虑,可将反应过程中分子轨道的变化 关系用能量相关图联系起来。
在能量相关图中,如果反应物的每个成键轨道只 和生成物的成键轨道相关联,则反应活化能低,易 于进行,称为对称性允许,加热就能使反应进行;
如果反应物和生成物之间有成键轨道和反键轨道 相关联,则反应的活化能高,不易进行,称为对称 性禁阻,要使反应进行,需要进行光照,把反应物 的电子由基态激发到激发态。
14
3. 如何理解丁二烯在不同条件下电环化得到不同 构型的环丁烯?
CC
RC
C R 顺旋 R
HH
Δ
H
H
C2对称
R
CC
RC
C R 对旋 R
HH
+- -+
+
-
-
+
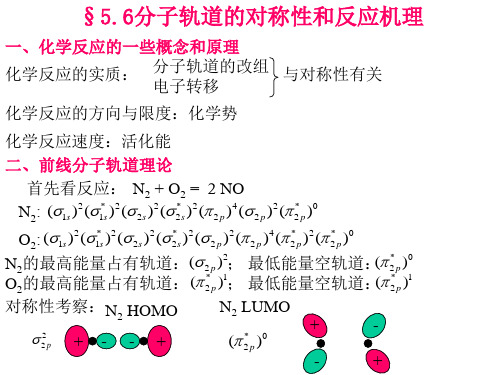
N2的HOMO
N2的LUMO
6
O2分子的价层电子结构为: (σ2s)2(σ2s*)2(σ2pz)2(π2px)2(π2py)2(π2px*)1(π2py*)1(σ2pz*)0 , 其 中4个2s电子占据(σ2s)2(σ2s*)2轨道,4个px、py中的电 子占据(π2px)2(π2py)2轨道,2个pz电子占据(σ2pz)2轨道。 其HOMO为π2p*,LUMO也为π2p*。
h
H
R σV对称
H
15
4
S
3 A
ψ2
S
ψ1
A
丁二烯
C2
*
A
*
S
A
环丁烯
S
C2
16
分子轨道的对称性和反应机理
(2)相互作用的HOMO和LUMO能量必须接近(约为6 eV);
+
(
* 2
p
)0
-
+
O2 HOMO
O2 LUMO
-
+
+
-
(
* 2
p
)1
+
-
(
* 2
p
)1
-
+
-
++
O2
+
--
N2
+
N2的LUMO和O2 的HOMO对称性匹配,但欲使反应进行,电 子需从电负性较高的O向电负性较低的N转移,而当O的电子向反键 轨道转移后,就会增强O2的化学键,反应很难进行。活化能很高。 这说明N2和O2能共存,而且NO也能分解。 前线轨道理论的基本要点:
)0
O2:
(1s
)2
(1*s
)2
(
2s
)2
(
* 2s
)2
(
2
p
)2
(
2
p
)4
(
* 2
p
)2
(
* 2
p
)0
N2的最高能量占有轨道:(
2
p
)2;
最低能量空轨道:(
* 2p
)0
O2的最高能量占有轨道:(
* 2p
)1;
结构化学-教学大纲设计

《结构化学》课程教学大纲(供应用化学专业使用)一、课程性质结构化学是应用化学的专业基础课。
本课程是在学生已经学过高等数学、物理学、无机化学、分析化学、有机化学和物理化学的基础上,在进一步从原子、分子的水平上研究物质微观结构以及结构与性能间的关系的学科。
要求学生系统地掌握结构化学的基本原理、基本方法与基本技能,通过各个教学环节培养学生独立思考、独立分析和创新的能力,使之具有一定的分析和解决化学方面实际问题的能力,从而为进一步学好专业课程及今后从事科学研究,奠定良好的化学理论基础。
考虑到应用化学专业的培养方向,本课程在内容的选材上突出了基础和实用性。
选择了化学键理论,原子结构,晶体化学等为主要内容,使学生通过对化学键理论的学习,为深入学习有关的知识打下基础,通过对晶体组成结构与性能之间关系的学习,为材料科学的学习打下基础。
本课程理论讲授共54学时,3学分。
理论教学主要通过课堂讲授,多媒体影视课件、习题课(或课堂讨论)、演算习题、自学及实验等教学形式,达到学习本课程的目的。
二、教学内容与要求量子力学基础和原子结构。
这部分内容在第一~三章中讲授。
要求了解量子力学的基本假设,掌握氢原子的薛定谔方程及求解要点,提高对原子结构的认识,深入理解原子轨道的意义、性质和空间图象。
了解多电子原子中心力场近似法及He原子的变分法处理,了解核外电子排布的依据,了解角动量的偶合及原子光谱的意义。
化学键理论和分子结构。
这部分内容主要在第五章中讲授。
要求重点掌握化学键的三个基本理论:分子轨道理论、价键理论和配位场理论。
要求掌握价键理论在多原子分子结构中的应用,了解S-P杂化轨道的组成及键角公式。
掌握HMO方法及其在共轭分子中的应用,了解前线轨道理论。
要求掌握配位场理论在配合物结构中的应用,以及s - p 配键配合物和多原子p 键配合物的结构。
点阵理论和晶体结构。
这部分内容主要在第四、六、七章中讲授。
要求掌握晶体周期性结构的特点及由此特点决定晶体的各种性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.6 分子轨道的对称性和反应机理
分子轨道的对称性对化学反应进行的难易程度及产物的构型和构象有决定的作用。
应用分子轨道对称性探讨反应机理,主要有福并谦一提出的前线轨道理论和Woodward和Hoffmann提出的分子轨道对称守恒原理。
5.6.1 有关化学反应的一些原理和概念
化学反应的实质是分子轨道在化学反应过程中进行改组,在改组时涉及分子轨道的对称性。
1、加热反应(Δ),体系受热辐射影响,由于热辐射光子能量小,反应物分子不激发,一般处于基态情况下进行;2、光照反应(hυ),例如体系受紫外线照射,光子能量大,反应物常受激发而处于激发态。
3、催化剂,催化剂的作用为改变反应物的性质,或改变反应的途径。
5.6.2 前线轨道理论
已填电子的能量最高的分子轨道称为最高占据轨道(HOMO),能量最低的空轨道称为最低空轨道(LUMO),这些轨道统称前线轨道。
前线轨道理论认为反应的条件和方式主要决定于前线轨道的对称性,其内容包括:
(1)分子在反应过程中,分子轨道发生相互作用,优先起作用的是前线执道。
当反应的两个分子互相接近时,一个分子中的HOMO和另一个分子中的LUMO必须对称性合适,即按轨道正与正叠加、负与负叠加的方式相互接近所形成的过渡状态是活化能较低的状态,称为对称允许的状态。
(2)互相起作用的HOMO和LUMO能级高低必须接近(约6eV以内)。
(3)随着两个分子的HOMO与LUMO发生叠加,电子便从一个分子的HOMO转移到另一个分子的LUMO,电子的转移方向从电负性判断应该合理,电子的转移要和旧键的削霸相一致,不能发生矛盾。
例1、N2+O2=2NO
N2:1σg21σu21πu42σg21πg
O2:σ2s2σ*2s2σ2pz2(π2px2π2py2)(π*2px1π*2py1)σ*2pz
N2:HOMO:2σ2g LUMO:1πg
O2:HOMO:(π*2px1π*2py1) LUMO:σ*2pz
N2的LUMO:1πg和O2的HOMO:(π*2px1π*2py1)对称性是匹配的,但欲使反应进行,电子需从电负性较高的O向电负性较低的N转移,N2的HOMO:2σ2
g 和O2的LUMO:σ*2pz能量相差很大对称性也不匹配,因此反应是很难进行的。
例2、C2H4+H2=C2H6
H2:σ1s2σ*1s HOMO:σ1s2LUMO:σ*1s
C2H4:π2p z2π*2p z HOMO:π2p z2LUMO:π*2p z
H2的HOMO和C2H4的LUMO及H2的LUMO和C2H4的HOMO对称性均不匹配,在加热下反应不能进行。
可以用光照使H2的电子激发到σ*
1s
或C2H4的电
子激发到π*
2p z 则对称性匹配,或者用催化剂使d电子进入H2的σ*
1s
从而满足对
称性匹配。
例3、丁二烯和乙烯环加成生产环己烯的反应
前线轨道对称性匹配,加热反应即可进行。
5.6.3 分子轨道对称守恒原理
分子轨道对称守恒原理将整个分子轨道一起考虑,即在一步完成的化学反应中,若反应物分子和产物分子的分子轨道对称性一致时,反应容易进行,也就是说整个反应体系从反应物、中间态到产物,分子轨道始终保持某一点群的对称性(顺旋过程保持C2点群,对旋过程保持C s点群)。
(1)反应物的分子轨道与产物的分子轨道一一对应;
(2)相关轨道的对称性相同;
(3)相关轨道的能量应相近:在能量相关图中,如果产物的每个成键轨道都只和反应物的成键轨道相关联,则反应的活化能低,易于反应,称作对称允许,一般加热就能实现反应;如果双方有成键轨道和反键轨道相关联,则反应活化能高,难于反应,称作对称禁阻,要实现这种反应,须把反应物的基态电子激发到激发态。
(4)对称性相同的相关线不相交:对称性相同的轨道间会产生相互排斥的作用,所以对称性相同的关联线不相交。
1、丁二烯型化合物
丁二烯—环丁烯的分子轨道及对称性相关见下图:
丁二烯—环丁烯顺旋(a)和对旋(b)相互转化时的轨道能级相关图
丁二烯如发生顺旋反应(ψ2),分子保持c2对称性,产物的每个成键轨道都只和反应物的成键轨道相关联,反应的活化能低,在加热条件下即可进行;对旋反应(ψ3),分子保持σ
υ对称性,有成键轨道和反键轨道相关联,则反应活化能高,难于反应,称作对称禁阻,要实现这种反应,须把反应物的基态电子激发到激发态,在光照条件下才能进行。
2、己三烯型化合物
加热情况下发生对旋闭环,光照情况下发生顺旋闭环。
