常见有机物化学式
高中化学各类有机物的通式

高中化学各类有机物的通式各类有机物的通式、及主要化学性质烷烃CnH2n+2 仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃CnH2n 含C==C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃CnH2n-2 含C≡C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)CnH2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:CnH2n+1X 醇:CnH2n+1OH或CnH2n+2O 苯酚:遇到FeCl3溶液显紫色醛:CnH2nO 羧酸:CnH2nO2 酯:CnH2nO2 有机反应类型:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
甲醇乙醇化学式

甲醇乙醇化学式
甲醇和乙醇是常见的醇类有机物,它们的化学式分别为CH3OH和C2H5OH。
甲醇和乙醇在我们的生活中扮演着重要的角色,不仅在工业生产中有广泛的应用,而且作为消费品也广泛存在。
作为一种有机物,甲醇和乙醇的化学性质极为活泼。
它们可以与许多无机物发生反应,形成各种化合物。
例如,甲醇可以与氧气反应生成二氧化碳和水,释放出大量的能量。
这种化学反应在工业生产中被广泛应用。
乙醇也有类似的反应,但是其反应活性略低于甲醇。
除此之外,甲醇和乙醇还可以被用作有机试剂,用于有机合成反应。
它们作为亲电性较强的醇类有机物,可以与一些碳原子带有氢原子的化合物发生酯化反应,生成酯类有机化合物。
这种反应在日常生活中也有应用,例如制作香料和油漆。
然而,甲醇和乙醇也有毒性,过量摄入会对人体产生不良影响。
甲醇摄入过量可能导致中枢神经系统和视觉系统损伤,乙醇则会产生烈性饮酒、酒精中毒等毒性反应。
因此,我们应该正确使用甲醇和乙醇,避免对身体产生不必要的伤害。
综上所述,甲醇和乙醇作为常见的醇类有机物,在生产和生活中扮演着重要的角色。
我们应该了解它们的化学性质和应用,并正确使用,以充分发挥它们的作用。
常见化学式大全

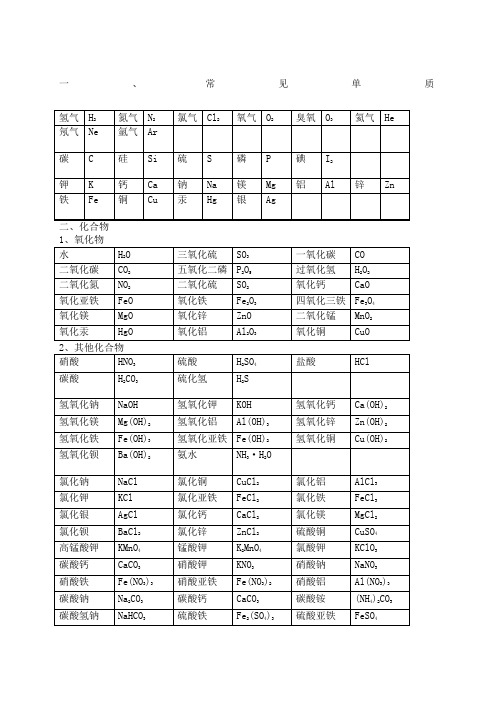
常见化学式➢ 常见的化学式一、常见单质二、化合物 1、氧化物水 H 2O 三氧化硫 SO 3 一氧化碳 CO 二氧化碳 CO 2 五氧化二磷 P 2O 5 过氧化氢 H 2O 2 二氧化氮 NO 2 二氧化硫 SO 2 氧化钙 CaO 氧化亚铁 FeO 氧化铁 Fe 2O 3 四氧化三铁 Fe 3O 4 氧化镁 MgO 氧化锌 ZnO 二氧化锰 MnO 2 氧化汞 HgO氧化铝Al 2O 3氧化铜CuO2、其他化合物硝酸 HNO 3 硫酸 H 2SO 4 盐酸HCl碳酸 H 2CO 3 硫化氢 H 2S氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜Cu(OH)2氢氧化钡 Ba(OH)2 氨水 NH 3 ·H 2O氯化钠 NaCl 氯化铜 CuCl 2 氯化铝 AlCl 3 氯化钾 KCl 氯化亚铁 FeCl 2 氯化铁 FeCl 3 氯化银 AgCl 氯化钙 CaCl 2 氯化镁 MgCl 2 氯化钡 BaCl 2 氯化锌 ZnCl 2 硫酸铜 CuSO 4 高锰酸钾 KMnO 4 锰酸钾 K 2MnO 4 氯酸钾 KClO 3 碳酸钙CaCO 3硝酸钾KNO 3硝酸钠NaNO 3臭氧 O 3 氦气 He氖气 碘 I 2铝 Al 锌 Zn铁氮气 氩气 硅 钙 铜H 2 Ne C K FeN 2 Ar Si Ca CuP Mg AgS Na Hg硫 钠 汞磷 镁 银碳 钾 氢气 氧气氯气Cl 2O 23、常见有机化合物初中化学方程式全(已配平) .一、化合反应1、镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO2、铁在氧气中燃烧: 3Fe +2O 2 点燃 Fe 3O 43、铝在空气中燃烧: 4Al+ 3O 2 点燃 2Al 2O 34、氢气在空气中燃烧: 2H 2 +O 2 点燃 2H 2O5、红磷在空气中燃烧: 4P +5O 2 点燃 2P 2O 56、硫粉在空气中燃烧: S+ O 2 点燃 SO 27、碳在氧气中充分燃烧: C +O 2 点燃 CO 28、碳在氧气中不充分燃烧: 2C +O 2 点燃 2CO9、二氧化碳通过灼热碳层: C +CO 2 高温 2CO 10、一氧化碳在氧气中燃烧: 2CO +O 2 点燃 2CO 211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液) : CO 2 +H 2O ===H 2CO 312、生石灰溶于水: CaO+ H 2O === C a (O H )213、无水硫酸铜作干燥剂: CuSO 4 +5H 2O ==== C u S O 4 ·5H 2O甲烷 CH 4 乙醇 C 2H 5OH 葡萄糖 C 6H 12O 6硝酸铁Fe(NO 3)3 硝酸亚铁 Fe(NO 3)2 硝酸铝 Al(NO 3)3 碳酸钠 Na 2CO 3 碳酸钙 CaCO 3 碳酸铵 (NH 4)2CO 3 碳酸氢钠 NaHCO 3 硫酸铁 Fe 2(SO 4)3 硫酸亚铁 FeSO 4 硝酸银 AgNO 3 硝酸钡Ba(NO 3)2硝酸铵NH 4NO 3硫酸钡BaSO 414、钠在氯气中燃烧: 2Na+ Cl 2 点燃 2NaCl二、 分解反应15、实验室用双氧水制氧气: 2H 2O 2 MnO 2 2H 2O +O 2 ↑ 16、加热高锰酸钾: 2KMnO 4 加热 K 2M nO4 + MnO 2 +O 2 ↑17、水在直流电的作用下分解: 2H 2O 通电 2H 2 ↑+O 2 ↑ 18、碳酸化学物理学报不稳定而分解: H 2CO 3 === H 2O +CO 2 ↑ 19、高温煅烧石灰石(二氧化碳工业制法) : CaCO 3 高温 CaO+ CO 2 ↑三、 置换反应20、铁和硫酸铜溶液反应: Fe+ CuSO 4 == F e S O 4 +C u21、锌和稀硫酸反应(实验室制氢气): Zn+ H 2SO 4 == Z n S O 4+ H 2 ↑ 22、镁和稀盐酸反应: Mg +2HCl === MgCl 2 +H 2 ↑23、氢气还原氧化铜: H 2 +Cu O 加热 Cu +H 2O 24、木炭还原氧化铜: C+ 2CuO 高温 2Cu +CO 2 ↑ 25、甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2+2H 2O 26、水蒸气通过灼热碳层: H 2O +C 高温 H 2 +C O 27、焦炭还原氧化铁: 3C +2Fe 2O 3 高温 4Fe +3CO2↑其他28 、氢氧化钠溶液与硫酸铜溶液反应: 2NaOH+ CuSO 4 == Cu(OH)2 ↓+N a 2SO429、甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 +2H 2O 30、酒精在空气中燃烧: C 2H 5O H + 3O 2 点燃 2CO 2 +3H 2O31、一氧化碳还原氧化铜: CO +CuO 加热 Cu+ CO 232、一氧化碳还原氧化铁: 3CO+ Fe 2O 3 高温 2F e + 3C O 233、二氧化碳通过澄清石灰水(检验二氧化碳): Ca(OH)2+ CO 2 ====CaCO 3 ↓+ H 2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO 2 ==== N a 2CO 3+H 2O35 、石灰石(或小学音乐教案大理石) 与稀盐酸反应(二氧化碳的实验室制法): CaCO 3 +2HCl === CaCl 2 +H 2O +CO 2 ↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理) : Na2CO 3+ 2H C l ===2N a Cl +H 2O +CO 2 ↑ 一. 物质与氧气的反应: (1)单质与氧气的反应:1. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO2. 铁在氧气中燃烧: 3Fe+ 2O 2 点燃 Fe 3O 43. 铜在空气中受热: 2Cu+ O 2 加热 2CuO4. 铝在空气中燃烧: 4Al +3O 2 点燃 2Al 2O 35. 氢气中空气中燃烧: 2H 2 +O 2 点燃 2H 2O6. 红磷在空气中燃烧: 4P+ 5O 2 点燃 2P 2O 57. 硫粉在空气中燃烧: S +O 2 点燃 SO 28. 碳在氧气中充分燃烧: C+ O 2 点燃 CO 29. 碳在氧气中不充分燃烧: 2C+ O 2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO+ O 2 点燃 2CO 211. 甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 2H 2O 12. 酒精在空气中燃烧: C 2H 5O H +3O 2 点燃 2CO 2+ 3H 2O二. 几个分解反应:13. 水在直流电的作用下分新概念英语第一册解: 2H 2O 通电 2H 2 ↑+O 2 ↑14. 加热碱式碳酸铜: Cu 2 (OH)2CO 3 加热 2C u O +H 2O +CO 2 ↑ 15. 加热氯酸钾(有少量的二氧化锰): 2KClO 3 ==== 2K C l + 3O 2 ↑16. 加热高锰酸钾: 2KMnO4 加热 K 2M nO 4 +M n O 2 +O 2 ↑ 17. 碳酸不稳定而分解: H 2CO 3 === H 2O +CO 2 ↑ 18. 高温煅烧石灰石: CaCO 3 高温 CaO +CO 2 ↑ 三. 几个氧化还原反应:19. 氢气还原氧化铜: H 2+ C u O 加热 C u + H 2O 20. 木炭还原氧化铜: C+ 2CuO 高温 2Cu +CO 2 ↑2 初三化学方程式大合集21. 焦炭还原氧化铁: 3C+ 2Fe 2O 3 高温 4Fe+ 3CO 2 ↑ 22. 焦炭还原四氧化三铁: 2C +Fe 3O 4 高温 3F e + 2C O 2 ↑23. 一氧化碳还原氧化铜: CO +CuO 加热 Cu+ CO 224. 一氧化碳还原氧化铁: 3CO+ Fe 2O 3 高温 2F e +3C O 225. 一氧化碳还原四氧化三铁: 4CO +Fe 3O 4 高温 3Fe+ 4CO 2四. 单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气 (置换反应)26. 锌和稀硫酸 Zn+ H 2SO 4 = Z nSO 4+ H 2 ↑27. 铁和稀硫酸 Fe +H 2SO 4 = F e S O 4+ H 2 ↑28. 镁和稀硫酸 Mg +H 2SO 4 = M g S O 4 +H 2 ↑ 29. 铝和稀硫酸 2Al+ 3H 2SO 4 = Al 2 (SO 4)3 +3H 2 ↑30. 锌和稀盐酸 Zn +2HCl === ZnCl 2+ H 2 ↑ 31. 铁和稀盐酸 Fe+ 2HCl === FeCl 2+ H 2 ↑32. 镁和语文教案格式稀盐酸 Mg 2HCl === MgCl 2+ H 2 ↑33. 铝和稀盐酸 2Al+ 6HCl == 2AlCl 3 +3H 2 ↑(2)金属单质+ 盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应: Fe+ CuSO 4 === F e S O 4+ C u 35. 锌和硫酸铜溶液反应: Zn+ CuSO 4 === Z n S O 4+ C u 36. 铜和硝酸汞溶液反应: Cu +Hg(NO 3)2 === C u (N O 3)2 +H g(3)碱性氧化物+酸 -------- 盐+ 水37. 氧化铁和稀盐酸反应: Fe 2O 3+ 6HCl === 2FeCl 3+ 3H 2O 38. 氧化铁和稀硫酸反应: Fe 2O 3 +3H 2SO 4 === F e 2 (SO 4)3+ 3H 2O 39. 氧化铜和稀盐酸反应: CuO +2HCl ==== CuCl 2 +H 2O 40. 氧化铜和稀硫酸反应: CuO +H 2SO 4 ==== C u S O 4+ H 2O 41. 氧化镁和稀硫酸反应: MgO+ H 2SO 4 ==== M g S O 4+ H 2O 42. 氧化钙和稀盐酸反应: CaO +2HCl ==== CaCl 2 +H 2O (4)酸性氧化物+碱 -------- 盐+水43. 苛性钠暴露在空气中变质: 2NaOH +CO 2 ==== N a 2CO 3+H 2O 44. 苛性钠吸收二氧化硫气体: 2NaOH +SO 2 ==== N a 2SO 3 +H 2O 45. 苛性钠吸收三氧化硫气体: 2NaOH+ SO 3 ==== N a 2SO 4+ H 2O46. 消石灰放在空气中变质: Ca(OH)2+ C O 2 ==== C a C O 3 ↓+ H 2O47. 消石灰吸收二氧化硫: Ca(OH)2 +S O 2 ==== C a S O 3 ↓+H 2O (5)酸+碱 -------- 盐+水48. 盐酸和烧碱起反应: HCl+ NaOH ==== NaCl+ H 2O49. 盐酸和氢氧化钾反应: HCl+ KOH ==== KCl+H 2O50. 盐酸和氢氧化初中家长会课件铜反应: 2HCl+ Cu(OH)2 ==== C u C l 2+2H 2O51. 盐酸和氢氧化钙反应: 2HCl+ Ca(OH)2 ==== Ca C l 2 +2H 2O52. 盐酸和氢氧化铁反应: 3HCl+ Fe(OH)3 ==== FeCl 3 +3H 2O 53.氢氧化铝药物治疗胃酸过多: 3HCl +Al(OH)3 ==== AlCl 3 +3H 2O54.硫酸和烧碱反应: H 2S O 4 +2N a O H ==== N a 2SO 4 +2H 2O 55.硫酸和氢氧化钾反应: H 2S O 4 +2K O H ==== K 2SO 4 +2H 2O 56.硫酸和氢氧化铜反应: H 2SO4 +Cu(OH)2 ==== C u S O 4 +2H 2O 57. 硫酸和氢氧化铁反应: 3H 2SO 4 +2Fe(OH)3==== F e 2 (SO4)3+ 6H 2O 58. 硝酸和烧碱反应: H N O 3+ N a O H ==== N a N O 3 +H 2O(6)酸+盐 -------- 另一种酸+另一种盐59. 大理石与稀盐酸反应: CaCO 3 +2HCl === CaCl 2 H 2O +CO 2 ↑ 60. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2H C l === 2N a Cl +H 2O+ CO 2 ↑ 61. 碳酸镁与稀盐酸反应 : MgCO 3 +2H C l === Mg Cl 2 +H 2O+ CO 2 ↑ 62. 盐酸和硝酸银溶液反应: HCl+ AgNO 3 === AgCl↓+ HNO 3 63.硫酸和碳酸钠反应: Na 2CO 3 +H 2SO 4 === N a 2SO 4 +H 2O +CO 2 ↑ 64.硫酸和氯化钡溶液反应: H 2S O 4 +BaCl 2 ==== B a S O 4 ↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65. 氢氧化钠与硫酸铜: 2NaOH CuSO 4 ==== C u (O H )2 ↓ N a 2SO 4 66. 氢氧化钠与氯化铁: 3NaOH FeCl 3 ==== Fe(OH)3 ↓ 3NaCl 67. 氢氧化钠与氯化镁: 2NaOH MgCl 2 ==== M g (O H )2 ↓ 2NaCl 68. 氢氧化钠与氯化铜: 2NaOH CuCl 2 ==== C u (O H )2 ↓ 2NaCl 69. 氢氧化钙与碳酸钠: Ca(OH)2 N a 2CO 3 === C a C O 3 ↓ 2N a O H (8)盐+ 盐 ----- 两种新盐70. 氯化钠溶液新概念英语第二册和硝酸银溶液: NaCl +AgNO 3 ====AgCl↓+ NaNO 371. 硫酸钠和氯化钡: Na 2SO 4+ BaCl 2 ==== B a S O 4 ↓+ 2NaCl五. 其它反应:72. 二氧化碳溶解于水: CO 2+ H 2O=== H 2CO 373. 生石灰溶于水: CaO+ H 2O === C a (O H )2 74. 氧化钠溶于水: Na 2O +H 2O ==== 2N a O H 75. 三氧化硫溶于水: SO 3 +H 2O==== H 2SO 4 76. 硫酸铜晶体受热分解: CuSO 4 ·5H 2O 加热 CuSO 4 5H 2O 77. 无水硫酸铜作干燥剂: CuSO 4+ 5H 2O ==== C u S O 4 ·5H 2 化学方程式 反应现象 应用2M g + O 2 点燃或 Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体 .放热.产生大量白烟 白色信号弹2H g +O 2 点燃或 Δ2HgO 银白液体、生成红色固体 拉瓦锡实验2C u + O 2 点燃或 Δ2CuO 红色金属变为黑色固体4Al+ 3O 2 点燃或 Δ2Al 2O 3 银白金属变为白色固体3F e + 2O 2 点燃 Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe+3O2 高温 2Fe 2O 3C+ O 2 点燃 CO 2 剧烈燃烧、白光、放热、使石灰水变浑浊S +O 2 点燃 SO 2 剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰 .氧气中蓝紫色火焰2H 2 O 2 点燃 2H 2O 淡蓝火焰、放热、生成使无水 CuSO 4 变蓝的液体(水)高能燃料4P +5O2 点燃 2P 2O 5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量C H 4+ 2O 2 点燃 2H 2O+ CO 2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水 CuSO 4 变蓝的液体(水) 甲烷和天然气的燃烧2C 2H 2+ 5O 2 点燃 2H 2O +4CO 2 蓝色火焰、放热、黑烟、生成使石灰水变 浑浊气体和使无水 CuSO 4 变蓝的液体(水) 氧炔焰、焊接切割金属 2KClO 3M n O 2 、 Δ2K C l +3O 2 ↑ 生成使带火星的木条复燃的气体 实验室 制备氧气2KMnO 4 Δ K2MnO 4 M nO 2 +O 2 ↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧论文气2H g O Δ2H g + O 2 ↑ 红色变为银白 、生成使带火星木条复燃的气体 拉瓦锡实验2H2O 通电 2H 2 ↑+ O 2 ↑ 水通电分解为氢气和氧气 电解水C u 2 (OH)2CO 3 Δ2Cu O +H 2O+ CO 2 ↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热N H 4HCO 3 ΔN H 3 ↑+ H 2O+ CO 2 ↑ 白色固体消失 、管壁有液体 、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失Z n + H 2SO 4=Z nSO 4 +H 2 ↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气F e +H 2SO 4=F e S O 4 +H 2 ↑ 有大量气泡产生、金属颗粒逐渐溶解M g +H 2SO 4 =M g S O 4 +H 2 ↑ 有大量气泡产生、金属颗粒逐渐溶解 2Al+ 3H 2SO 4=Al 2 (SO4)3+ 3H 2 ↑ 有大量气泡产生、金属颗粒逐渐溶解 Fe 2O 3+3H 2 Δ 2F e +3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金 属、利用氢气的还原性Fe 3O 4 +4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译 、试管壁有液体 冶炼金属、利用氢气的还原性WO 3 +3H 2 Δ W +3H 2O 冶炼金属钨、利用氢气的还原性MoO 3 +3H 2 ΔM o +3H 2O 冶炼金属钼、利用氢气的还原性2Na+ Cl 2 Δ 或点燃 2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2 +Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的 形成、制备盐酸CuSO 4 +2N aO H =C u (O H )2 ↓+ N a 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 2 点燃 2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O 2 点燃 2CO 2 蓝色火焰 煤气燃烧C+ CuO 高温 2Cu+ CO 2 ↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+ 3C 高温 4Fe+ 3CO 2 ↑ 冶炼金属Fe 3O 4 +2C 高温 3Fe+ 2CO 2 ↑ 冶炼金属 C+ CO2 高温 2COCO 2+ H 2O = H 2CO 3 碳酸使石蕊变红 证明碳酸的酸性小学三语文教学论文H 2CO 3 ΔCO 2 ↑+ H 2O 石蕊红色褪去Ca(OH)2 +C O 2= Ca CO 3 ↓+ H 2O 澄清石灰水变浑浊 应用 CO2 检验和石灰浆粉刷墙壁CaCO 3 +H 2O+ CO 2 = Ca (HCO 3)2 白色沉淀逐渐溶解 溶洞的形成 , 石头的风化Ca(HCO 3)2 Δ CaCO 3 ↓+ H 2O +CO 2 ↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成2N aH CO 3 ΔNa 2CO 3+ H 2O +CO 2 ↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头CaCO 3 高温 CaO +CO 2 ↑ 工业制备二氧化碳和生石灰CaCO 3 +2HCl=CaCl 2+ H 2O +CO 2 ↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 初中化学方程式汇总 一、 氧气的性质:(1)单质与氧气的反应: (化合反应) 1. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO2. 铁在氧气中燃烧: 3Fe+ 2O 2 点燃 Fe 3O 43. 铜在空气中受热: 2Cu+ O 2 加热 2CuO4. 铝在空气中燃烧: 4Al +3O2 点燃 2Al 2O 35. 氢气中空气中燃烧: 2H 2 +O 2 点燃 2H 2O6. 红磷在空气中燃烧(研究空气组成的实验) : 4P +5O 2 点燃 2P 2O 57. 硫粉在空气中燃烧: S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧: C +O 2 点燃 CO 29. 碳在氧气中不充分燃烧: 2C +O 2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO+O 2 点燃 2CO 2 11. 甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 +2H 2O 12. 酒精在空气中燃烧: C 2H 5O H +3O 2 点燃 2CO 2 +3H 2O(3)氧气的来源:13. 玻义耳研究空气的成分实验 2HgO 加热 Hg +O 2 ↑14. 加热高锰酸钾: 2KMnO 4 加热 K 2M nO 4+ M n O 2 +O 2 ↑(实验室制氧气原理 1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H 2O 2 M nO 22H 2O+ O 2 ↑(实验室制氧气原理 2)二、自然界中的水:16. 水在直流电的作用下分解(研究水的组成实验): 2H 2O 通电2H 2 ↑+O 2 ↑17. 生石灰溶于水英语六级作文: CaO +H 2O == Ca (O H )218. 二氧化碳可溶于水: H 2O+CO 2==H 2CO 3 三、质量守恒定律:19. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO20. 铁和硫酸铜溶液反应: Fe+ CuSO 4 === F e S O 4+ C u21. 氢气还原氧化铜: H 2 +C u O 加热 Cu +H 2O 22. 镁还原氧化铜: Mg+ CuO 加热 Cu +MgO 四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧: C + O 2 点燃 CO 224. 木炭还原氧化铜: C + 2CuO 高温 2Cu+ CO 2 ↑ 25. 焦炭还原氧化铁: 3C + 2Fe2O 3 高温 4Fe + 3CO 2 ↑(2)煤炉中发生的三个反应: (几个化合反应) 26. 煤炉的底层: C +O 2 点燃 CO 227. 煤炉的中层: C O 2+ C 高温 2CO28. 煤炉的上部蓝色火焰的产生: 2CO +O 2 点燃 2CO 2(3)二氧化碳的制法与性质:29. 大理石与稀盐酸反应(实验室制二氧化碳) :CaCO 3+ 2HCl == CaCl 2+ H 2O +CO 2 ↑ 30. 碳酸不稳定而分解: H 2CO 3 == H 2O +CO 2 ↑31. 二氧化碳可溶于水: H 2O +CO 2== H 2CO 332. 高温煅烧石灰石(工业制二氧化碳) : C aCO 3 高温 CaO+ CO 2 ↑ 33. 石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳) :Ca(OH)2 +C O 2 === C a C O 3 ↓+H 2O (4) 一氧化碳的性质:34. 一氧化碳还原氧化铜: CO+ CuO 加热 Cu +CO 235. 一氧化碳的可燃性: 2CO +O 2 点燃 2CO 2 其它反应:36. 碳酸钠与稀盐酸反应(灭火器的原理) : N a 2CO 3 2HCl == 2NaCl+ H 2O +CO 2 ↑ 五、燃料及其利用:37. 甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 +2H 2O 38. 酒精在空气中燃烧: C 2H 5OH +3O2 点燃 2CO 2 +3H 2O39. 氢气中空气中燃烧: 2H 2+ O 2 点燃 2H 2O 六、金属(1)金属与氧气反应:40. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO 41. 铁在氧气中燃烧: 3Fe +2O 2 点燃 Fe 3O 4 42. 铜在空气中受热: 2Cu +O 2 加热 2CuO 43. 铝在空气中形成氧化膜: 4Al+ 3O 2 = 2Al 2O 3(2)金属单质 酸 -------- 盐 氢气 (置换反应)44. 锌和稀硫酸 Zn+ H 2SO 4 = Z nSO 4+ H 2 ↑ 45. 铁和稀硫酸 Fe +H 2SO 4 = F e S O 4 +H 2 ↑ 46. 镁和稀硫酸 Mg +H 2SO 4 = M g S O 4+ H 2 ↑ 47. 铝和稀硫酸 2Al+ 3H 2SO 4 = Al 2 (SO 4)3 +3H 2 ↑48. 锌和稀盐酸 Zn+ 2HCl == ZnCl 2+ H 2 ↑ 49. 铁和稀盐酸 Fe +2HCl == FeCl 2 +H 2 ↑ 50. 镁和稀盐酸 Mg +2HCl == MgCl 2+ H 2 ↑ 51. 铝和稀盐酸 2Al+ 6HCl == 2AlCl 3 +3H 2 ↑(3)金属单质 盐怎样学好高中物理(溶液) ------- 新金属 新盐 52. 铁和硫酸铜溶液反应: Fe +CuSO 4 == F e S O 4 +C u53. 锌和硫酸铜溶液反应: Zn +CuSO 4 ==Z n S O 4 +Cu 54. 铜和硝酸汞溶液反应: Cu +Hg(NO 3)2 == C u (N O 3)2 +H g(3)金属铁的治炼原理: 55. 3CO +2Fe 2O 3 高温 4Fe +3CO 2 ↑七、酸、碱、盐 1、酸的化学性质(1) 酸 金属 -------- 盐 氢气(见上)(2) 酸 金属氧化物-------- 盐 水56. 氧化铁和稀盐酸反应: Fe 2O 3 +6HCl ==2FeCl 3 +3H 2O 57. 氧化铁和稀硫酸反应: Fe 2O 3 +3H 2S O 4 == F e 2 (SO4)3 +3H 2O 58. 氧化铜和稀盐酸反应: CuO +2HCl ==CuCl 2 +H 2O59. 氧化铜和稀硫酸反应: CuO+ H 2S O 4 == C uS O 4+ H 2O (3) 酸 碱 -------- 盐 水(中和反应) 60. 盐酸和烧碱起反应: HCl +NaOH == NaCl+H 2O 61. 盐酸和氢氧化钙反应: 2HCl+ Ca(OH)2 == CaCl 2+2H 2O 62. 氢氧化铝药物治疗胃酸过多: 3HCl +Al(OH)3 == AlCl 3 +3H 2O63. 硫酸和烧碱反应: H 2SO 4+ 2N a O H == N a 2SO 4 +2H 2O(4) 酸 盐 -------- 另一种酸 另一种盐64. 大理石与稀盐酸反应: CaCO 3+ 2HCl == CaCl 2 +H 2O+ CO 2 ↑ 65. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2H C l == 2N a Cl + H 2O+ CO 2 ↑ 66. 碳酸氢钠与稀盐酸反应: NaHCO 3 +HCl== Na Cl+H 2O+ CO 2 ↑ 67. 硫酸和氯化钡溶液反应: H 2SO 4 +BaCl 2 == B a S O 4 ↓+2HCl 2、碱的幼儿园小班音乐教案化学性质 (1) 碱 非金属氧化物 -------- 盐 水68. 苛性钠暴露在空气中变质: 2NaOH+CO 2 == N a 2CO 3+ H 2O 69. 苛性钠吸收二氧化硫气体: 2NaOH +SO 2 == N a 2SO 3 +H 2O 70. 苛性钠吸收三氧化硫气体: 2NaOH+ SO 3 == N a 2SO 4 +H 2O 71. 消石灰放在空气中变质: Ca(OH)2+ C O 2 == C a C O 3 ↓+H 2O 72. 消石灰吸收二氧化硫: Ca(OH)2 +S O 2 == C a S O 3 ↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠: Ca(OH)2 +N a 2CO 3 == C a C O 3 ↓+ 2N a O H3、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐74. 铁和硫酸铜溶液反应: Fe+ CuSO 4 == F e S O 4 +C u (2) 盐 酸-------- 另一种酸 另一种盐75. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2H C l == 2N a Cl +H 2O+ CO 2 ↑碳酸氢钠与稀盐酸反应: NaHCO 3 +HC l == Na Cl + H 2O +CO 2 ↑点燃(3) 盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠: Ca(OH)2 +N a 2CO 3 == C a C O 3 ↓+ 2N a O H(4) 盐 盐 ----- 两种新盐77. 氯化钠溶液和硝酸银溶液: NaCl +AgNO 3 == AgCl↓+NaNO 3 78. 硫酸钠和氯化钡: Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中: CO 2 + Ca(OH)2 == CaCO 3 ↓+ H 2O2、氢氧化钠在空气中变质: CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫: SO 2 + 2NaOH ==Na 2SO 3+ H 2O 4 、一氧化碳还原氧化铜: CO + CuO C + CO 2 5、酒精燃烧: C 2H 5OH + 3O 2 点CO 2 + 3H 2O6、甲烷燃烧: CH 4 + 2O 2 CO 2 + 2H 2O。
初中常见化合物化学式

初中化学基础知识梳理宋辉婵之阿布丰王创作初中罕见化合物化学式1、罕见的酸:无氧酸:氢氯酸 HCl(盐酸)氢硫酸 H2S 氢氟酸 HF含氧酸:硫酸 H2SO4硝酸 HNO3碳酸 H2CO3氯酸HClO3磷酸 H3PO4亚硫酸H2SO3有机酸:乙酸(醋酸)CH3COOH2、罕见碱的化学式:可溶性碱:氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2氢氧化钡 Ba(OH) 2氢氧化铵(氨水)NH3·H2O不溶性碱:氢氧化铜Cu(OH) 2氢氧化亚铁Fe(OH) 2氢氧化镁Mg(OH) 2氢氧化铝Al(OH)33、罕见盐的化学式:硝酸盐:硝酸钾KNO3硝酸钠NaNO3硝酸铵 NH4NO3硝酸铜 Cu(NO3)2硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3硝酸铝Al(NO3)3硝酸银AgNO3硝酸镁Mg(NO3)2硝酸钙Ca(NO3)2硝酸锌Zn(NO3)2硫酸盐:硫酸钠 Na2SO4硫酸钾K2SO4硫酸铵(NH4)2SO4硫酸铁 Fe2(SO4)3硫酸亚铁FeSO4硫酸铜CuSO4硫酸铝Al2(SO4)3硫酸锌ZnSO4硫酸镁MgSO4硫酸钙CaSO4硫酸钡BaSO4碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3碳酸铵(NH4)2 CO3碳酸铜CuCO3碳酸钙CaCO3碳酸钡BaCO3碳酸镁MgCO3碳酸锌ZnCO3碳酸亚铁FeCO3盐酸盐:氯化钠 NaCl氯化钾 KCl 氯化铵NH4 Cl氯化钙CaCl2氯化钡BaCl2氯化锌ZnCl2氯化铝AlCl3氯化铜CuCl2氯化铁FeCl3氯化亚铁FeCl2氯化镁MgCl2氯化银AgCl其他经常使用盐:高锰酸钾 KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3碱式碳酸铜Cu2(OH) 2CO3经常使用氧化物的化学式:金属氧化物:氧化铁 Fe2O3氧化亚铁FeO 四氧化三铁Fe3O4氧化铜CuO 氧化亚铜Cu2O 氧化铝Al2O3氧化镁MgO氧化锌ZnO 氧化钙CaO 氧化钠Na2O非金属氧化物:氧化氢(水)H2O一氧化碳 CO二氧化碳 CO2二氧化硫 SO2三氧化硫SO3一氧化氮NO 二氧化氮NO2五氧化二氮N2O5五氧化二磷P2O5过氧化物:过氧化氢 H2O2过氧化钠Na2O2过氧化钙CaO2其他:甲烷:CH4甲醇CH3OH 乙醇:C2H5OH有刺激性气味的气体:NH3 SO2 HCl有毒的气体:CO污染性气体:CO SO2 NO2(空气中原有的成分都不是污染性气体)罕见物质的主要成分及俗名物质及主要成分:石灰石、大理石、鸡蛋壳、水垢: CaCO3食盐:NaCl 食醋: CH3COOH 铁锈:Fe2O3天然气、沼气、瓦斯:CH4草木灰:K2CO3水煤气:(H2、CO)煤气:CO 焦炉煤气:(CH4、H2、CO)福尔马林:30%--40%的甲醛溶液生理盐水:0.9%的NaCl溶液碱石灰:CaO和NaOH的混合物罕见物质的俗名:干冰:固态CO2水银:Hg 火碱、烧碱、苛性钠:NaOH纯碱、碱面、苏打:Na2CO3小苏打:NaHCO3熟石灰、消石灰、石灰水的溶质:Ca(OH)2胆矾、蓝矾:CuSO4·5H2O 绿矾:FeSO4·7H2O酒精:乙醇C2H5OH 醋酸:乙酸CH3COOH工业盐:亚硝酸钠NaNO2 工业酒精:CH3OH罕见物质的颜色:1、白色固体:MgO P2O5 KClO3 KCl NaCl Na2CO3NaOH Ca(OH)2CaO 无水CuSO4纯铁镁带2、黑色固体:CuO Fe3O4MnO2K2MnO4铁粉碳粉石墨3、红色固体: 红磷(P) Cu 铁锈(Fe2O3)4、黄色:硫磺(S)5、绿色:碱式碳酸铜Cu2(OH) 2CO36、紫黑色:KMnO4罕见的有色离子:1、Cu2+:存在的溶液呈蓝色2、Fe2+:存在的溶液呈浅绿色3、Fe3+:存在的溶液呈棕黄色MnO4ˉ:存在的溶液呈紫红色罕见沉淀及其颜色:白色沉淀:CaCO3、BaCO3、BaSO4 、AgCl(不溶于稀硝酸)Mg(OH) 2 、Al(OH)3蓝色沉淀:Cu(OH) 2CuCO3红褐色沉淀:Fe(OH) 3罕见气体的检验O2:带火星的木条,观察其是否复燃CO2:澄清的石灰水,观察其是否变浑浊H2:燃着的木条,观察期是否发生淡蓝色火焰H2O:无水CuSO4粉末,观察其是否变蓝NH3:湿润的红色石蕊试纸,观察其是否变蓝罕见干燥剂的选择1、浓硫酸:酸性干燥剂,不克不及用来干燥碱性气体。
初中常见化学式大全
一、常见单质一、氧气的性质:1. 镁在空气中燃烧:2Mg + O2点燃 2MgO★2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 △ 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧:S + O2点燃 SO28. 碳在氧气中充分燃烧: C + O2点燃 CO29. 碳在氧气中不充分燃烧:2C + O2点燃 2CO10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO211.玻义耳研究空气的成分实验2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾:2KMnO4△ K2MnO4 + MnO2 + O2↑2KCl+3O2↑★13.氯酸钾和二氧化锰共热制取氧气2KClO3MnO2△★14.过氧化氢二氧化锰催化剂条件下分解反应2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★15.电解水(探究水的组成实验):2H2O 通电 2H2↑+ O2 ↑16.生石灰溶于水: CaO + H2O = Ca(OH)217.二氧化碳可溶于水:H2O + CO2=H2CO3三、质量守恒定律:18.镁在空气中燃烧:2Mg + O2 点燃 2MgO★19.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu★20.氢气还原氧化铜:H2 + CuO △ Cu + H2O四、碳和碳的氧化物:21. 碳在氧气中充分燃烧: C + O2点燃 CO2★22.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑23.焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑24.煤炉的底层: C + O2点燃 CO225.煤炉的中层:CO2 + C 高温 2CO26.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2★27.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑28.碳酸不稳定而分解:H2CO3 = H2O + CO2↑29.二氧化碳可溶于水: H2O + CO2=H2CO3):CaCO3高温 CaO + CO2↑★30.高温煅烧石灰石(工业制CO2★31.石灰水与二氧化碳反应Ca(OH)2 + CO2 = CaCO3↓+ H2O★32.一氧化碳还原氧化铜:CO+ CuO △ Cu + CO2★33.一氧化碳的可燃性:2CO + O2点燃 2CO2★34.碳酸钠与稀盐酸灭火器Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★35.甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O★36.酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O★37.氢气中空气中燃烧:2H2 + O2点燃 2H2O六、金属38.镁在空气中燃烧: 2Mg + O2点燃 2MgO39.铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O440. 铜在空气中受热:2Cu + O2 △ 2CuO41. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3★42. 锌和稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑★43. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑44. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑45. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑46. 锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑47. 铁和稀盐酸Fe + 2HCl =FeCl2 + H2↑48. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑49.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑★50. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu51. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu52. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg ★53.金属铁的治炼原理:3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐★54. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O★55. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O 56. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O57. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O★58.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O★59. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O60. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O61. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★62.大理石与稀盐酸反CaCO3 +2HCl =CaCl2+H2O+CO2↑★63.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑64.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑★65. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl★66.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O67.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O68.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O★69.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O70. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O★71. 铁和硫酸铜溶液(波尔多液不能用铁桶装):Fe + CuSO4 = FeSO4 + Cu ★72.碳酸钠与稀盐酸检验NaOH变质Na2CO3+2HCl=2NaCl+H2O+CO2↑★73. 碳酸氢钠与稀盐酸(小苏打治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑★74. 氢氧化钙与碳酸钠(检验NaOH变质):Ca(OH)2+Na2CO3=CaCO3↓+ 2NaOH ★75.氯化钠和硝酸银(区别食盐和蒸馏水):NaCl + AgNO3 =AgCl↓ + NaNO3★76.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
化学俗名及其化学式(有机物)

化学俗名及其化学式(有机物)二画二茂铁二聚环戊二烯铁Fe[(CH)5]2三画山梨酸己二烯-[2,4]-酸CH3CH=CHCH=CHCOOH马来酐顺丁烯二酸酐马来酸顺丁烯二酸HOOCCH=CHCOOH 四画六氢吡啶氮杂环己烷NH-(CH2)5 火棉胶硝化纤维(11~12%N)天冬氨酸丁氨二酸HOOCCH2CH(NH2)COOH 天冬酰胺HOOCCH2CH(NH2)CONH2木醇甲醇木醚二甲醚CH3OCH3牙托水甲基丙烯酸甲酯CH2=C(CH3)-COOCH3 月桂酸十二酸CH3(CH2)10COOH月桂醛十二醛月桂醇十二醇乌洛托品环六次甲基四胺双酚A HO-苯-C(CH3)2-苯-OH巴豆酸丁烯-[2]-酸CH3CH=CHCOOH 巴豆醛丁烯-[2]-醛CH3CH=CHCHO水杨酸邻羟基苯甲酸五画半胱氨酸beta-巯基丙氨酸HSCH2CH(NH2)COOH平平加O 一种非离子表明活性剂,主要成分石聚氧化乙烯脂肪醇醚RO(CH2CH2O)nCH2CH2OH,其中R为C12~C18的烷基,n为15~16.甘油丙三醇甘氨酸氨基乙酸H2NCH2COOH甘醇乙二醇甘露醇己六醇可的松11-脱氢-17羟基皮质菑酮,或称皮质酮石炭酸苯酚龙胆紫系含义模糊的商业名称,文献上各有其说,一般为甲紫和糊精的等量混和物卡必醇二甘醇单乙醚HOCH2CH2OCH2CH2OCH2CH3尼古丁烟碱,即1-甲基-2-(3-吡啶基)吡咯烷丝氨酸beta-羟基丙氨酸HOCH2CH(NH2)COOH六画冰片莰醇-[2] 衣康酸甲叉丁二酸CH2=C(COOH)-CH2COOH冰醋酸一般指浓度在98%以上的乙酸,在13.3摄氏度结成冰块(纯乙酸熔点为16.7摄氏度) 米吐尔硫酸对甲胺基苯酚HO-苯-NHCH3•1/2H2SO4安息油苯安息香酸苯甲酸百里酚5-甲基-2-异丙基苯酚过氧化苯甲酰苯-CO-O-O-CO-苯光气碳酰氯COCl2 肉豆蔻酸十四酸CH3(CH2)12COOH肉桂酸苯基丙稀-[2]-酸苯-CH=CHCOOH 肉桂醛苯-CH=CHCHO肉桂酸醇苯-CH=CHCH2OH 色氨酸β-吲哚基丙氨酸异佛尔酮3,5,5-三甲基环己烯-[2]-酮-[1]七画芥子气2,2-二氯乙硫醚ClCH2CH2SCH2CH2Cl 苏氨酸a-氨基-β-羟基丁酸谷氨酸a-氨基戊二酸HOOCCH2CH2CH(NH2)COOH 阿司匹林乙酰水杨酸HOOC-苯-OCOCH3八画油酸顺式-十八烯-[9]-酸CH3(CH2)7CH=CH(CH2)7COOH苹果酸羟基丁二酸HOOCCH(OH)CH2COOH 苦杏仁油苯甲醛苦味酸2,4,6-三硝基苯酚苯酐邻苯二甲酸酐芪1,2-二苯乙烯[通常指反式] C6H5CH=CHC6H5拉开粉一类阴离子型表面活性剂,主要成分是烷基萘磺酸钠乳酸2-羟基丙酸CH3CH(OH)COOH肥皂高级脂肪酸的金属盐的总称,日常一般指高级脂肪酸的钠盐或钾盐九画珂罗酊见火棉胶草酸乙二酸HOOC-COOH柠檬酸2-羟基丙(烷)三羧酸-[1,2,3] HO-C(CH2COOH)-COOH 蚁酸甲酸HCOOH 氟利昂氟氯烷和氟溴烷秋兰姆二硫化四甲基秋兰姆(CH3)2-N-C(=S)-S-S-C(=S)-N(CH3)2香豆素氧杂萘邻酮香蕉水(1) 用作涂料的溶剂或稀释剂,由酯,酮,醇,醚和芳烃等配合而成,(2)乙酸异戊酯CH3COOCH2CH2CH(CH3)2十画酒石酸 2,3-二羟丁二酸HOOCCH(OH)CH(OH)COOH 酒精乙醇桂酸十二酸CH3(CH2)10COOH 桐(油)酸十八碳三烯-[9,11,13]-酸CH3(CH2)3(CH=CH)3(CH2)7COOH胶棉硝化纤维(10~12%N) 胱氨酸双硫代氨基丙酸HOOCCH(NH2)-CH2-S-S-CH2-CH(NH2)-COOH十一画蓖麻酸顺式-12-羟基十八碳烯-[9]-酸CH3(CH2)5CH(OH)CH2CH=CH(CH2)7COOH梯恩梯[TNT] (2,4,6)三硝基甲苯脲尿素(H2N)2C=O十二画富马酸反丁烯二酸HOOC-CH=CH-COOH 琥珀酸丁二酸HOOC-CH2CH2-COOH 硬脂酸十八酸CH3(CH2)16COOH 硝化甘油甘油三硝酸酯硝棉硝化纤维(12.5~13.9% N) 氯仿三氯甲烷CHCl3十三画福尔马林37~40%甲醛(HCHO)水溶液赖氨酸2,6-二氨基己酸H2N(CH2)3CH(NH2)COOH碘仿三碘甲烷十四画精氨酸2-氨基-5-胍基戊酸H2NC(=NH)CH2CH2CH2CH(NH2)COOH蜡酸二十六酸CH3(CH2)24COOH 缩苹果酸丙二酸HOOCCH2COOH十五画糊精(C6H10O5)x,由淀粉经酸或热处理或经a-淀粉酶作用而成的不完全水解的产物樟脑莰酮-[2] 醋酐乙酐CH3C(=O)-O-C(=O)CH3醋酸乙酸CH3COOH 糖精邻磺酰苯(甲)酰亚胺磺胺酸对氨基苯磺酸鲸蜡烷十六烷CH3(CH2)14CH3鲸蜡醇十六醇CH3(CH2)14CH2OH 糠醇呋喃甲醇草酸HOOC-COOH 马来酸HOOC-CH=CH-COOH(顺丁烯二酸)缩苹果酸HOOC-CH2-COOH 酞酸CH3-C6H4-CH3(邻苯二甲酸)延胡索酸(富马酸)HOOC-CH=CH-COOH(反丁烯二酸)蚁酸HCOOH安息香酸C6H5-COOH 琥珀酸HOOC-CH2-CH2-COOH苯醋酸C6H5CH2COOH 胶酸HOOC-CH2-CH2-CH2-COOH肥酸HOOC-CH2-CH2-CH2-CH2-COOH 醋酸CH3-COOH酪酸CH3-CH2-CH2-COOH 缬草酸CH3-CH2-CH2-CH2-COOH。
高中有机化学知识点汇总(一)

高考有机化学专题一:有机物的结构和同分异构体:(一)有机物分子式、电子式、结构式、结构简式的正确书写:1、分子式的写法:碳-氢-氧-氮(其它元素符号)顺序。
2、电子式的写法:掌握7种常见有机物和4种基团:7种常见有机物:CH4、C2H6、C2H4、C2H2、CH3CH2OH、CH3CHO、CH3COOH。
4种常见基团:-CH3、-OH、-CHO、-COOH。
3、结构式的写法:掌握8种常见有机物的结构式:甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。
(注意键的连接要准确,不要错位。
)4、结构简式的写法:结构简式是结构式的简写,书写时要特别注意官能团的简写,烃基的合并。
要通过练习要能识别结构简式中各原子的连接顺序、方式、基团和官能团。
掌握8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。
(二)同分异构体:要与同位素、同素异形体、同系物等概念区别,注意这四个“同”字概念的内涵和外延。
并能熟练地作出判断。
1、同分异构体的分类:碳链异构、位置异构、官能团异构。
2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。
3、烃卤代物的同分异构体的判断:找对称轴算氢原子种类,注意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。
专题二:官能团的种类及其特征性质:(一)、烷烃:(1)通式:C n H2n+2,代表物CH4。
(2)主要性质:①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。
③、隔绝空气时高温分解。
(二)、烯烃:(1)通式:C n H2n(n≥2),代表物CH2=CH2,官能团:-C=C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。
③、加聚反应。
(三)、炔烃:(1)通式:C n H2n-2(n≥2),代表物CH≡CH,官能团-C≡C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
常见的化学物质

乳酸:有机化合物,化学式C3H6O3,无色或带黄色的糖浆状液体,牛奶中含有它,人常时间运动感到肌肉酸痛就是因为肌肉分泌了乳酸,过一会就消失了是因为乳酸在体内与氧气反应转变为了二氧化碳和水。
·软脂酸:有机化合物,化学式C16H32O2[CH3(CH2)14COOH],又叫十六酸,白色鳞片状固体,带珠光,用于制肥皂或化装品。
S水:水的化学式H2O,每个水分子由2个氢原子和一的氧原子构成,是自然界最常见的氧化物,纯净的水是没有颜色没有气味没有味道的液体,通电时可产生H2和O2,是维持生命的重要物质。
·水杨酸:学名邻羟苯甲酸,化学式C7H6O3,以酯的形式存在于自然界中,遇FeCl3溶液显紫色,羧基酸性比碳酸强,羟基酸性比碳酸弱。
水杨酸具有防腐、杀菌、消毒作用,可用于合成染料和制药。
·三氧化二铁:化学式Fe2O3。
又称“氧化铁”,俗称铁丹、铁红、土铁、赤铁矿等,红棕色至黑色立方晶体,常用见为红棕色粉末。
有碱性氧化物通性,广泛用于炼铁和建筑业。
三氧化二砷:见砒霜。
三硝基甲苯:化学式C7H5N3O6,学名2,4,6-三硝基甲苯,俗名“TNT”,浅黄色晶体,微溶于水,是一种较安全的爆炸力强的炸药,世界上常规武器大多采用此类炸药。
·三氯化铁:化学式FeCl3,黄色粉末,可由铁在氯气中燃烧制得,溶于水为黄褐色液体,用于化学试剂,遇苯酚会变为紫色,可用于鉴定苯酚的存在,也叫氯化铁。
三氯甲烷:见氯仿。
三碘甲烷:见碘仿。
烧碱:见氢氧化钠石墨:化学式C,一种结晶形碳,天然出产的矿物,呈钢灰色或黑色,质软,质软,具滑腻感。
有金属光泽,呈六方体,叶片状,密度2.25g·cm-3莫氏硬度为1,能导电,化学性质不活泼,耐腐蚀,与酸、碱不起作用,在空气或氧气中加强热生成二氧化碳,用作抗磨材料和润滑剂,并用于制造坩埚、电极和原子反应堆的减速剂,与锑粉、黏土混合用于制铅笔芯。
·石膏:一种无机化合物,化学式CaSO4·2H2O,透明结晶体,应用于医药、雕塑等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见有机物化学式
有机化学是关于碳基化合物的化学科学,常见有机物可以通过化学
式来表示其分子结构。
下面将介绍几种常见有机物及其化学式。
1. 甲烷(CH4)
甲烷是最简单的有机化合物,也是天然气的主要成分之一。
其化学
式为CH4,由一个碳原子与四个氢原子组成。
甲烷是一种无色、无味
的气体,主要用作燃料和化工原料。
2. 乙醇(C2H5OH)
乙醇是一种常见的醇类有机物,也称为酒精。
其化学式为C2H5OH,由两个碳原子、六个氢原子和一个氧原子组成。
乙醇是一种透明、无
色的液体,在医药、化妆品和溶剂等方面有广泛的应用。
3. 甲醛(CH2O)
甲醛是一种有机化合物,也是最简单的醛类化合物。
其化学式为
CH2O,由一个碳原子、两个氢原子和一个氧原子组成。
甲醛是一种无
色气体或液体,在工业中常用作防腐剂、消毒剂和纺织品整理剂。
4. 乙酸(CH3COOH)
乙酸是一种酸性有机化合物,常见的有机酸之一。
其化学式为
CH3COOH,由两个碳原子、四个氢原子和两个氧原子组成。
乙酸呈无
色液体,在制药、化妆品和食品行业有广泛的应用。
5. 苯(C6H6)
苯是一种芳香烃类有机化合物,由六个碳原子和六个氢原子组成。
其化学式为C6H6,苯是一种无色、有刺激性气味的液体,广泛用于制
造塑料、橡胶和染料等工业领域。
6. 丙酮(C3H6O)
丙酮是一种酮类有机化合物,其化学式为C3H6O,由三个碳原子、六个氢原子和一个氧原子组成。
丙酮是一种无色液体,在溶剂、化妆
品和药物制剂等方面有广泛的应用。
7. 乙烯(C2H4)
乙烯是一种烯烃类有机化合物,也称为乙烯烃。
其化学式为C2H4,由两个碳原子和四个氢原子组成。
乙烯是一种无色气体,是合成塑料
和橡胶的重要原料。
以上是几种常见的有机物及其化学式,我们可以通过化学式来了解
有机物的分子结构和化学性质。
有机化学在医药、化工、农业等领域
有广泛的应用,对人类的生活产生了巨大影响。
