第二章热力学基本定律
合集下载
热力学第二定律

3、卡诺循环为可逆循环,卡诺热机为可逆热机, 可逆过程-W值最大,因此所有工作于同样温 度的高温热源与低温热源间的热机以可逆热机 效率为最高。
练习:
1. 求工作于150C和25C两热源之间可逆热机的热机 效率。 2. 工作于500K和300K之间的可逆热机,对外作功 -W=100kJ,则应从高温热源吸热Q1和向低温热 源放热-Q2各为多少?
d(U - TS) δW'
A U TS
不可逆 T,V A W' 可 逆 恒温、恒容无非体积功过程: 不可逆 T,V A 0 dT,V A 0 可 逆
dT,V A δW'
2. 亥姆霍兹函数(自由能)
A U TS
状态函数,广延性质
单位:J或kJ
五、吉布斯自由能及其判据 1. 吉布斯自由能判据
Q1 Q2 T1 T2 Q1 T1
Q1 Q2 0 T1 T2
由卡诺循环可知:可逆热机热温商之和等于零
卡诺循环结论:
1、卡诺循环后系统复原,系统从高温热源吸热部 分转化为功,其余的热流向低温热源。热机效 率<1
2、卡诺热机效率只与热源的温度T1 、T2有关,两 热源温差越大,热机效率越高
对每个小卡诺循环:
p P
δQ1 δQ2 0 T1 T2
a b
δQi1 δQi2 T T i 1 2
0
图中绝热线ab部分是两个 相邻卡诺循环公用线,效 果正好抵消。 则折线ABCDA可代替原可逆循环ABCDA
δQr T 0
当取小卡诺循环无限多时折线与光滑曲线重合
§3-4 熵、亥姆霍兹自由能、吉布斯自由能 一、熵的定义与导出 二、熵变的计算 三、热力学第二定律的表达式 四、亥母霍兹自由能及其判据 五、吉布斯自由能及其判据 六、A和G的物理意义
练习:
1. 求工作于150C和25C两热源之间可逆热机的热机 效率。 2. 工作于500K和300K之间的可逆热机,对外作功 -W=100kJ,则应从高温热源吸热Q1和向低温热 源放热-Q2各为多少?
d(U - TS) δW'
A U TS
不可逆 T,V A W' 可 逆 恒温、恒容无非体积功过程: 不可逆 T,V A 0 dT,V A 0 可 逆
dT,V A δW'
2. 亥姆霍兹函数(自由能)
A U TS
状态函数,广延性质
单位:J或kJ
五、吉布斯自由能及其判据 1. 吉布斯自由能判据
Q1 Q2 T1 T2 Q1 T1
Q1 Q2 0 T1 T2
由卡诺循环可知:可逆热机热温商之和等于零
卡诺循环结论:
1、卡诺循环后系统复原,系统从高温热源吸热部 分转化为功,其余的热流向低温热源。热机效 率<1
2、卡诺热机效率只与热源的温度T1 、T2有关,两 热源温差越大,热机效率越高
对每个小卡诺循环:
p P
δQ1 δQ2 0 T1 T2
a b
δQi1 δQi2 T T i 1 2
0
图中绝热线ab部分是两个 相邻卡诺循环公用线,效 果正好抵消。 则折线ABCDA可代替原可逆循环ABCDA
δQr T 0
当取小卡诺循环无限多时折线与光滑曲线重合
§3-4 熵、亥姆霍兹自由能、吉布斯自由能 一、熵的定义与导出 二、熵变的计算 三、热力学第二定律的表达式 四、亥母霍兹自由能及其判据 五、吉布斯自由能及其判据 六、A和G的物理意义
第二章 热力学基本

热一律否定了 第一类永动机 热二律否定了 第二类永动机
t >100%不可能 t =100%不可能
热机的热效率最大能达到多少? 又与哪些因素有关?
§2.7 卡诺循环—理想可逆热机循环
(法国,S. Carnot,1824年提出)
q1
w
q2
1-2定温吸热过程, q1 = T1(s2-s1) 2-3绝热膨胀过程,对外作功w 3-4定温放热过程, q2 = T2(s2-s1) 4-1绝热压缩过程,对内作功
T T0
制冷
T2 s1 s2 s
逆向卡诺循环 热泵
q1 q1 T1 ( s2 s1 ) T1 w q1 q2 T1 ( s2 s1 ) T0 ( s2 s1 ) T1 T0
'
T1
q1 Rc
q2 T0
w
T1 ↑ T0 ↓
′↓ ′↓
1 T0 1 T1
归
纳: 1)自发过程有方向性; 2)自发过程的逆过程并非不可进行,而是不能自发进 行。若满足一定的附加条件,也是可以进行的; 3)并非所有不违反第一定律的过程均可进行。
自然界的自发过程多种多样,其方向性表现 各异,条件和限度不同
能不能找出共同的规律性?
能不能找到一个统一判据?
热力学第二定律
§2.6.2 热二律的表述与实质
热力学第二定律的各种说法是等效的。 克氏说法: 不可能使热量从低温物体传向高温物体而不引 起其他任何变化。 开—普说法: 不可能从单一热源取热并使之完全转变为功而 不产生其他影响。
表面上看,二者完全不同,实则是等效的。
可用反证法证明。
反证法: 假设论题不正确; 由此进行推理,推出与假设自相矛盾的结果; 得出结论,这样假设不对。即结论是正确的。
t >100%不可能 t =100%不可能
热机的热效率最大能达到多少? 又与哪些因素有关?
§2.7 卡诺循环—理想可逆热机循环
(法国,S. Carnot,1824年提出)
q1
w
q2
1-2定温吸热过程, q1 = T1(s2-s1) 2-3绝热膨胀过程,对外作功w 3-4定温放热过程, q2 = T2(s2-s1) 4-1绝热压缩过程,对内作功
T T0
制冷
T2 s1 s2 s
逆向卡诺循环 热泵
q1 q1 T1 ( s2 s1 ) T1 w q1 q2 T1 ( s2 s1 ) T0 ( s2 s1 ) T1 T0
'
T1
q1 Rc
q2 T0
w
T1 ↑ T0 ↓
′↓ ′↓
1 T0 1 T1
归
纳: 1)自发过程有方向性; 2)自发过程的逆过程并非不可进行,而是不能自发进 行。若满足一定的附加条件,也是可以进行的; 3)并非所有不违反第一定律的过程均可进行。
自然界的自发过程多种多样,其方向性表现 各异,条件和限度不同
能不能找出共同的规律性?
能不能找到一个统一判据?
热力学第二定律
§2.6.2 热二律的表述与实质
热力学第二定律的各种说法是等效的。 克氏说法: 不可能使热量从低温物体传向高温物体而不引 起其他任何变化。 开—普说法: 不可能从单一热源取热并使之完全转变为功而 不产生其他影响。
表面上看,二者完全不同,实则是等效的。
可用反证法证明。
反证法: 假设论题不正确; 由此进行推理,推出与假设自相矛盾的结果; 得出结论,这样假设不对。即结论是正确的。
《工程热力学》第二章—热力学基本定律

五、功量与热力过程直接相关
在既定的始、终状态之间,可以有许多过程途径。 在既定的始、终状态之间,可以有许多过程途径。不同 过程中的功量交换是完全不同的。 过程中的功量交换是完全不同的。即:功的大小除与过程的 有关——功 初、终状态有关外,还与描述过程的函数p=f(v)有关 终状态有关外,还与描述过程的函数 有关 功 过程量。 而不能用dw表示 是一个过程量 微元过程功只能用δw而不能用 表示, 是一个过程量。微元过程功只能用 而不能用 表示,即
在孤立系统中,能的形式可以相互转换, ● 在孤立系统中,能的形式可以相互转换,但能 的总量保持不变。 的总量保持不变。 第一类永动机是不可能制成的。 ● 第一类永动机是不可能制成的。 ● 工程热力学中常以热力系统为对象来研究能量 的传递、转换和守恒。 的传递、转换和守恒。 对任一热力系统,热力学第一定律可表述为: ● 对任一热力系统,热力学第一定律可表述为: 进入系统的能量 - 离开系统的能量 = 系统中储存能量的变化
无论哪一种情况, 无论哪一种情况,当系统与外界发生功量 交换时,总与系统本身所经历的过程有关。 交换时,总与系统本身所经历的过程有关。
三、功量交换的基本表达式
δW = F • dx
W = ∫ F ( x)dx
x1
x2
热力学最常见的功——容积功 容积功 热力学最常见的功
δW = F • dx = pA • dx = pdV
宏观位能(位能):系统在外力场作用下, ):系统在外力场作用下 ◆ 宏观位能(位能):系统在外力场作用下,相对于 某参考坐标系中某一位置所具有的能量。 某参考坐标系中某一位置所具有的能量。
E p = mgz
二、内能
储存于系统内部的能量称为内能 内能, ● 储存于系统内部的能量称为内能,内能与物质 的分子结构和微观运动形式有关。 的分子结构和微观运动形式有关。 ● 对于闭口系统来说,工质经历一个循环之后又 对于闭口系统来说, 回复到原来的状态, 回复到原来的状态,所以系统储存能量的变化为 零,即:进入系统的能量(吸热量)等于离开系 进入系统的能量(吸热量) 统的能量(对外做功量)。 统的能量(对外做功量)。
第二章 热力学第二定律

δ Qr δQ ir > ∴ δQr > δQ ir T T
p r ir B V A
δQir δQr ,故 dS > 又 dS = T T δQir δQr 将 dS = 与 dS > 合并, 合并, T T
得: d S
ir ≥ r
δQ T
第2定律的数学表达式 定律的数学表达式 T是环境还是系统温度? 是环境还是系统温度? 是环境还是系统温度
=C
n m
特点: 数学概率大;故体系自动 特点: >1, 大,数学概率大;故体系自动 , 从概率小的状态向概率大的状态移动, 从概率小的状态向概率大的状态移动,其逆过 程不可能自动实现. 程不可能自动实现.
二,规定熵
δQr nC p ,m = dT 定压下:dS = 定压下: T T
则: S = ∫T
T2
1
nC p ,m T
dT
T2 ln T1
理想气体: 理想气体: S
= nC
p ,m
δ 恒容可逆变温: ★ 恒容可逆变温: Qr = dUV
= nCV ,m dT
则: S = ∫T
T2
1
nC V ,m T
dT
理想气体: 理想气体: S
= nC V ,m
T2 ln T1
★可逆变T,p,V 可逆变 , ,
§4. 熵的物理意义和规定熵
一,熵的物理意义 理想气体等温混合熵变△ 理想气体等温混合熵变△mixS = - R∑nilnxi > 0 说明:混合后系统熵值大于混合前系统熵值; 说明:混合后系统熵值大于混合前系统熵值; 混合后: , 气体混在一起 不易区分,混乱; 气体混在一起, 混合后:A,B气体混在一起,不易区分,混乱; 混合前: , 气体分别放置 容易区分,有序; 气体分别放置, 混合前:A,B气体分别放置,容易区分,有序; 由教材中的例题可得: 由教材中的例题可得: 蒸发过程△ 例3.3 → 蒸发过程△S > 0,则同物质 Sg > Sl; , 升温过程△ 例3.5 → 升温过程△S > 0,则同物质 S高温>S低温; , 膨胀过程△ 例3.6 → 膨胀过程△S > 0,则同物质 S低压>S高压; , 结论: 结论:更混乱的状态熵值大于相对有序状态熵值
p r ir B V A
δQir δQr ,故 dS > 又 dS = T T δQir δQr 将 dS = 与 dS > 合并, 合并, T T
得: d S
ir ≥ r
δQ T
第2定律的数学表达式 定律的数学表达式 T是环境还是系统温度? 是环境还是系统温度? 是环境还是系统温度
=C
n m
特点: 数学概率大;故体系自动 特点: >1, 大,数学概率大;故体系自动 , 从概率小的状态向概率大的状态移动, 从概率小的状态向概率大的状态移动,其逆过 程不可能自动实现. 程不可能自动实现.
二,规定熵
δQr nC p ,m = dT 定压下:dS = 定压下: T T
则: S = ∫T
T2
1
nC p ,m T
dT
T2 ln T1
理想气体: 理想气体: S
= nC
p ,m
δ 恒容可逆变温: ★ 恒容可逆变温: Qr = dUV
= nCV ,m dT
则: S = ∫T
T2
1
nC V ,m T
dT
理想气体: 理想气体: S
= nC V ,m
T2 ln T1
★可逆变T,p,V 可逆变 , ,
§4. 熵的物理意义和规定熵
一,熵的物理意义 理想气体等温混合熵变△ 理想气体等温混合熵变△mixS = - R∑nilnxi > 0 说明:混合后系统熵值大于混合前系统熵值; 说明:混合后系统熵值大于混合前系统熵值; 混合后: , 气体混在一起 不易区分,混乱; 气体混在一起, 混合后:A,B气体混在一起,不易区分,混乱; 混合前: , 气体分别放置 容易区分,有序; 气体分别放置, 混合前:A,B气体分别放置,容易区分,有序; 由教材中的例题可得: 由教材中的例题可得: 蒸发过程△ 例3.3 → 蒸发过程△S > 0,则同物质 Sg > Sl; , 升温过程△ 例3.5 → 升温过程△S > 0,则同物质 S高温>S低温; , 膨胀过程△ 例3.6 → 膨胀过程△S > 0,则同物质 S低压>S高压; , 结论: 结论:更混乱的状态熵值大于相对有序状态熵值
热力学第二定律

3. 我们可根据“第二类永动机不可能造成”这一结论 来判断一指定过程的方向。 例如在任意一个过程中,令系统的状态先由A变 到B,再让它逆向进行,假若再由B变到A时将能构成 第二类永动机,则可断言,该系统由A变到B的过程是 自发的,而由B自动变到A是不可能的。 这样的判断方法太抽象,在考虑能否构成第二类 永动机时需要繁杂的手续和特殊的技巧,并且不能指 出过程进行的限度。在第二定律中最好能找到像热力 学第一定律中的内能U和焓H那样的热力学函数,只要 计算此函数的变化值,就可判断过程的方向和限度.
然而,随着对更多的反应进行研究,发现有 不少吸热反应仍能自动进行。例如: 高温下的水煤气反应: C(s) +H2O(g)→CO(g)+H2(g) 事实说明,热力学第一定律只有告诉人们一 化学反应的能量效应,但不能告诉人们在一 定条件下指定化学反应能否自动发生,以及 进行到什么程度为止,亦即不能解决化学变 化的方向、限度问题。
(2) 热由高温物体传向低温物体
设有高温热源T2及低温热源T1。其热容均为无 限大,现有Q2的热从高温热源T2传向低温热 源T1 。 环 境
Q=W
T2
Q’=Q2+W
Q2
W
机器
Q2 T1 T 1
(3) 镉放入氯化铅溶液变成氯化镉溶液和铅 Cd (s)+PbCl2(aq)=CdCl2(aq)+pb(s)
决定自发过程的方向和限度的因素是什么?
上述各类不同的过程有着不同的决定因素: 决定热传导方向及限度的因素是温度T; 决定气体流动方向及限度的因素是压力p; 决定电流方向及限度的因素是电压V。 决定化学反应方向和限度的因素是什么呢? 需要找出决定一切自发过程变化方向及限度的共 同因素,这个共同因素既能判断一切自发过程的方向 和限度,也能用来判断化学过程的方向及限度。这个 共同因素究竟是什么?这就是热力学第二定律所要解 决的中心课题。
工程热力学第二章

可逆
8
∫ pdv
q = ∫ Tds
条件
7
准静态或可逆
4、示功图与示热图 p W T Q
二、储存能
1、内部储存能——热力学能 储存于系统内部的能量, ,与系统内工质粒子的微 储存于系统内部的能量 观运动和粒子的空间位置有关。 观运动和粒子的空间位置有关。 分子动能( 分子动能(移动、 移动、转动、 转动、振动) 振动)T 分子位能( 分子位能(相互作用) 相互作用)V 核能 化学能
对推进功的说明
1、与宏观流动 与宏观流动有关 流动有关, 有关,流动停止, 流动停止,推进功不存在 2、作用过程中, 作用过程中,工质仅发生位置 工质仅发生位置变化 位置变化, 变化,无状 态变化 3、w推=p v与所处状态有关, 与所处状态有关,是状态量 4、并非工质本身的能量( 并非工质本身的能量(动能、 动能、位能) 位能)变化引 起,而由外界做出, 而由外界做出,流动工质所携带的能量 流动工质所携带的能量 可解为: 可理解为:由于工质的进出, 由于工质的进出,外界与系统之间 所传递的一种机械功 所传递的一种机械功, 机械功,表现为流动工质进出系 统使所携带 统使所携带和所 携带和所传递 和所传递的一种 传递的一种能量 的一种能量
15 16
三、焓
内能+流动功 焓的定义式 焓的定义式: 定义式:焓=内能+ 对于m 对于m千克工质: 千克工质: H = U + pV 对于1 对于1千克工质: 千克工质: h=u+ p v 焓的物理意义: 焓的物理意义: --对 --对流动工质 流动工质( 工质(开口系统 开口系统) 系统),表示沿流动方向传递 的总能量中, 的总能量中,取决于热力状态 取决于热力状态的那部分能量 热力状态的那部分能量. 的那部分能量. --对 --对不流动工质 不流动工质( 闭口系统) 焓只是一个复合状 工质(闭口系统 系统),焓只是一个复合状 态参数 思考: 思考:特别的对理想气体 h=f(T h=f(T) f(T) 17
8
∫ pdv
q = ∫ Tds
条件
7
准静态或可逆
4、示功图与示热图 p W T Q
二、储存能
1、内部储存能——热力学能 储存于系统内部的能量, ,与系统内工质粒子的微 储存于系统内部的能量 观运动和粒子的空间位置有关。 观运动和粒子的空间位置有关。 分子动能( 分子动能(移动、 移动、转动、 转动、振动) 振动)T 分子位能( 分子位能(相互作用) 相互作用)V 核能 化学能
对推进功的说明
1、与宏观流动 与宏观流动有关 流动有关, 有关,流动停止, 流动停止,推进功不存在 2、作用过程中, 作用过程中,工质仅发生位置 工质仅发生位置变化 位置变化, 变化,无状 态变化 3、w推=p v与所处状态有关, 与所处状态有关,是状态量 4、并非工质本身的能量( 并非工质本身的能量(动能、 动能、位能) 位能)变化引 起,而由外界做出, 而由外界做出,流动工质所携带的能量 流动工质所携带的能量 可解为: 可理解为:由于工质的进出, 由于工质的进出,外界与系统之间 所传递的一种机械功 所传递的一种机械功, 机械功,表现为流动工质进出系 统使所携带 统使所携带和所 携带和所传递 和所传递的一种 传递的一种能量 的一种能量
15 16
三、焓
内能+流动功 焓的定义式 焓的定义式: 定义式:焓=内能+ 对于m 对于m千克工质: 千克工质: H = U + pV 对于1 对于1千克工质: 千克工质: h=u+ p v 焓的物理意义: 焓的物理意义: --对 --对流动工质 流动工质( 工质(开口系统 开口系统) 系统),表示沿流动方向传递 的总能量中, 的总能量中,取决于热力状态 取决于热力状态的那部分能量 热力状态的那部分能量. 的那部分能量. --对 --对不流动工质 不流动工质( 闭口系统) 焓只是一个复合状 工质(闭口系统 系统),焓只是一个复合状 态参数 思考: 思考:特别的对理想气体 h=f(T h=f(T) f(T) 17
(NEW)毕明树《工程热力学》(第2版)笔记和课后习题详解

b.热力学摄氏温标
热力学摄氏温标,以符号t表示,单位为摄氏度,符号为℃。热力
学摄氏温度定义为
,即规定热力学温度的273.15K为摄氏温度
的零点。这两种温标的温度间隔完全相同(
)。这样,冰的三相
点为0.01℃,标准大气压下水的冰点也非常接近0℃,沸点也非常接近
100℃。
c.华氏温标
在国外,常用华氏温标(符号也为t,单位为华氏度,代号为℉)
量,压力计的指示值为工质绝对压力与压力计所处环境绝对压力之差。 一般情况下,压力计处于大气环境中,受到大气压力pb的作用,此时压 力计的示值即为工质绝对压力与大气压力之差。当工质绝对压力大于大 气压力时,压力计的示值称为表压力,以符号pg表示,可见
p=pg+pb (1-1-1) 当工质绝对压力小于大气压力时,压力计的示值称为真空度,以pv 表示。可见
(2)几种基本状态参数如下: ① 压力
压力是指沿垂直方向上作用在单位面积上的力。对于容器内的气态 工质来说,压力是大量气体分子作不规则运动时对器壁单位面积撞击作 用力的宏观统计结果。压力的方向总是垂直于容器内壁的。压力的单位 称为帕斯卡,符号是帕(Pa)。
作为描述工质所处状态的状态参数,压力是指工质的真实压力,称 为绝对压力,以符号p表示。压力通常由压力计(压力表或压差计)测
热力学的宏观研究方法,由于不涉及物质的微观结构和微粒的运动 规律,所以建立起来的热力学理论不能解释现象的本质及其发生的内部 原因。另外,宏观热力学给出的结果都是必要条件,而非充分条件。
(2)热力学的微观研究方法,认为大量粒子群的运动服从统计法则 和或然率法则。这种方法的热力学称为统计热力学或分子热力学。它从 物质的微观结构出发,从根本上观察和分析问题,预测和解释热现象的 本质及其内在原因。
热力学摄氏温标,以符号t表示,单位为摄氏度,符号为℃。热力
学摄氏温度定义为
,即规定热力学温度的273.15K为摄氏温度
的零点。这两种温标的温度间隔完全相同(
)。这样,冰的三相
点为0.01℃,标准大气压下水的冰点也非常接近0℃,沸点也非常接近
100℃。
c.华氏温标
在国外,常用华氏温标(符号也为t,单位为华氏度,代号为℉)
量,压力计的指示值为工质绝对压力与压力计所处环境绝对压力之差。 一般情况下,压力计处于大气环境中,受到大气压力pb的作用,此时压 力计的示值即为工质绝对压力与大气压力之差。当工质绝对压力大于大 气压力时,压力计的示值称为表压力,以符号pg表示,可见
p=pg+pb (1-1-1) 当工质绝对压力小于大气压力时,压力计的示值称为真空度,以pv 表示。可见
(2)几种基本状态参数如下: ① 压力
压力是指沿垂直方向上作用在单位面积上的力。对于容器内的气态 工质来说,压力是大量气体分子作不规则运动时对器壁单位面积撞击作 用力的宏观统计结果。压力的方向总是垂直于容器内壁的。压力的单位 称为帕斯卡,符号是帕(Pa)。
作为描述工质所处状态的状态参数,压力是指工质的真实压力,称 为绝对压力,以符号p表示。压力通常由压力计(压力表或压差计)测
热力学的宏观研究方法,由于不涉及物质的微观结构和微粒的运动 规律,所以建立起来的热力学理论不能解释现象的本质及其发生的内部 原因。另外,宏观热力学给出的结果都是必要条件,而非充分条件。
(2)热力学的微观研究方法,认为大量粒子群的运动服从统计法则 和或然率法则。这种方法的热力学称为统计热力学或分子热力学。它从 物质的微观结构出发,从根本上观察和分析问题,预测和解释热现象的 本质及其内在原因。
第2章热力学第一定律
热力学能又称为内能(internal energy),指体系 内部能量的总和,包括分子运动的平动能、转动能、 振动能、电子能、核能以及各种粒子之间的相互作 用势能等。以符号U表示,单位J。 ① 热力学能是状态函数,广度量; ② 热力学能的绝对值无法确定; ③ 单相、组成恒定、量定系统:U = f(T、V)
1、热力学的研究内容
经典热力学基本定律:
① 热力学第零定律: 热平衡定律(开尔文定律) ② 热力学第一定律: 能量转化与守恒定律 ③ 热力学第二定律: 判断过程的方向与限度 ④ 热力学第三定律: 计算规定熵
2、热力学研究方法及局限性
热力学研究方法:
以含有大量质点的宏观体系为研究对象,以两 个经典热力学定律为基础,用一系列热力学函数及
本堂课学习内容
§2.2
热力学第一定律
§2.3
恒容热、恒压热及焓
§2.2 热力学第一定律
1、热力学能(U) 2、热力学第一定律 3、焦耳实验
1、热力学能(thermodynamic energy)
•系统的总能量由以下三部分组成: ① 整体运动的动能;
② 在外力场中的势能;
③ 系统内部一切能量。 热力学研究对象为宏观静止体系,无整体运动; 并且一般没有特殊的外力场存在(电磁场、离心力场 等),因此只考虑系统内部能量。
4、热与功
•体积功(膨胀功)的计算:
W pamb dV
W PambdV
V1
V2
( 向真空膨胀: W 0 pamb 0)
恒容过程: W 0 dV 0) ( 恒外压过程: W Pamb (V2 V1 )
4、热与功
[例题] 300K下:
pamb p2 50kPa
1、热力学的研究内容
经典热力学基本定律:
① 热力学第零定律: 热平衡定律(开尔文定律) ② 热力学第一定律: 能量转化与守恒定律 ③ 热力学第二定律: 判断过程的方向与限度 ④ 热力学第三定律: 计算规定熵
2、热力学研究方法及局限性
热力学研究方法:
以含有大量质点的宏观体系为研究对象,以两 个经典热力学定律为基础,用一系列热力学函数及
本堂课学习内容
§2.2
热力学第一定律
§2.3
恒容热、恒压热及焓
§2.2 热力学第一定律
1、热力学能(U) 2、热力学第一定律 3、焦耳实验
1、热力学能(thermodynamic energy)
•系统的总能量由以下三部分组成: ① 整体运动的动能;
② 在外力场中的势能;
③ 系统内部一切能量。 热力学研究对象为宏观静止体系,无整体运动; 并且一般没有特殊的外力场存在(电磁场、离心力场 等),因此只考虑系统内部能量。
4、热与功
•体积功(膨胀功)的计算:
W pamb dV
W PambdV
V1
V2
( 向真空膨胀: W 0 pamb 0)
恒容过程: W 0 dV 0) ( 恒外压过程: W Pamb (V2 V1 )
4、热与功
[例题] 300K下:
pamb p2 50kPa
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
v
2
3、系统与外界交换的热量与功量不随时间改变,满足能量守恒
Q Const W net s Const W dE=0 s
一、开口系稳定流动能量方程的推导
u1 m1 1 c p1v1
2
2
1
gz1
Ws
Q
m2 1 p2v2
u2
2 c
2 2
gz2
进入系统的能量-离开系统的能量=系统内部总能量的变化 [Q + m1[u1 + p1v1 + c2/2 + gz] - [m2[u2 + p2v2 + c22/2 + gz2 + W s ]= dE
2.外部储存能
宏观动能 Ek= mc2/2 宏观位能 Ep= mgz
热力学能,内部储存能
机械能
热力系统的总能量=内部储存能+外部储存能 E = U + (Ek + Ep)
总能 宏观动能 宏观位能
外部储存能
热力系统单位质量工质具有的总能量
e = u + ek + ep
热力学能(内能)的说明: 热力学能(内能)是状态量 U : 广延参数 [ kJ ] u : 比参数 [kJ/kg] 内能总以变化量出现,内能零点人为定
§2-5
开口系稳定流动能量方程
不随时间变化(注意:不同截面参数可不同)
稳定流动:是指热力系统在任意截面上工质的一切参数都 稳定流动条件:
1、进出口处工质状态不随时间变化。 2、进出口处工质流量相等,且不随时间改变,满足质量守恒.
m m AC m
1 1 2
1
v
AC
2
2
3、并非工质本身的能量(动能、位能)变化引起,
而由外界(泵与风机)做出,流动工质所携带的能量
可理解为:流动工质进出系统使所携带和所
传递的一种能量。
3 轴功Ws
热力系通过叶轮机械的 轴和外界交换的功量称∽。
4 有用功Wu
凡是可以提升重物,驱 动机器的功统称为∽。如轴 功和电功。反之,则为无用 功 分析活塞汽缸系统中气体的作功问题
2
2
[Q + m1(u1 + c1 + gz1)] -[ m2(u2 + c22/2 + gz2) + Wtol] = dE
2/2
u2 gz2
热力学第一定律一般表达式又称开口系能量方程微分式
Q= dE + m2(u2 +c22/2 + gz2) m1(u1 +c12/2 + gz1) + Wtol 当有多条进出口:
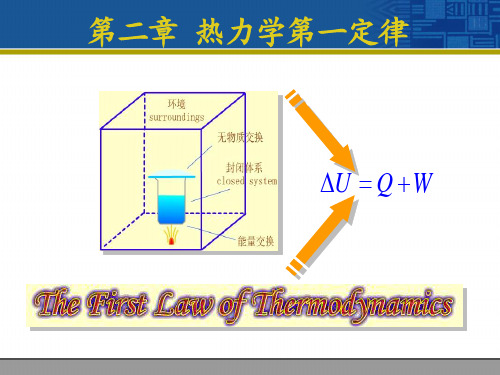
第二章 热力学基本定律
The First Law of Thermodynamics
§2-1 热力学第一定律
一、热力学第一定律实质 实质:能量守恒及转换定律在热过程中的应用 热力学第一定律的表述:
热能和机械能之间可以相互转移或转换,在转移或转换过程中 能量的总量必定守恒。
要想得到功,必须化费热能或其它能量
态的能量。
∴Q = dE + m2( u2 + h2p2v2 +c22/2 + gz2) m1( u1 + h1p1v1 +c12/2 + gz1) + Ws
开口系稳定流动能量方程推导
∴Q = dE + m2( u2 + p2v2 +c22/2 + gz2) h2 m1( u1 + h1p1v1 +c12/2 + gz1) + Ws
w dp
t 1 2
_____准静态下的技术功的计算式
准静态
q du pdv
_____热一律解析式之一 _____热一律解析式之二
q dh vdp
技术功在示功图上的表示
wt w p1v1 p2v2
wt dp pd p11 p22
以房间为系统 由闭口系能量方程 闭口系
Q U W
Q0
W 0
Q
U Q W
空 调
Q W
T
例 绝热自由膨胀
如图, 抽去隔板,求 U
解:取气体为热力系 —闭口系?开口系?
Q U W
Q0
? 0 W
U 0
即U1 U 2
结论:绝热自由膨胀,膨胀前后气体温度不变
热力学第一定律又可表述为“第一类永动机是不可能制成的”
二、热力学能(内能)和热力系统的总能量
1.内储存能(内能、热力学能) U _____ 代表储存 于系统内部的能量。 热力学能(内能)的微观组成:
移动动能
分子动能 热力学能(内能)U 分子位能 转动动能 振动动能
f 1 T
f 2 T , v
Q= dE + ∑m2(u2 +c22/2 + gz2) ∑m1(u1 +c12/2 + gz1) + Wtol
开口系能量方程
Q =dE + ∑(u2+ c22/2 + gz2) m2
- ∑(u1+ c12/2 + gz1) m1 + Wtol
2.闭口系能量方程
一般式
Q = dU + W
Q H Wt
q h wt
单位质量工质的开口系与闭口系
闭口系(1kg)
q u w
容积变化功
等价 技术功
ws
q
q h wt
开口系稳流
讨论闭口系与稳流开口系的能量方程
闭口系
q u w
稳流开口系 q h wt 容积变化功w 技术功wt 轴功ws
三、功和热量——迁移能
几种常用功的介绍
1.体积功(或膨胀功)W
——系统体积膨胀或压缩时与外界交换的功量。 可逆过程或准静态过程
W pdV
1
2
功量正负号规定: 系统膨胀对外界做功,功为正 W > 0 (即dV>0,膨胀) 外界对系统做功,功为负 W < 0 (即dV<0,压缩 )
2 流动功
dp 1 2 dc dz 0 g 2g
§ 2-6
稳定流动能量方程应用举例
q h c / 2 gz ws
2
稳定流动能量方程
热力学问题经常可忽略动、位能变化 例:c1 = 1 m/s c2 = 30 m/s (c22 - c12) / 2 = 0.449 kJ/ kg
压力降低,速度提高 速度降低,压力升高 动能参与转换,不能忽略
q h c / 2 gz ws
2 2
1
out
m 2 m out
u1 c / 2 gz1 m min 1 W net s h pv 1 1
2 1 in
Q mq
1kg工质
整理得
W s m ws
1 q h c 2 g z ws 2
开口系稳定流动能量方程:
1 2 q h c g z ws ___单位质量工质 2
δWu=δW-P0dV
P
P0 δWu P0dV
热力学第一定律的文字表达式
进入热力 系的能量
-
离开热力 系的能量
=
热力系内部总 能量的变化
§ 2-2 热力学第一定律的一般表达式
能量守恒原则
进入系统的能量
m1
uin
离开系统的能量
1 c 2
2
1
gz1
Wtol Q
m2
1 c 2
=
系统内部总能量的变化
1 2 wt c g z ws 2
∴
wswt
准静态下的技术功
w ( pv) wt
准静态
w d ( pv) wt
pdv d ( pv) wt
wt pdv d ( pv) pdv ( pdv vdp) vdp
wt vdp
1 1 2 2
12ba1
12341 140a1 230b 2
由功之间的关系推导机械能守恒定律
wt vdp dc / 2 gdz ws
对于流体流过管道, ws 0
1 2 vdp dc gdz 0 2
压力能 动能 位能
2
机械能守恒
伯努利方程
Bernoulli’s equation
Q dEcv c / 2 gz 0 / u2 2 h2pv 1 2 2
2 2 in
out
m 2 m out
2 u1 pv c h1 1 1 1 / 2 gz1 m min 1 W net s
开口系稳定流动能量方程推导
Q dEcv c / 2 gz2 0 / u2 h2pv 1 2 2
热一律解析式之一
2.简单可压缩闭口系可逆过程能量方程:
q = Tds
Tds = du + pdv
Tds u pd
1 1 2 2
门窗紧闭房间用电冰箱降温?
以房间为系统 由闭口系能量方程 绝热闭口系
Q U W
Q0
W 0
电 冰 箱
U W 0
T
门窗紧闭房间用空调降温
1 Q H mc mgZ W ___mkg工质 2
2 s
适用条件:
任何流动工质
任何稳定流动过程
技术功 Wt
