二元液系相图
实验D-7二元液系相图-基础化学实验中心

实验D-5 溶液的二元液系T-X图实验目的1.采用回流冷凝法测定不同浓度的二元液系的沸点和气液两相组成,绘制其沸点∽组成(t∽X)图(包括液体折射率工作曲线的绘制),并描述其相图特征,找出其恒沸点温度与组成。
2.用阿贝折光仪测量液体和蒸汽的组成。
了解液体折光率的测量原理和方法。
实验原理一个完全互溶双液体系的沸点∽组成图,表明在气液两相平衡时,沸点与气液两相组成的关系;它对于了解这一体系的性质及精馏过程都有很大的实用价值.在恒压下完全互溶的双液体系T∽X有下列三种情况:1.所有组成溶液沸点介于二纯组分沸点之间,如苯与甲苯(图D5-1A)。
2.有最高恒沸点,如卤化氢和水(图D5-1B)。
3.有最低恒沸点,如苯和乙醇(图D5-1C)。
A B C图D5-1 二元液系相图在图D5-1A中,A'LB'代表液相线,A'VB'代表气相线,等温水平线与气相线和液相线的交点分别代表在该温度时相互成平衡的气相和液相的组成.在图D5-1c中,绘制沸点∽组成图的原理说明如下:当总组成为X的溶液加热时,体系的温度沿着虚线上升,当温度达到T时(即和液相线相交时)溶液开始沸腾,此时平衡的气相组成为yV ,液相组成为X.温度升至Ti,气相组成为yi,液相组成为xi,在此相区f=C - P + 2式中:f为自由度;P为相数;C为组分数。
在本实验中C=2,在二相区(气、液二相),P = 2,∴f=2,由于压力指定(实验在恒压下进行)所以在二相区内f=l,因此,若指定温度则气液相浓度就不可改变,此时气、液两相的相对量亦不可变(服从杠杆原理);反之,若指定了气液相的相对量从而气液相组成一定,则沸点也确定了。
本实验采用后者使用Ellis平衡蒸馏仪利用回流方法保持气液两相相对量一定,测定平衡时的沸点,并分别收集气相冷凝液和液相的样品,用化学方法或物理方法分析其组成,这样在T—X图上可找到此沸点T1时互成平衡的液相组成Xl和气相组成yl。
二元相图(匀晶,共晶)(精)

三)固溶体的非平衡凝固
不平衡结晶的过程分析 假定:不平衡结晶时,液相成分借助扩散、对流或搅拌等 作用完全均匀化,固相内却来不及扩散。
三)固溶体的非平衡凝固
① 将各温度下固溶体和液相的平均成分点连接成线,得 到固溶体和液相的平均成分线。
② 不平衡凝固时,液固相在各温度时的相平衡成分仍然 在平衡凝固时的液固相线上,只是其平均成分线偏离 了平衡凝固时的液固相线。
四、杠杆定律
在二元合金相图的两相区内,温度一定时,两相的重量比是一定的。 合金成分为C0,总重量为1, 在T 温度时,由液相和固相组成,液 相的成分为CL,重量为WL,固 相成份为Cα,重量为Wα。
1 = WL +Wa
1 C0 WL CL W C
WL = Ca - C0 Wa C0 - CL
固溶体凝固与纯金属凝固的比较
固溶体的凝固与纯金属的凝固相比有两个显著特点:
⑴ 固溶体合金凝固时结晶出来的固相成分与原液相成分不 同。结晶出的晶体与母相化学成分不同的结晶称为异分结晶 (又称选择结晶);纯金属凝固结晶时结晶出的晶体与母相化 学成分完全一样称为同分结晶。
固溶体的结晶属于异分结晶,在结晶时的溶质原子必然要在 液相和固相之间重新分配。
的相图上有极小点;
在Pb-Tl、Al-Mn等合金的相图上 有极大点。
二)固溶体的平衡凝固
平衡凝固:从液态无限缓慢冷却,在相变过程中充分进行组元间互相 扩散,达到平衡相的均匀成分,这种凝固过程叫平衡凝固。
x合金凝固过程及组织
冷至T1时
开始凝固出α1成分的固相 α1中的含Ni量比x合金高, α1旁的液体中含Ni量降 低,扩散平衡后液体成分 为L1
一、 二元系相图的表示法
二元系物质有成分的变化,在反映它的 状态随成分、温度和压力变化时,必须用一 个坐标轴的三维立体相图。由于二元合金的 凝固是在一个大气压下进行,所以二元系相 图的表示多用一个温度坐标和一个成分坐标 表示,即用一个二维平面表示。
固-液二元体系相图PPT49页

51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
44、卓越的人、自己的饭量自己知道。——苏联
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
形成固溶体的二元系统相图
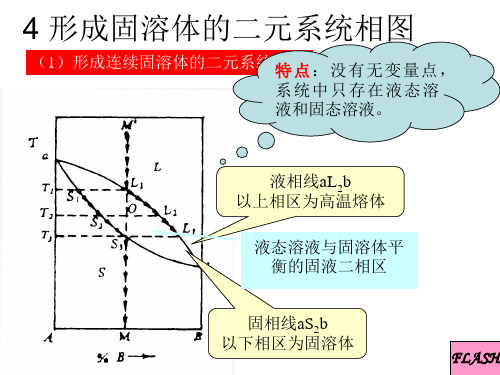
界线上任一点的切线与 相应连线的交点实际上 表示了该点液相的瞬时 析晶组成
瞬时析晶组成是指液 相冷却到该点温度, 从该点组成的液相中 所析出的晶相组成
21
(3) 重心规则
判断无变量点的性质
• 如无变量点处于其相应的副三角形的重心位,则该无变 量点为低共熔点;如无变量点处于其相应的副三角形的 交叉位,则为单转熔点;如无变量点处于其相应的副三 角形的共轭位,则为双转熔点。
f=1
E (L C+A+B, f = 0) 固相点 C F M FLASH
16
杠杆规则计算液相量和固相量
液相到达D点时:
固相量 CM 液相量 MD
固相量 CM 固液总量(原始配料量) CD 液相量 MD 固液总量(原始配料量) CD
17பைடு நூலகம்
2 生成一个一致熔融二元化合物
相当于 2 个简 单三元相图 的组合 • 在三元系统 中某二个组分 间生成的化合 物称为二元化 合物 • 二元化合物的 组成点在浓度 三角形的一条 边上 • 一致熔化合物 的组成点在其 初晶区内
2个固溶体
7条线 6个相区 3个无变量点
FLASH
2
析晶路程表示法
液相点
L S B ( A) L M’ L1 E LE S A( B ) S B ( A) , f 0 f=2 f=1
固相点
S1 D H
SB ( A)
SB ( A) S A( B )
着背离C的方向而变化。
9
二、杠杆规则
(1)在三元系统内,由两个相合成一个
新相时,新相的组成点必在原来二相
组成点的连线上;
(2)新相组成点与原来二相组成点的距 离和二相的量成正比。
10-2二元液系相图

二元液系相图一、实验目的1、测定环己烷-乙醇系统的沸点组成图(T-X图)2、掌握阿贝折光仪的使用方法二、实验原理1、一个完全互溶的二元系统的沸点-组成图,表明在气液二相平衡时,沸点和两相组成间的关系.2、在常温下,两种液态物质以任意比例相互溶解所组成的体系称之为完全互溶双液系。
完全互溶双液系在恒定压力下的沸点—组成图可分为三类:3、(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
4、(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1 (b)所示。
5、(3)最大正偏差:混合物存在着最低沸点,如正丙醇—水体系,如图1(c)所示。
BB B(a)(b)(c)本实验绘制环己烷-乙醇二元液系的T-X图。
其方法为将不同组成的溶液于蒸馏仪中进行蒸馏看,沸腾平衡后记下温度,一次吸取少量的蒸馏液和蒸出液。
分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率组成标准曲线或其数据表确定相应组成,从而绘制环已烷-乙醇二元液系相图。
三、实验仪器与试剂1、沸点测定仪1个;取样管12支;阿贝折光计1台;环己烷(分析纯);无水乙醇(分析纯);直流稳压电源1台四、实验步骤1、纯液体折光率的测定。
分别测定乙醇和环己烷的折光率。
2、工作曲线的绘制。
这有实验书所给定的数据进行绘制。
3、测定沸点-组成数据(1)安装沸点测定仪。
将干燥的沸点测定仪按图2-1安装图2-1好,检查带有温度计的橡皮塞是否塞紧。
加热用的电阻丝要靠近底部中心,温度计的水银球不能接触电阻丝,而且每次更换溶液后,要保证测定条件尽量平行(包括水银温度计和电阻丝的相对位置)。
(2)用老师粗略的配制好的20%,40% ,60% ,80%组成的环己烷-乙醇溶液约50ml。
(3)测定沸点及平衡的气液相组成。
取下塞子,加入所要测定的溶液(40ml),其液面以在水银球中部为宜。
接好加热线路,打开冷凝水,再接通电源。
调节直流稳压电源电压调节旋钮,使加热电压为10-15v,缓慢加热。
二元系相图ppt课件

3. 固溶体的不平衡结晶-D
枝晶偏析程度大小与铸造时冷却条件、原子的扩散能 力,相图形状有密切关系: (1) 在其它条件不变时,V冷越大,晶内偏析程度严重, 但得到枝晶较小。如果冷速极大,致使偏析来不及发 生,反而又能够得到成分均匀的铸态组织。 (2) 偏析元素在固溶体中扩散能力越小,相图上液、 固相线间距离的间隔愈大,形成树枝晶状偏析的倾向 愈大。 ❖ 要消除枝晶偏析采用均匀化退火(扩散退火) (diffusion annealing)。
固溶体的凝固与纯金属的凝固相比有两个显 著特点:
⑴.固溶体合金凝固时结晶出来的固相成分与 原液相成分不同。上述结晶出的晶体与母相化 学成分不同的结晶称为异分结晶(又称选择结 晶);纯金属凝固结晶时结晶出的晶体与母相 化学成分完全一样称为同分结晶
⑵.固溶体凝固需要一定的温度范围,在此温 度范围内,只能结晶出一定数量的固相。
❖ (3) 二元相图中的三相平衡必为一条水平线,表示恒温反 应。在这条水平线上存在3个表示平衡相的成分点,其中两 点在水平线两端,另一点在端点之间,水平线的上下方分别 与3个两相区相接。
❖ (4) 当两相区与单相区的分界线与三相等温线相交则分界 线的延长线应进入另一两相区内,而不会进入单相区。 15
第七章 二元系相图 及其合金凝固
1
本章要求
1. 几种基本相图: 匀晶相图(Cu-Ni合金相图)、 共 晶相图(Pb-Sn合金相图)、包晶相图(Pt-Ag合金 相图)。
2. 相律,杠杆定律及其应用。 3. 二元合金相图中的几种平衡反应: 共晶反应、共析反
应、包晶反应、包析反应 、偏晶反应、熔晶反应、合 晶反应。 4. 二元合金相图中合金的结晶转变过程及转变组织。 5. 熟练掌握Fe-Fe3C相图。熟悉Fe-C合金中各相与组织 的结构。会几种典型Fe-C合金的冷却过程分析 。熟练
二元系相图.ppt

2点以下固相冷却, 无组织变化
合金C冷却曲线及结晶过程示意图
t
L
L
t1
L+α
L→α
t2
α
α
C
A
B%
B
时间
(3)有极值的匀晶相图
a)具有极大点 b)具有极小点
Fe-Co、Co-Pb、Fe-Ni、Fe-V、Fe-W、 Mn-Co、Mn-Ni、Pb-Ti、V-W、Ti-Zr等。
wL CP w PD
理论上讲液相L和α相同时消耗完毕,得到单一 的β相晶体。
②合金Ⅱ(D~P间成分合金)
合金Ⅱ的平衡结晶过程示意图
α相的量比包晶反应时所需的量多,即
w
C 2 CD
CP CD
(包晶转变后α相有剩余)
室温平衡组织
③合金Ⅲ(P~C间成分合金)
根据相律 包晶反应时 F=0 此时三个平衡相的成分及反应温度都是确
定的。
(1)相图分析
固相线 固溶线
液相线
(1)相图分析
TACTB-液相线
TADPTB-固相线
DF-α固溶体溶解度曲线
PG-β固溶体溶解度曲线
DPC(水平线)- 包晶线 P-包晶点
相区:3个单相区 L, α, β
3个两相区 L+α,L+β, α+β
具有这类相图的合金系主要有Cu-Ni、Cu-Au、 Au-Ag、Mg-Cd、W-Mo等。
(1)相图分析
2条线: 液相线 固相线
2个单相区:固相区α 液相区L
1个两相区: L+α
A
T
液相线 L
α+L 固相线
13 实验五 二元液体溶液的气—液平衡相图
实验五 二元液态混合物的气-液平衡相图【目的要求】1.实验测定并绘制环己烷-乙醇体系的沸点组成(T -x )图,确定其恒沸点及恒沸混合物的组成。
2.了解测量折光率的原理,掌握阿贝折光仪的使用方法。
【实验原理】两种液体能在任意浓度范围内完全相溶的体系称完全互溶的双液体系。
根据相律:f =K Φ+2式中:f 为体系的自由度;K 为体系中的组分数;Φ为体系中的相数;2是指压力和温度两个变量。
对于定压下的二组分液态混合物,相律可表示为:f =3-Φ。
在大气压力下,液体的蒸气压和外压相等时,平衡温度即为沸点。
对于完全互溶的双液体系,当气液两相平衡时Φ=2,f =1。
完全互溶的双液体系在定压下并没有固定的沸点,为一沸程,并且是和溶液的组成有关的,即T 是x 的函数。
完全互溶的双液体系,由于两种液体的蒸气压不同,溶液上方的气相组成和液相组成是不相同的,测定溶液的沸点和溶液在沸点时的气相和液相的组成,可绘制出溶液的气-液平衡相图,即溶液的沸点与组成关系图,T -x -y 图。
完全互溶的双液体系,T -x -y 图可分三类:如图5-1所示。
图5-1(1)是理想液态混合物和偏离拉乌尔定律较小的体系的T -x -y 相图;图5-1(2)是对拉乌尔定律有较大正偏差的体系;图5-1(3)是对拉乌尔定律有较大负偏差的体系。
在图5-1(2)和图5-1(3)中,由于偏离拉乌尔定律较大以致在T -x -y 图上分别出现了最低点和最高点,在最低点和最高点上,液态混合物的气相组成和液相组成相同,这种组成的液态混合物称为恒沸混合物,在最高点和最低点上时液态混合物的沸点称为恒沸点。
将一定组成的环已烷-乙醇混合物在特制的蒸馏器中进行蒸馏。
当温度保持不变时,即表示气、液两相己达平衡,记下沸点温度,并测定沸点时气相(冷凝液)和液相的组成,Fig.5-1 二组分完全互溶双液体系的T -x -y 相图 (1)理想或近似理想的体系 (2)有最低恒沸点的体系 (3)有最高恒沸点的体系 Fig.5-1 Phase diagram for mixture of binary liquid(1)Ideal mixture (2)With minimum aezotropic point (3) With maximum aezotropic 液相Liquid 气相Gas T B x B (y B ) (3) M A B液相Liquid气相Gas T A T B x B (y B ) T (1) AB 液相Liquid 气相Gas T A T Bx B (y B ) (2) M A B T A图5-2 沸点仪示意图 1.温度计;2.接加热器;3.加液口;4.电热丝连接点;5.电热丝;6.分馏液;7.分馏液取样口 Fig.5-2 The sketch of ebulliometer 1.thermometer;2. connection pole;3. inlet orifice; 4. connection point of heater with wire;5.heater; 6. fractional liquid;7. sampling orifice 即可得到一组T -x -y 数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二元液系相图
一、实验目的
1.测定在常压下环己烷-乙醇的气液平衡相图。
2.掌握阿贝折射仪的使用方法。
二、实验原理
在恒压下,完全互溶双液体系的沸点与成分关系有下列三种情况:
(1)溶液的沸点介于二纯组分沸点之间;
(2)溶液有最高恒沸点,即对拉乌尔定律发生负偏差的溶液;(3)溶液有最低恒沸点,即对拉乌尔定律发生正偏差的溶液
图1 简单完全互溶双液系的T-x图
图2 具有最高恒沸点的T-x图
图3 具有最低恒沸点的T-x图
配制一系列不同组成的环己烷—乙醇溶液,然后测定其相应的折光率,由此可绘出组成—折射率的标准曲线。
测定混合液近似组成所对应的液相和气相折射率,通过标准曲线可以查出该温度下气液二相平衡时折射率所对应的环己烷组成,通过此方法再找出其他混合液近似组成的折射率所对应的环己烷组成,这样测得若干组数据后,以环己烷的组成x为横坐标,温度T为竖坐标作图,将气相点和液相点用光滑的曲线连成气相线和液相线,即得T-x图。
气液组成的折光率可用阿贝折射仪来测定。
三、仪器与试剂
阿贝折射仪,铁架台,沸点测量仪,沸点仪, 50mL量筒一个,
10mL刻度移液管各2支、试剂瓶若干、,长取液管,短取液管。
环己烷,无水乙醇,重蒸馏水,80%、60%、40%、20%环己烷—乙醇标准混合液。
四、实验步骤
先分别测定纯组分的折光率。
工作曲线的测定:测定折射率与组成的关系:使用阿贝折射仪测量纯环己烷,纯乙醇,80%、60%、40%、20%环己烷—-乙醇标准混合液相应的折射率。
以折射率对组成作图,即可绘制工作曲线。
溶液的配制。
粗略配制环己烷的体积百分数分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9等组成的环己烷—乙醇溶液约100ml。
放入编号为1-9的容器内待测。
测定沸点及平衡的气—液相组成。
取下塞子,将1号待测液加入蒸馏瓶,盖好瓶塞,使电热丝侵入液体中,温度传感器与液面接触,将沸点测量仪用冷凝管夹固定,接通自来水。
将恒流电源的连接线与沸点测量仪的电热丝相连,接通沸点测量仪电源,接通电热丝加热至沸腾,待数字温度计上读数恒定后,读下该温度值,即为样品的沸点,关闭电源停止加热。
将干燥的长取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液分析样,迅速用阿贝折射仪测其折光率。
用擦镜纸把阿贝折射仪的镜面擦干,用干燥的短取液管取液相混合物,用阿贝折射仪测其折光率,取下连接线,关闭自来水,取出温度传感器。
测完气、液相折光率后,将混合物从磨口倒回原试剂瓶中,不必弄干蒸馏瓶,继续取下一号混合液进行实验。
直到做完为止。
整理仪器。
五、数据记录与处理
室温:24.6℃大气压:100.70kPa
表1 环己烷-乙醇标准溶液的折光率
环己烷
00.10.20.30.40.50.60.70.80.91
摩尔分数
折光率 1.3625 1.3665 1.3700 1.3755 1.3860 1.3885 1.4015 1.4025 1.4125 1.4210 1.4225根据表1绘制工作曲线,即为图4。
图 4 环己烷摩尔分数与折光率的关系曲线
测定沸点及平衡的气—液相组成记录如下:
表2 不同组成的环己烷-
乙醇溶液的折光率
混合液编号
混合液近似组成 沸点
气相分析
液相分析 V b/%
折射率
V b /%
折射率
V b /%
1 0.0 77.9 1.3630
2 0.1 75.
3 1.371 0.17492 1.3637 0.0642
4 3 0.2 73.4 1.373
5 0.23878 1.3695 0.22459 4 0.3 69.5 1.3755 0.23878 1.3745 0.22459 5 0.4 65.1 1.3975 0.55095 1.3782 0.27709
6 0.5 64.
7 1.4005 0.59352 1.3853 0.37784 7 0.6 66.5 1.4014 0.6063 1.3925 0.48001
8 0.7 69.2 1.4024 0.6204
9 1.3995 0.57933 9 0.8 73.2 1.4114 0.6063 1.4195 0.86313 10 0.9 75.8 1.4121 0.61623
1.4226 0.90712
11 1.0 80.2 1.4260
绘制双液系相图,如图5。
图5 环己烷-乙醇双液系相图
由图所知:最低恒沸点为64.2℃,组成为0.4914。
六、注意事项
1.加热电阻丝一定要被待测液体浸没,否则通电加热时可能会
引起有机液体燃烧;所加电压不能太大,加热丝上有小气泡逸出即可;温度计的水银球不要直接碰到加热丝。
2. 一定要使体系达到气液平衡,即温度读数要稳定,然后再取样;先停止通电再取样。
3. 注意保护阿贝折射仪的棱镜,不能用硬物触及(如滴管),擦拭棱镜需用擦镜纸。
4.每次测定前,取样管和折射仪棱镜玻璃面必须用洗耳球吹干,否则将严重影响测定结果。
七、思考题
1、本实验不测纯环己烷、纯乙醇的沸点,而直接用下的数据,这样会带来什么误差?
答:不同压力下的沸点不相同,会给实验偶然误差。
2、待测溶液的浓度是否需要精确计量?为什么?
答:不需要,待测溶液经实验测的沸点、气相折光率、液相折光率后可从图一中找到待测溶液的浓度(含环己烷),故不需要精确计量。
3、如果要测纯环己烷、纯乙醇的沸点,蒸馏瓶必须洗净,而且烘干,而测混合液沸点和组成时,蒸馏瓶则不洗也不烘,为什么?
答:测试纯样时,如沸点仪不干净,所测得沸点就不是纯样的沸点。
测试混合样时,其沸点和气、液组成都是实验直接测定的,绘制图像时只需要这几个数据,并不需要测试样的准确组成,也跟式样的量无关。
