蛋白质二级结构及其英文缩写
蛋白质二级结构
Secondary Structure of Proteins
蛋白质具有唯一的化学结构
一个经典蛋白质的共价骨架含有数百个化学 键,由于围绕这些化学键发生的可能的自由 旋转,蛋白质分子可能有无限个空间构象。 然而每个蛋白质具有一种特定的化学或结构 上的功能,表明每一种蛋白质只有一个唯一 的三维结构。1920s后期,几种蛋白质被结晶, 包括血红蛋白(Mr 64500)和脲酶(Mr 48300),表明多数蛋白质能被结晶,即使非 常大的蛋白质也能形成唯一的结构,支持蛋 白质结构和功能之间的必然关系。
Each peptide bond has some double-bond character due to resonance and cannot rotate.
相邻氨基酸残基的-碳原子被3个共价键隔开
六个原子(-Cα—CO—NH—Cα-)基本上同处于一个平面,这 就是肽键平面。肽链中能够旋转的只有α碳原子所形成的单键, 此单键的旋转决定两个肽键平面的位置关系,于是肽键平面成 为肽链盘曲折叠的基本单位。
生理条件下,蛋白质分子氢和离子键的
形成主要是由相同熵效应所驱动的。极性基团 与水形成氢键,溶解于水。然而对于每个单位 质量(unit mass)的氢键的数量,纯水的要比其他 液体或溶液的要大。所以即使是最强极性的分 子,它的溶解性也是有限度的,因为它们的存 在导致了每个单位质量氢键的净减少。因此极 性分子的周围会形成一个结构化了的水的水化 层(solvation shell)。尽管在一个大分子内两个极 性基团形成的分子间的氢键或离子键作用的自 由能主要被消除相同基团与水之间的这种相互 作用所抵消,但在分子间相互作用形成时,结 构化了的水的释放提供了一个折叠所需要的熵 的驱动力。
ftir 蛋白质二级结构

ftir 蛋白质二级结构FTIR 蛋白质二级结构是利用傅里叶变换红外光谱仪(FTIR) 技术研究蛋白质分子的组成、结构和功能。
这种技术已经成为生物化学、生物物理学和生物医学科学领域中广泛使用的基本工具,有助于更好地理解蛋白质的二级结构的组成及其在生命过程中的作用。
蛋白质是构成生物体的主要化学成分之一,它们是由氨基酸组成的长链多肽。
按照其三维结构的组成,蛋白质可以分为四级结构,从一级到四级分别为:氨基酸序列、二级结构、三级结构和四级结构。
其中,二级结构指的是蛋白质分子中氢键连接的局部折叠,如α-螺旋、β-折叠等。
这种结构在蛋白质分子的稳定性和功能中起着至关重要的作用。
FTIR 技术是一种非常强大的工具,可以对蛋白质样品进行精确的结构分析,不仅可以确定蛋白质的二级结构成分,而且可以研究蛋白质分子的构象变化、折叠、聚集和降解等反应。
FTIR 技术的优点在于,它能够直接测量分子中的化学键的振动频率和强度,从而比其他技术更加灵敏,能够提供更加准确的结构信息。
使用 FTIR 技术分析蛋白质的二级结构时,会发现不同的氨基酸序列和二级结构成分具有独特的红外光谱特征。
例如,与α-螺旋相比,β-折叠的特征峰位置更加靠近高波数端,这是因为β-折叠的氢键相对较弱,所以峰位更靠近且部分重叠。
通过分析这些光谱特征,可以确定蛋白质样品中不同二级结构组成的含量,并进一步研究二级结构的变化和作用。
在实际应用中,FTIR 技术已经被广泛应用于许多领域,例如生物医学、药物研发和生物技术等。
在药物研发中,FTIR 技术可以帮助研究人员确定药物和载体的相互作用,同时也可用于药物与蛋白质相互作用的研究。
在生物技术领域中,FTIR 技术可用于分析蛋白质的二级结构、定量分析蛋白质组分、研究与蛋白质相互作用的分子等。
需要注意的是,FTIR 技术的分析结果往往受到多种因素的影响,如样品预处理、光谱采集条件等。
因此,在使用 FTIR 技术进行蛋白质二级结构研究时,需要进行标准化的实验操作和数据处理,以保证测量结果的可靠性和准确性。
3.3 蛋白质的二级结构

常见超 二级结 构类型
发卡
超二级结构的主要类型 (1)αα 是 一种α螺旋束,如由两股 平行或反平行排列的右手 螺旋段互相缠绕而成的左 手卷曲螺旋(coiled coil) 或称超螺旋; 是α-角蛋白(纤维蛋白 原)、肌球蛋白、原肌球 蛋白的主要结构构件
(2)β αβ 最简单的βαβ组合 又称βαβ 单元
(4)影响α螺旋稳定的因素: ① Pro由于-亚氨基上的H参与肽键形成后,再 无H参与链内氢键形成而使螺旋中断; Gly由于无侧链的约束,也不利于-螺旋形成。 ②R基团较大(如Phe、Trp),特别是β-碳原子 上具有分支(如Ile、Leu、Val、Thr )不利于形 成-螺旋。 ③连续存在带相同电荷基团的残基时,同性电 荷相斥,如Glu和Asp、Lys和Arg。
♦ Gly 和 Pro 往往出现在β转角部位;
(--Gly残基侧链为H原子,能很好地调整其他残基的 空间位阻,适于充当多肽链大幅度转向的成员;Pro残 基的环状侧链的固定取向有利于转角的形成)
♦ β转角有利于反平行β折叠的形成。
(2)3种类型:以Ⅰ型转角更为常见
Ⅰ型
Ⅱ型
5. 无规卷曲(random coil)—又称自由回转
变性的实质:蛋白质分子中的次级键被破坏, 引起天然构象解体。 *蛋白质变性学说,我国生物化学家吴宪在1931 年提出。 天然蛋白质分子因环境的种种关系,从有序而 紧密的结构,变为无序而松散的结构,这就是 变性。
他认为天然蛋白质的紧密结构以及晶体结构是 由分子中的次级键维系的,所以容易被物理的 和化学的因素所破坏。
B. -碳原子总是处于折叠的角上,氨基酸的R基 团交替分布在片层的两侧。C-C 键(即侧链) 几乎垂直于折叠片平面。
生物化学名词解释

蛋白质1.两性离子(dipolarion)2.必需氨基酸(essential amino acid)3.等电点(isoelectric point,pI)4.稀有氨基酸(rare amino acid)5.非蛋白质氨基酸(nonprotein amino acid)6.构型(configuration)7.蛋白质的一级结构(protein primary structure)8.构象(conformation)9.蛋白质的二级结构(protein secondary structure)10.结构域(domain)11.蛋白质的三级结构(protein tertiary structure)12.氢键(hydrogen bond)13.蛋白质的四级结构(protein quaternary structure)14.离子键(ionic bond)15.超二级结构(super-secondary structure)16.疏水键(hydrophobic bond)17.范德华力( van der Waals force)18.盐析(salting out)19.盐溶(salting in)20.蛋白质的变性(denaturation)21.蛋白质的复性(renaturation)22.蛋白质的沉淀作用(precipitation)23.凝胶电泳(gel electrophoresis)24.层析(chromatography)1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
2.必需氨基酸:指人体(和其它哺乳动物)自身不能合成,机体又必需,需要从饮食中获得的氨基酸。
3. 氨基酸的等电点:指氨基酸的正离子浓度和负离子浓度相等时的pH值,用符号pI表示。
4.稀有氨基酸:指存在于蛋白质中的20种常见氨基酸以外的其它罕见氨基酸,它们是正常氨基酸的衍生物。
5.非蛋白质氨基酸:指不存在于蛋白质分子中而以游离状态和结合状态存在于生物体的各种组织和细胞的氨基酸。
生物化学—蛋白质的二级结构

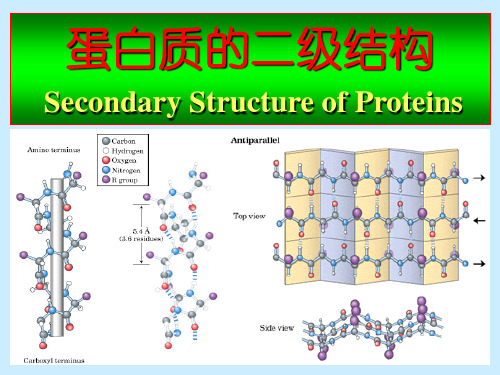
四、二级结构的类型 (一)-螺旋(-helix)
肽链由于氨基酸残基氨基氢和它后面第四个残基上的 羰基氧之间形成氢键,呈周期性规则的螺旋状构象, 即-螺旋。
-螺旋主要特点:
1. 每圈螺旋含3.6个氨基酸残基,沿螺旋 方向上升0.54nm;
2. -螺旋中氨基酸残基侧链伸向外侧;
3. -螺旋靠氢键维持,氢键的取向几乎 与中心轴平行;
第二节 蛋白质的二级结构 (secondary structure)
一、蛋白质二级结构定义
指多肽链借助氢键排列成沿一维方向 具有周期性结构的构象。
二、研究蛋白质构象的方法 (一) X-射线衍射技术(X-ray diffraction method)
X-射线( = 0.154nm) 蛋白质晶体(0.5 mm) 原子水平
(二)核磁共振 (Nuclear magnetic resonance,NMR) 在原子水平,蛋白质溶液 蛋白质浓度(15 mg/ml)
三、多肽链折叠的空间限制 (一)二面角(dihedral angle)
在多肽链的主链结构中,与C相连的两 个单键可绕键轴旋角 度用 表示。这两个旋转角度叫二面角。
4. -螺旋为右手螺旋。
一对二面角决定了相邻两个肽单位的构象。
(二)Ramachandran 构象图
理论推测 依据: 非键合原子之间的接触距离(范德华半径)
用作横坐标, 作纵坐标, 作图表示哪 些成对二面角所规定的两个相邻肽单位的 构象是允许的,哪些是不允许的,这个 - 图,就是Ramachandran 构象图
从该图可以看出,肽链的折叠具有相当大 的局限性。
ncbi蛋白质序列的二级结构

ncbi蛋白质序列的二级结构
NCBI(National Center for Biotechnology Information)是一个提供生物医学和基因组学信息的数据库,它包含了大量的蛋白质序列数据。
蛋白质的二级结构是指蛋白质分子中由氨基酸残基之间的氢键和其他非共价键形成的空间结构。
NCBI数据库中的蛋白质序列可以通过一些工具和算法来预测其二级结构。
一种常用的预测蛋白质二级结构的方法是利用基于序列的预测算法,例如PSIPRED和JPred。
这些算法使用蛋白质序列的氨基酸组成来预测其可能的二级结构,包括α-螺旋、β-折叠和无规卷曲等。
这些预测结果可以在NCBI数据库中的相关蛋白质条目中找到。
另一种方法是利用实验技术,如X射线晶体学和核磁共振等,来直接解析蛋白质的二级结构。
这些实验技术可以提供更准确和直接的二级结构信息,但需要耗费大量时间和资源。
总的来说,NCBI数据库中的蛋白质序列可以通过预测算法和实验技术来研究其二级结构。
这些信息对于理解蛋白质的功能和结构具有重要意义,有助于生物医学和基因组学领域的研究和应用。
生物化学2.6.2 蛋白质的超二级结构以及三级、四级结构

羧肽酶
(b)
腺苷酸激酶
2.结构域(structure domain)
结构域: 多肽链在二级结构或超二级结构的基础上形成三级
结构的折叠区,这种相对独立的紧密球状实体就是结构域 (structure domain)或简称域(domain)。
★ 结构域是多肽链的独立折叠单位,
一般由100-200个氨基酸残基构成
主讲教师:尹春光
蛋白质的空间结构:
α-螺旋 β-折叠 β-转角 无规卷曲
1.超二级结构(super secondary structure):
超二级结构 • 由若干个相邻的二级结构单元(α-螺旋、β-折叠、β-转角
及无规卷曲)组合在一起,彼此相互作用,形成有规则的、 在空间上能够辨认的二级结构组合体 。
• 疏水相互作用力、氢 键、范德华力、盐键
氢键
范德华力
疏水相互作用
离子键
稳定蛋白质空间
范德华力 离子键
四. 蛋白质的四级结构
亚基: • 自然界很多蛋白质是以独立折叠的球状多肽链
聚集体形式存在,这些具有三级结构的多肽链 称为亚基。
四. 蛋白质的四级结构
蛋白质四级结构(quaternary stucture): • 亚基通过非共价键相互作用彼此缔合在一起 ,亚基的
缔合方式或组织方式称为蛋白质四级结构(quaternary stucture)。
超二级结构基本类型 • αα;ββ;βαβ;
(1)αα结构(复绕α-螺旋)
(2)βxβ结构(βαβ)
x:无规卷曲 x:α-螺旋
(3)α-螺旋-β转角- α-螺旋
超二级结构
αα
β×β
βαβ(两个:Rossman折叠)
蛋白质二级结构名词解释

蛋白质二级结构名词解释蛋白质的二级结构名词解释不对称性二级结构蛋白质分子两端存在不同的碱基序列,每条链都含有4个碱基对。
又叫不对称性二级结构。
这种二级结构存在于许多病毒中,如流感病毒。
1、氨基酸在N-位碳原子上有1个或2个天冬酰胺残基,故命名为天冬酰胺(Glycine, -NH2)型残基,简称为α-NH2。
天冬酰胺残基的数目愈少,蛋白质的α-氨基酸残基愈少。
2、天冬酰胺型残基主要存在于谷类蛋白质、丝心蛋白质、球蛋白质等多肽和一些血红蛋白、肌红蛋白等蛋白质中。
3、当N-位上只有1个天冬酰胺残基时,则称为单-NH2残基。
此类型蛋白质多见于动物蛋白质。
在N-位上有2个天冬酰胺残基,但其中一个残基不是天冬酰胺残基,称为双-NH2残基。
4、氨基酸的侧链含有一个环状羟基(如天冬氨酸),使氨基酸之间发生氢键而形成不同长度的不对称二级结构。
在一定的溶剂中这些不对称二级结构可用多级折叠形式表现出来。
5、一条多肽链上有2个或2个以上的亚基时,则各亚基以N-或C-交替方式连接,每个亚基称为亚基1(sub-chain1,常为N-chain1)或亚基2(sub-chain2,常为C-chain2),当有几个亚基时,则分别称为1、 2亚基。
不对称二级结构蛋白质亚基1与2一般称为同多肽链的手性碳原子。
8、蛋白质的N-末端与蛋白质中含有可作为识别信号和特殊功能的肽段有关。
9、结构域在手性的β-折叠片层结构中,除了具有折叠轴和多肽链间的交联外,还有蛋白质分子中的亚基。
10、带电荷的肽段有手性的区域称为手性区。
11、带电荷的肽段能改变它周围蛋白质分子的性质。
12、蛋白质二级结构受微小范围内的不对称性的影响。
13、在非对称性二级结构蛋白质分子中,由于每个氨基酸残基在多肽链上的排列顺序不同,引起二级结构上的差异,称为蛋白质的手性,即它的旋光性。
14、某些肽段具有较高的亲水性,相反的是一些带有极性的疏水区域。
15、蛋白质的手性既可以是原子序数上的手性,也可以是构象上的手性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质二级结构及其英文缩写
蛋白质是生命体内最基本的组成部分之一,其二级结构是指由蛋白质
分子内部氢键作用形成的空间结构,通常包括α-螺旋,β-折叠和β-转角。
这三种结构对于蛋白质分子的稳定性和功能具有重要作用。
其中,α-螺旋是一种紧密卷曲成直线的结构,具有很高的稳定性和可延展性;β-折叠是由相邻蛋白质链残基之间的氢键形成的平面折叠结构,形状
如多边形;β-转角是一种连接两个β-折叠的结构,常常出现在蛋白质
结构中较为多样的部分。
α-螺旋的英文缩写为α-helix;β-折叠的英文缩写为β-sheet;β-转角的英文缩写为β-turn。
总的来说,蛋白质二级结构对于蛋白质分子的结构和功能具有很大的
影响,因此研究蛋白质的二级结构是生物学和生物化学研究领域中的
一个重要方向。
随着技术的不断进步和研究的深入,对蛋白质二级结
构的认识也会日益深入,为生命科学的发展和生物技术的应用提供更
加扎实的基础。
