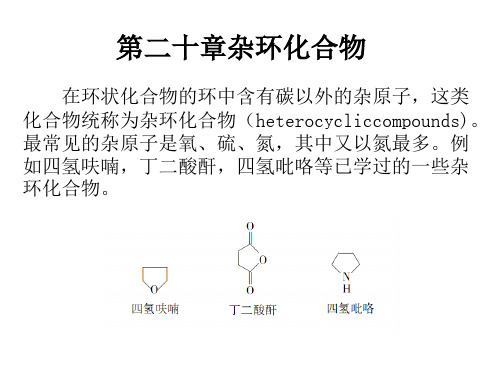
第二十章 杂环化合物
合集下载
杂环化合物和生物碱学时讲课文档

(A)
第二十五页,共46页。
4. 氧化反应
CH3 HN3O
COOH
N
or KM4nO
N
β-吡啶甲酸
HN3O
COOH
or KM 4 nO
N
N COOH
2, 3-吡啶二甲酸
第二十六页,共46页。
完成下列合成:
CH3 N
KMnO4/H+
NH 2 N
NaOH Br 2
COOH NH3
N
CONH 2 N
第二十七页,共46页。
第二十九页,共46页。
红色
2. 吡咯及其衍生物
吡咯最重要的衍生物是卟啉化合物。
2
a
3
1
4
NH N
N HN
8
5
7
6
卟啉环
第三十页,共46页。
叶绿素:
CH
2
H 3C 1 Ⅰ N
3R
Ⅱ N
4 C H 2C H 3
Mg
N
H 3C
Ⅳ
H8 7 HH
H 2C O C
CH2
OC O
N Ⅲ
5
CH3
6
Ⅴ
O
OCH3
R = -C H 3 为 叶 绿 素 a R = -C H O 为 叶 绿 素 b
N
异烟酰肼又叫雷米封 具有抗结核作用
N
异丙烟肼
用于神经退行性疾病治疗
(老年痴呆等)
C2H OH
CHO
C2H N2H
H O
C2H OH H O
C2H OHH O
C2H OH
H 3C N
H 3C N
维生素B6
第三十六页,共46页。
有机化学课件--第二十章杂环化合物

N H
1
S
1
N
f u r a np y r r o l et h i o p h e n e p y r i d i n e
呋 喃 吡 咯噻 吩吡 啶
1
N H indole
吲哚
1
N
quinoline 喹啉
2019/8/23
课件
7
2. 杂环及环上取代基的编号 (1) 母体杂环的编号:杂原子的编号为“1”。
2019/8/23
课件
11
二、呋喃、噻吩、吡咯杂环的化学性质
1.亲电取代反应 从结构上分析,五元杂环为Π 56共轭体系,电
荷密度比苯大,发生亲电取代反应的速度也比苯快 得多。 如以苯环上碳原子的电荷密度为标准(作为 0),则五元杂环化合物的有效电荷分布为:
0
0
0
0
0
0
- 0.02
- 0.03
O
+0.1
DMF, POCl3
N H
20-30℃
吡啶 SO3 N H
NO2
N H CHO
N H SO3H
N H
3-硝基吲哚 3-吲哚甲醛 3-吲哚磺酸
含吲哚的生物碱广泛存在于植物中, 如麦角碱、马钱子碱、利血平等
2019/8/23
课件
34
C H 2C O O H
β -吲 哚 乙 酸 ( 植 物 生 长 调 节 剂 ) N H
CH3I O
△ N
CH3 N-甲 基 吡 咯
CH3CCl
△ N
COCH3 N-乙 酰 基 吡 咯
C H C l3/KO H
CHO N H α-吡 咯 甲 醛
课件
N
CH3
1
S
1
N
f u r a np y r r o l et h i o p h e n e p y r i d i n e
呋 喃 吡 咯噻 吩吡 啶
1
N H indole
吲哚
1
N
quinoline 喹啉
2019/8/23
课件
7
2. 杂环及环上取代基的编号 (1) 母体杂环的编号:杂原子的编号为“1”。
2019/8/23
课件
11
二、呋喃、噻吩、吡咯杂环的化学性质
1.亲电取代反应 从结构上分析,五元杂环为Π 56共轭体系,电
荷密度比苯大,发生亲电取代反应的速度也比苯快 得多。 如以苯环上碳原子的电荷密度为标准(作为 0),则五元杂环化合物的有效电荷分布为:
0
0
0
0
0
0
- 0.02
- 0.03
O
+0.1
DMF, POCl3
N H
20-30℃
吡啶 SO3 N H
NO2
N H CHO
N H SO3H
N H
3-硝基吲哚 3-吲哚甲醛 3-吲哚磺酸
含吲哚的生物碱广泛存在于植物中, 如麦角碱、马钱子碱、利血平等
2019/8/23
课件
34
C H 2C O O H
β -吲 哚 乙 酸 ( 植 物 生 长 调 节 剂 ) N H
CH3I O
△ N
CH3 N-甲 基 吡 咯
CH3CCl
△ N
COCH3 N-乙 酰 基 吡 咯
C H C l3/KO H
CHO N H α-吡 咯 甲 醛
课件
N
CH3
Chap20、21-杂环、脂类、氨基酸

第二十章杂环化合物1、命名下列化合物。
2、指出下列化合物的分子结构中各有哪些杂环。
3. 下列化合物发生亲电取代反应速度最快的是哪一个?
4. 比较下列化合物的酸碱性。
(1)乙胺、氨、苯胺、吡啶、吡咯
(2)六氢吡啶、吡啶、嘧啶、吡咯
5. 比较下列各化合物中不同氮原子的碱性强弱。
第二十一章脂类、氨基酸
1、选择题
1)组成蛋白质的氨基酸,除甘氨酸外,都是()
A、D-构型
B、S-构型
C、L-构型
D、R-构型
2)水合茚三酮和下列哪个化合物显紫色()
A、吡咯
B、3-氨基丙酸
C、氨基乙酸
D、葡萄糖
3)将点样端置于负极,在pH=7.6的缓冲溶液中通以直流电,在正极可能得到的是()
A、丝氨酸(pI=5.68)
B、精氨酸(pI=10.76)
C、组氨酸(pI=7.59)
D、赖氨酸(pI=9.74)
4)天冬氨酸(pI=2.77)在pH=10.0的溶液中,其主要存在形式是()
5)某氨基酸的pI是10.5,其水溶液呈()
A、强酸性
B、碱性
C、中性
D、弱酸性
6)油脂的碘值大小可以判断油脂的(),
油脂的皂化值大小可以判断油脂的()。
A、活泼性
B、平均相对分子质量
C、不饱和度
D、相对含量
7)油脂没有恒定的熔点是由于()
A、油脂是混甘油酯
B、油脂是单甘油酯
C、油脂是混甘油酯的混合物
D、油脂易酸败
8)维生素A为动物生长发育所必须,人体缺乏它,会导致夜盲症。
它属于()A、单萜B、倍半萜
C、双萜
D、三萜
9) 下列属于甾族化合物的是()。
李艳梅有机化学-20 杂环化合物

SO
4
(CH
H
2
oC
CO)
3
H
25
95 %
PO
3
O
2
4
S SO3H
O S
CH3
20.2.2.2 加成反应
1、催化加氢
N2/Ni O
N2/Ni S
N2/Ni N H
N2/Ni
O
O
N2/Ni
S
S
N2/Ni
N
N
H
H
2、Diels-Alder反应
+ O
+ S
O
30oC
O
O
O
100oC
O
High pressure
氧(杂)茂
O
氮(杂)茂
N H
茂 硫(杂)茂
S
氮苯
N
N N
1,4-二氮苯
1,2-二氮苯
N N
N N
1,3-二氮苯
N 2-氮萘 萘 1-氮萘
N
环上只有一个杂原子时,有时也把靠近杂原子的位置叫α位,其 次是β位,再次为γ位。
β α O
β α
O
γ β α
N
γ β
Nα
20.1.3 杂环化合物的结构
1.44Å 1.35Å
N+ N
H
SO3
C2H4Cl2 3 days, r.t.
100oC
HCl
O SO3 N H
HCl
N SO3 N
H
H
+
C2H4Cl2
S
N
r.t.
SO3
Ba(OH)2
S SO3 Ba2+ 2
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
有机化学 杂环化合物

2)五员芳杂环的加成反应
(1)催化加氢
H2 / Ni O O
THF(常用的有 机溶剂) 吡咯烷:一个仲胺
使用特殊催化剂(噻
H2 / Ni N H N H
N i/H 2 脱S
S
H2 / MoS2 S
吩能使常用氢化催 化剂中毒)
(2)Dields-Alder反应
O O + O O O O O O
3) 吡咯的弱酸性
H
N
N
H
A
§15.3 含一个杂原子六员芳杂环(吡啶)
H C H C C H C H C
孤对电子
H
N
I) 符合Hückel规则 II) 吡啶环电子云分布不如苯均匀,吡啶环上的碳原子电 子云密度较苯低,氮原子附近电子云密度较大诱导效应和共轭 效应一致 III)可以质子化,具有碱性,易溶于水
一、吡啶的碱性和亲核性
2
86%
N SO3
H+
+
O r. t. O S O 3H H O 3S O S O 3H
41%
15%
•噻吩活性大,较稳定:可直接用硫酸磺化
H 2S O 4 S r. t. S SO 3H
应用:从煤焦油中得到的苯含噻吩,利用 该反应将其除去
+
H 2S O 4 S (少量) 反应快 S S O 3H r. t.
N
吲哚 indole
5
N
7
N
3
4
N
8 9
H 嘌呤 purine
四、杂环命名的标氢
饱和原子为最低编号H 作字首
O
O
4H-吡 喃
2H-吡 喃
6 1N 2
5
第二十章杂环化合物
Sn + HCl
N
或 Na+C2H5OH
N H
三、合成
•命名:音译法(带“口”旁的同音汉字) 命名:音译法( 命名 旁的同音汉字) •编号: (杂环上有取代基时),从杂原子算起 编号: 杂环上有取代基时), ),从杂原子算起 编号 依次用1, , , , 编号。( 依次用 ,2,3,4,5…编号。( ,β, 编号。(α, , γ…则从杂原子相邻的碳原子依次编号) 则从杂原子相邻的碳原子依次编号) 则从杂原子相邻的碳原子依次编号 如杂环上不止一个杂原子时,则从O、 、 如杂环上不止一个杂原子时,则从 、S、 N顺序编号。编号时杂原子的位次数字之 顺序编号。 顺序编号 和应最小
20.6 喹啉和异喹啉
一、结构 二、化学性质 1. 弱碱性
7 2.亲电取代(类似于硝基萘 6 亲电取代( 亲电取代 5 8
NO2 1 2 3 4
)
5 6 7 8 5 6 7 8
4 3 N 2 1 4 3 N2 1
亲电体进入5,8-位 位 亲电体进入
3. 亲核取代:主要发生在吡啶环(2或4位) 亲核取代:主要发生在吡啶环( 或 位 4. 氧化反应: (苯环被氧化) 氧化反应: 苯环被氧化) 5. 还原反应: (吡啶环被还原) 还原反应: 吡啶环被还原)
+ CH3COOH
N
+ N O
或 N O
(3)还原反应:吡啶对还原剂比苯环活泼 )还原反应:
N
+ 6[H]
H2
Na + C2H5OH
N H
N H
Pt 乙乙
N
0.1MPa,室室 室
4. 吡啶环上的亲核取代反应 吡啶环由于电子密度低,易与 发生亲核取代, 吡啶环由于电子密度低,易与Nu-发生亲核取代, 取代在α-位发生 取代在 位发生 若两个α-位已有基团,则发生在 位 若两个 位已有基团,则发生在γ-位 位已有基团
N
或 Na+C2H5OH
N H
三、合成
•命名:音译法(带“口”旁的同音汉字) 命名:音译法( 命名 旁的同音汉字) •编号: (杂环上有取代基时),从杂原子算起 编号: 杂环上有取代基时), ),从杂原子算起 编号 依次用1, , , , 编号。( 依次用 ,2,3,4,5…编号。( ,β, 编号。(α, , γ…则从杂原子相邻的碳原子依次编号) 则从杂原子相邻的碳原子依次编号) 则从杂原子相邻的碳原子依次编号 如杂环上不止一个杂原子时,则从O、 、 如杂环上不止一个杂原子时,则从 、S、 N顺序编号。编号时杂原子的位次数字之 顺序编号。 顺序编号 和应最小
20.6 喹啉和异喹啉
一、结构 二、化学性质 1. 弱碱性
7 2.亲电取代(类似于硝基萘 6 亲电取代( 亲电取代 5 8
NO2 1 2 3 4
)
5 6 7 8 5 6 7 8
4 3 N 2 1 4 3 N2 1
亲电体进入5,8-位 位 亲电体进入
3. 亲核取代:主要发生在吡啶环(2或4位) 亲核取代:主要发生在吡啶环( 或 位 4. 氧化反应: (苯环被氧化) 氧化反应: 苯环被氧化) 5. 还原反应: (吡啶环被还原) 还原反应: 吡啶环被还原)
+ CH3COOH
N
+ N O
或 N O
(3)还原反应:吡啶对还原剂比苯环活泼 )还原反应:
N
+ 6[H]
H2
Na + C2H5OH
N H
N H
Pt 乙乙
N
0.1MPa,室室 室
4. 吡啶环上的亲核取代反应 吡啶环由于电子密度低,易与 发生亲核取代, 吡啶环由于电子密度低,易与Nu-发生亲核取代, 取代在α-位发生 取代在 位发生 若两个α-位已有基团,则发生在 位 若两个 位已有基团,则发生在γ-位 位已有基团
第二十章 杂环化合物
• 由取代反应的中间体稳定性分析
a. 取代在 位
E N 位 E N H N H E N
E H
-H+ N E
正电荷在电负性大的 原子上,不稳定
b. 取代在 位
中间体较为稳定
c. 取代在 位
E E N 位 N N N H E H E H
正电荷在电负性大的原子上,不稳定
环上有给电子基时反应相对较易进行
2位(6位)取代产 物为主,4位很少。
C、氧化、还原反应 吡啶抗氧化能力比苯强,氧化时只氧化环上侧链得到相应 的吡啶甲酸。
N KMnO4 HOOC N
N N CH3
HNO3 N
COOH
NH3 N
CONH2
过氧化氢或过氧酸氧化得到N-氧化物
CH3 N
30% H2O2 CH3COOH
CH3 N O
• N-氧化吡啶的性质:比吡啶易与亲电试剂或亲核试剂反应
5、重要的衍生物
(1)糠醛(2-呋喃甲醛)
[H] O NaOH O NaCN O
CHO (CH3CO)2O CH3COONa CH2OH
COONa O
+ O
CH2OH
OH CH
O
C
O
O
C C COOH H H
[O] O
COOH
O
CHO
Cl2
Cl
O
CHO
O
CHO
HNO3 H2SO4 + CH3COCH3
(a) 与亲电试剂的亲电取代,产物在γ位
NO2 发烟HNO3 N O 发烟H2SO4 90 C
o
NO2 PCl3 + N POCl3
N O
主要产物
杂环化合物和生物碱-有机化学
溶解1份吡咯、呋喃及噻吩,分别需要17、 35、700份的水。 当五元杂环上连有羟基时,溶解度增大。
如: O
H3C O OH
S
S
OH
(1:35)
(1:20)
(1:700)
(1:16)
3. 杂环化合物的化学性质 (1)、亲电取代反 应
N H O S
HNO3
I2 NaOH
吡咯、呋喃、噻吩 α位取代
I
第四节 稠杂环化合物
稠杂环化合物是指苯环与杂环稠合或杂环与杂环稠合在一起的化 合物。常见的有喹啉、吲哚和嘌呤。
泳衣品牌
3 2 d ★ c
N
a b
N
1
N
★ b 2 a 3
N1
S
N
吡啶并[2,3-d]嘧啶
咪唑并[2,1-b] 噻唑
第二节
五元杂环化合物
五元杂环化合物包括含有1个杂原子的五元杂 环和含2个杂原子的五元杂环。 一、含1个杂原子的五元杂环化合物 1.结构
4 5 1N 3 2
4 5 3 2 4 5 3 2
OH
2.亲电取代反应
Cl2, AlCl 3 100 ℃ Br2, 浮石催化 300 ℃ 气相
Cl
3 氯吡啶
N
Br
3 溴吡啶
N
NO2
N
浓 H2SO4 HgSO4 催化, ℃ 220 混酸 300 ℃
3 硝基吡啶
N
SO3H
吡啶 3 磺酸
N
3.氧化还原反应
(1)氧化反应
COOH N β 吡啶甲酸(烟酸) HNO 3 N COOH N α 吡啶甲酸
由于吡啶环的N上在环外有一孤对电子,故吡啶环上的电荷分布不均。
有机化学精品课件——杂环化合物
杂环化合物在材料科学中具有广泛的应用,因为它们可以提供优良的物理和化学性能。例如,聚酰亚胺、聚醚醚酮等杂环高分子材料在航空航天、电子和汽车等领域广泛应用。
杂环化合物作为材料合成的关键组分,能够提高材料的耐热性、耐腐蚀性和机械性能等,同时降低生产成本和提高生产效率。
杂环化合物的研究进展与展望
05
在亲电反应机理中,试剂的性质和杂环化合物上的取代基的性质都会影响反应的进程和产物的生成。因此,在选择合适的试剂和反应条件时,需要考虑这些因素。
亲核反应机理是指反应过程中,试剂首先进攻杂环化合物上的电子云密度较高的部位,从而形成负碳离子中间体。然后,负碳离子中间体再与试剂发生反应,形成新的键,最终生成产物。
杂环化合物的应用
04
杂环化合物在药物合成中具有广泛的应用,因为它们具有独特的化学结构和生物活性。例如,嘧啶衍生物在抗肿瘤药物中发挥重要作用,喹啉衍生物具有抗菌和抗癌活性。
杂环化合物作为药物合成中的关键中间体,可用于合成多种类型的药物,如抗高血压药物、抗病毒药物和抗癌药物等。
VS
杂环化合物在农药合成中具有不可替代的地位,因为它们可以提供高效、低毒、低残留的农药。例如,吡啶衍生物可用于合成除草剂和杀虫剂,嘧啶衍生物可用于合成杀菌剂和杀虫剂。
杂环化合物作为农药合成的关键组分,能够提高农药的生物活性、选择性和稳定性,从而降低对环境和人体的危害。
杂环化合物在染料合成中具有重要作用,因为它们可以提供鲜艳的色彩和优良的染色性能。例如,偶氮染料和酞菁染料等杂环染料在纺织品、皮革和纸张等领域广泛应用。
杂环化合物作为染料合成的关键组分,能够提高染料的色牢度和稳定性,同时降低生产成本和对环境的污染。
杂环化合物的物理性质与其结构密切相关,如熔点、沸点、溶解度等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生侧链氧化,生成吡啶甲酸,而不是苯甲酸。
N
KMnO4 N
COOH
△
γ-吡啶甲酸
CH2CH3
HNO3
△
N
COOH N
β-吡啶甲酸
HNO3
COOH
△
COOH
N
N
α,β- 吡啶二甲酸
4.吡咯和吡啶的酸碱性 含氮化合物的碱性强弱主要取决于氮原子上未共用电子对与 H+的结合能力。在吡咯分 子中,由于氮原子上的未共用电子对参与环的共轭体系,使氮原子上电子云密度降低,吸 引 H+的能力减弱。另一方面,由于这种 p-π共轭效应使与氮原子相连的氢原子有离解成 H+的可能,所以吡咯不但不显碱性,反而呈弱酸性,可与碱金属、氢氧化钾或氢氧化钠作 用生成盐。
N ..
..
.N
吡啶的结构
在吡啶分子中,由于氮原子的电负性比碳大,表现出吸电子诱导效应,使吡啶环上碳 原子的电子云密度相对降低,因此环中碳原子的电子云密度相对地小于苯中碳原子的电子 云密度,所以此类杂环称为缺电子芳杂环或缺π电子芳杂环。
富电子芳杂环与缺电子芳杂环在化学性质上有较明显的差异。
第三节 杂环化合物的化学性质
+ B r2
浓H2SO4
Br + H B r
N
300℃
N
β-溴代吡啶
(2)硝化反应 在强酸作用下,呋喃与吡咯很容易开环形成聚合物,因此不能象苯 那样用一般的方法进行硝化。五元杂环的硝化,一般用比较温和的非质子硝化剂——乙酰 基硝酸酯(CH3COONO2)和在低温度下进行,硝基主要进入α-位。
O
+
CH3COONO2
要的溶剂。四氢吡咯具有二级胺的性质。
呋喃的芳香性最弱,显示出共轭双烯的性质,与顺丁烯二酸酐能发生双烯合成反应(狄
尔斯-阿尔德反应),产率较高。
O
O
+
O
O
25℃
OO
O
O
3.氧化反应
呋喃和吡咯对氧化剂很敏感,在空气中就能被氧化,环被破坏。噻吩相对要稳定些。
吡啶对氧化剂相当稳定,比苯还难氧化。例如,吡啶的烃基衍生物在强氧化剂作用下只发
杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。 译音法是根据 IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同 音汉字来表示环状化合物。例如:
N
N
N
O
呋喃 furan
N H
咪唑 imidazole
N
吡啶 pyridine
NN H
嘌呤
purine
杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子
开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为 1,并
使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。
例如:
4
3
H3C 5
2 CH3
O1
H3C 4
N3
5
2
N1
H
H3C
4
N3
H3C
5
S1
2
2,5-二甲基呋喃
4 –甲基咪唑
4,5–二甲基噻唑
当只有 1 个杂原子时,也可用希腊字母编号,靠近杂原子的第一个位置是α-位,其次
在同一平面上。与吡咯不同的是,氮原子的三个未成对电子,两个处于 sp2 轨道中,与相
邻碳原子形成σ键,另一个处在 p 轨道中,与 5 个碳原子的 p 轨道平行,侧面重叠形成一 个闭合的共轭体系。氮原子尚有一对未共用电子对,处. 在 sp2. 杂化轨道中与环共平面。如
图所示。吡啶符合休克尔规则,所以吡啶具有芳香. 性。
杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体 的生长、发育、遗传和衰亡过程都起着关键性的作用。例如:在动、植物体内起着重要生理 作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。 一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。
+ Br2
O
+ Br2
S
1,4-二氧 六 环
+ HBr
室温
O
Br
α-溴代呋喃
HA c
+ HBr
Br
S
α-溴代噻唑
吡咯极易卤代,例如与碘-碘化钾溶液作用,生成的不是一元取代产物,而是四碘吡咯。
I
+ 4 I2 KI
I
+
HI
4
HN
I
N H
I
2,3,4,5-四碘吡咯
吡啶的卤代反应比苯难,不但需要催化剂,而且要在较高温度下进行。
为β-位、γ-位等。例如:
β
α CHO O
CH3
γ β
Nα
α-呋喃甲醛
γ-甲基吡啶
当环上连有不同取代基时,编号根据顺序规则及最低系列原则。结构复杂的杂环化合
物是将杂环当 做取代基来命名。例如:
C2H5
CH3
O
2-甲基-5-乙基呋喃
COOH
O2N
CHO
N
O
4-吡啶甲酸
5-硝基-2-呋喃甲醛
O C CH3 N
+ ( C H3C O )2O
BF3
O
+
COCH3 O
CH3COOH
α-乙酰基呋喃
+ ( C H 3 C O )2 O 200 c
N H
︒
+
COCH3 CH3COOH N H
α-乙酰基吡咯
2.加成反应
呋喃、噻吩、吡咯均可进行催化加氢反应,产物是失去芳香性的饱和杂环化合物。呋
喃、吡咯可用一般催化剂还原。噻吩中的硫能使催化剂中毒,不能用催化氢化的方法还原,
H 2-乙酰基吡咯
稠杂环的编号一般和稠环芳烃相同,但有少数稠杂环有特殊的编号顺序。例如:
4 5
6 7
3 2
HN 1
吲哚
5 6
7
8
4 3
N2
1
异喹啉
6
1N
5
N7
2
N
4
8
N9
3
H
嘌呤
OH
1N 6 5
N7
2
HO
8
N
3
4
N9
H
OH
2,6,8-三羟基嘌呤
系统命名法是根据相应的碳环为母体而命名,把杂环化合物看作相应碳环中的碳原子 被杂原子取代后的产物。命名时,化学介词为“杂”字,称为“某杂某”。例如,五元杂 O 环相应的碳环为 ,定名为“茂”,则 称为氧杂茂;茂中的“戊”表示五元环,草 头表示具有芳香性。系统命名法能反映出化合物的结构特点。
噻吩对酸比较稳定,室温下可与浓硫酸发生磺化反应。
S
+ H 2 S O 4 25℃
S
+
SO3H
H2O
α-噻吩磺酸
吡啶在硫酸汞催化和加热的条件下才能发生磺化反应。
+
H 2 S O 4 HgSO4
SO3H + H 2 O
>200℃
N
N
β-吡啶磺酸
(4)傅-克反应 傅氏酰基化反应常采用较温和的催化剂如 SnCl4、BF3 等,对活性较 大的吡咯可不用催化剂,直接用酸酐酰化。吡啶一般不进行傅氏酰基化反应。
需使用特殊催化剂。吡啶比苯易还原,如金属钠和乙醇就可使其氢化。
+
2 H2
Ni
O
O
四氢呋喃
+
2 H2 MoS2
S
四氢S噻吩
+
2 H2 Pd
N H
N 四氢吡H 咯(吡咯烷)
Na+ C2H5OH
N
N H
六氢吡啶
喹啉催化加氢,氢加在杂环上,说明杂环比苯环易被还原。
+ 2 H2 Pt
N
N
H
四氢喹啉
四氢呋喃在有机合成上是重要的溶剂。四氢噻吩可氧化成砜或亚砜,四亚甲基砜是重
第二十章 杂环化合物
杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介 绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提 取方法和重要的生物碱。
环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构, 则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂 原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容 易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。
第二节 杂环化合物的结构
1.呋喃、噻吩、吡咯 五元杂环化合物中最重要的是呋喃、噻吩、吡咯及它们的衍生物。
..
..
..
O. .
S. .
NH
呋喃
噻吩
吡咯
从这三种杂环化合物的结构式上看,它们似乎应具有共轭二烯烃的性质,但实验表明,
它们的许多化学性质类似于苯,不具有典型二烯烃的加成反应,而是易发生取代反应。
子分布在由 5 个原子组成的分子轨道中),使环上碳原子的电子云密度增加,因此环中碳
原子的电子云密度相对地大于苯中碳原子的电子云密度,所以此类杂环称为富电子芳杂环
或多π电子芳杂环。
杂原子氧、硫、氮的电负性比碳原子大,使环上电子云密度分布不象苯环那样均匀,
所以呋喃、噻吩、吡咯分子中各原子间的键长并不完全相等,因此芳香性比苯差。由于杂
+
KOH N H
+
H2O N K+
吡啶氮原子上的未共电子对不参与环共轭体系,能与 H+结合成盐,所以吡啶显弱碱性, 比苯胺碱性强,但比脂肪胺及氨的碱性弱得多。
+
HCl N
N+ Cl H
第四节 与生物有关的杂环化合物及其衍生物
