苯甲酸的制备
苯甲酸的制备

目的:巩固烷基侧链的氧化反应;练习减压过滤操作。 目的:巩固烷基侧链的氧化反应;练习减压过滤操作。 原理: 原理:
CH3 COOK
+ #43; KOH + H2O
COOK
COOH
+ HCl
+
KCl
装置: 装置:
抽滤装置 反应装置
步骤: 步骤: 反应 250 mL三颈瓶中加入 三颈瓶中加入2.7 mL甲苯和 甲苯和100 mL水, 瓶口装一冷凝管 加热至 三颈瓶中加入 甲苯和 水 瓶口装一冷凝管, 高锰酸钾, 沸。从冷凝管上口分批加入8.5g高锰酸钾 每次加料不宜多 整个加料过程约 从冷凝管上口分批加入 高锰酸钾 每次加料不宜多, 最后用少量水(约 需60分钟.最后用少量水 约25mL)将粘在冷凝管内壁的高锰酸钾冲洗入烧瓶 分钟 最后用少量水 将粘在冷凝管内壁的高锰酸钾冲洗入烧瓶 继续煮沸并间歇摇动烧瓶直到甲苯层消失, 内.继续煮沸并间歇摇动烧瓶直到甲苯层消失 回流液不再有明显油珠。 继续煮沸并间歇摇动烧瓶直到甲苯层消失 回流液不再有明显油珠。 纯化: 纯化: 若溶液显较深的紫色, 加入少量亚硫酸氢钠, 若溶液显较深的紫色 加入少量亚硫酸氢钠 振摇使紫色褪去后趁热将 反应混合物减压过滤,用少量热水洗涤残渣。将滤液放在冷水浴中冷却 反应混合物减压过滤 用少量热水洗涤残渣。将滤液放在冷水浴中冷却, 用 用少量热水洗涤残渣 苯甲酸全部沉淀析出为止。 浓盐酸酸化直至溶液呈强酸性,苯甲酸全部沉淀析出为止。抽滤 用少量冷 苯甲酸全部沉淀析出为止 抽滤, 水洗涤, 尽量抽干, 把苯甲酸在表面皿上摊开, 晾干;称重 称重。 水洗涤 尽量抽干 把苯甲酸在表面皿上摊开 晾干 称重。粗产品可用热水 重结晶。 重结晶。
注意事项: 注意事项: 1) 高锰酸钾要分批加入; 高锰酸钾要分批加入; 2)高锰酸钾不能粘在管壁上; )高锰酸钾不能粘在管壁上; 3)控制反应速度; )控制反应速度; 4)酸化要彻底; )酸化要彻底; 5)尽量抽干 )
苯甲酸制备

苯甲酸制备一.设计思想苯甲酸是一种可作为食品饲料防腐剂,醇酸树脂和聚酰胺的改造剂,医药和染料中间体的精细化学品,工业生产以甲苯液相空气氧化法为主,在实验室制备主要采用甲苯高锰酸钾氧化法,实验过程中存在反应持续时间长,产率低等问题。
〈3〉以苯甲醛为原料进行歧化反应可制得苯甲酸与苯甲醇,但该制备实验基本操作较多,包括萃取洗涤干燥蒸馏重结晶等,实验最终产品既有固体又有液体,能够全面反映基本操作技能,但是该方法用时长,实验效率不高。
〈5〉高锰酸钾是水溶性试剂,难与油溶性试剂甲苯反应,在十六烷基三甲基溴化铵为催化剂的条件下实现甲苯的高锰酸钾氧化具有良好的转化效果。
〈4〉Monsanto公司开发了利用二乙醇胺催化脱氢制备氨基二乙醇钠的方法,以苯甲醇为原料,在催化氧化法制备被甲酸反应中使用的铜催化剂可以重复使用,整个过程没有有害废物排放,为环境友好化学反应。
〈2〉利用高锰酸钾氧化甲苯生成苯甲酸,高锰酸钾水溶液与有机相极难相互溶解,进行非均相的氧化反应。
在试验过程中,由于甲苯处于回流状态,高锰酸钾分批加入,使反应更加难以控制,因此造成实验产率低,甚至使实验失败。
相转移催化是一种有机合成新方法众所周知,多数有机物不溶于水,在有机反应中存在有机相和水相两相,如果没有相转移催化,则反应速度慢,甚至不能发生反应。
相转移催化剂能使离子化合物与不溶于水的有机化合物在弱极性溶剂中进行反应或加速反应〈1〉本实验采用在十六烷基三甲基溴化铵为相转移催化剂作用下高锰酸钾氧化法制备苯甲酸。
二.合成路线三.实验所需仪器圆底烧瓶(250ml),球形冷凝管,温度计,量筒,抽滤瓶,布氏漏斗,电热套。
四.所需试剂五.实验装置名称相对密度性状分子量熔点/摄氏度沸点/摄氏度溶解性折光率投料量水醇酮高锰酸钾紫色柱状晶体158 240 高温分解 6.4 微溶微溶8.5g0.053mol甲苯0.87 无色透明液体92.14 -95 110.6 不溶混溶混溶 1.49672.7ml0.025mol十六烷基三甲基溴化铵364.446 237-250 13g/l易容易容0.2g苯甲酸鳞片状或针状晶体122.12 122.13 0.35g/ml混溶混溶六.实验步骤称取8.5克高锰酸钾于烧杯中,用50ml水溶解,将此溶液移至圆底烧瓶中,加入2.7ml甲苯,0.2g十六烷基三甲基溴化铵和50ml水,加热回流,至回流液不出现油珠。
苯甲酸的制备

苯甲酸的制备1. 简介苯甲酸,化学式C6H5COOH,是一种有机酸,常用于制备药物、染料和农药等化合物。
本文将介绍苯甲酸的制备方法及相关的实验步骤。
2. 材料和试剂•甲苯 (C6H5CH3)•重铬酸钾 (K2Cr2O7)•硫酸 (H2SO4)•稀盐酸 (HCl)•水 (H2O)•氢氧化钠 (NaOH)•石油醚 (C6H14)•氯仿 (CHCl3)3. 实验步骤步骤1: 硝化甲苯1.将100 mL甲苯加入500 mL锥形瓶中。
2.在通风橱下,将15 mL浓硝酸(HNO3) 慢慢加入甲苯中,同时搅拌。
3.加入10 mL浓硫酸 (H2SO4),继续搅拌混合。
4.将瓶口用塞子密封,并在室温下放置约30分钟。
步骤2: 还原硝基化合物1.将制得的硝基苯溶液慢慢倒入滴加装置中。
2.在滴加装置中加入50 mL水和5 g亚硫酸钠(Na2SO3),并轻轻摇动。
3.将滴加装置的滴液慢慢加入50 mL稀盐酸中,同时搅拌。
4.过滤得到的沉淀物。
步骤3: 合成苯甲酸1.将沉淀物转移到一个反应瓶中。
2.加入适量的氢氧化钠溶液 (NaOH) 并搅拌。
3.将反应瓶放入水浴中,并加热至70-80°C。
4.加入稀盐酸,使pH值保持在2-3之间。
5.过滤沉淀物并用石油醚洗涤,得到苯甲酸的粗产物。
6.将粗产物加入氯仿中,并搅拌混合。
7.使用漏斗分离出苯甲酸层。
8.用石油醚洗涤苯甲酸层,并用无水氯化钠除去残余的水分。
9.将溶液倒入干燥皿中,并用浓盐酸处理,得到苯甲酸的纯品。
4. 安全注意事项•这些实验应在通风橱下进行,以避免有害气体的吸入。
•实验过程中要注意火源和爆炸物的存在,确保实验环境安全。
•使用化学药品时,应戴上手套和护目镜,避免直接接触皮肤和眼睛。
5. 结论通过以上实验步骤,我们可以制备出苯甲酸。
这是一种常见的有机酸,广泛用于医药、染料和农药等领域。
通过了解苯甲酸的制备方法,我们可以更好地理解化学实验的基本原理和步骤。
同时,在实验操作过程中,我们必须严格遵守实验操作规程和安全注意事项,以保证实验的安全和成功。
药物合成实验指导书实验一苯甲酸的制备

实验一苯甲酸的制备(Benzoic Acid)苯甲酸与水杨酸合用于成人皮肤真菌病,浅部真菌感染如体癣、手癣及足癣等,但因目前有更多的高效抗真菌药,本制剂可作为二线治疗药。
也用于食品和药物制剂的防腐剂,一般浓度为0.2%,或用0.5%的苯甲酸钠,溶解度更好。
【反应式】【试剂】甲苯1.0mL(0.0087 mol),高锰酸钾3.5 g(0.022 mol),亚硫酸氢钠,氯化苄基三乙胺0.4g,浓盐酸。
【步骤】在配有球形冷凝管的100mL三口烧瓶中加入1.0mL甲苯、35mL水和0.4g 氯化苄基三乙胺相转移催化剂,于磁力加热搅拌器上加热至沸。
两批加入 3.5g 高锰酸钾,粘附于瓶口的高锰酸钾用约2.0mL水冲入瓶内,继续在搅拌下反应,直至甲苯层几乎消失,回流液不再出现油珠(约需2小时)。
将反应混合物趁热减压抽滤,用少量热水洗涤滤渣二氧化锰。
合并滤液和洗涤液,加入少量的亚硫酸氢钠还原未反应完的高锰酸钾,直至紫色褪去,成为无色透明的溶液。
再进行减压抽滤,将滤液放于冰水浴中冷却,然后加入浓盐酸酸化,边加边搅拌,且用pH试纸测溶液的pH值直至强酸性,这时苯甲酸结晶析出。
将析出的苯甲酸减压抽滤,得到粗的苯甲酸。
用水进行重结晶,可得到纯净的苯甲酸。
本实验约需3~5 h。
【注释】[1] 滤液如果呈紫色,可加入少量亚硫酸氢钠使紫色褪去,重新减压抽滤[2] 苯甲酸在100g水中的溶解度为4℃,0.18g;18℃,0.27g;75℃,2.2g。
【思考题】1.在氧化反应中,影响苯甲酸产量的主要因素有哪些?2.反应完毕后,如果滤液呈紫色,为什么要加亚硫酸氢钠?3. 精制苯甲酸还有什么方法?。
实验八 苯甲酸的制备

实验八 苯甲酸的制备一、 试验目的1.掌握甲苯液相氧化法制备苯甲酸的原理和方法。
2.了解苯甲酸在水中的溶解度变化,学习减压过滤方法。
二、实验原理主要性质和用途苯甲酸(benzoic acid )俗称安息香酸,常温常压下是鳞片状或针状晶体,有苯或甲醛的臭味,易燃。
密度1.2659(25℃),熔点121.25℃,沸点249.2℃,折光率1.53947(15℃),微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳和松节油。
可用作食品防腐剂、醇酸树脂和聚酰胺的改性剂、医药和染料中间体,还可以用于制备增塑剂和香料等。
苯甲酸及其钠盐对钢铁材料具有防锈作用。
苯甲酸的生产方式有三种:甲苯液相空气氧化法、三氯甲苯水解法、邻苯二甲酸酐脱酸法。
其中以空气氧化法最为常见。
本实验是用KMnO 4为氧化剂,由甲苯制备苯甲酸,反应式如下:KMnO 4+COOK+ MnO 2+ H 2O+ HCl COOH+ KClCH 3COOK三、仪器与药品三口烧瓶(250ml )、球形冷凝管、温度计(0~300℃)、量筒(5ml 、10ml )、标准瓶塞、温度计套管、滤纸、吸滤瓶(500ml )、布氏漏斗(ϕ80mm )、pH 试纸(1~14)、刚果红试纸、烧杯(100ml 、250ml )、洗瓶、药匙、表面皿、水浴盆、真空泵、天平、电炉子、石棉网、电热套。
沸石、冰、甲苯、高锰酸钾、浓盐酸、蒸馏水。
四、实验步骤在250ml 三口烧瓶中,加入2.7ml 甲苯和100ml 蒸馏水,中口装上冷凝器,左口装上温度计,右口用标准塞密封,注意温度计的水银球浸入液面。
用电热套加热三口烧瓶,使溶液至沸,从右口分批少量加入8.5g高锰酸钾,继续煮沸并间歇摇动三口烧瓶,直到观察不到甲苯层,此时温度不再升高,回流液中不出现油珠为止(大约4h)。
在实验中注意记录变化,从反应液沸腾开始每10min记录一次,直到温度30min内无变化时实验结束。
将反应混合液趁热减压过滤,并用少量热水洗涤滤渣,然后将滤液放在冰水浴中冷却,然后用浓盐酸酸化至苯甲酸全部析出为止。
实验四 苯甲酸的制备

7 苯甲酸的制备(8学时).一、实验目的1.掌握高锰酸钾氧化法制备羧酸。
2.掌握相转移催化氧化制备苯甲酸的方法。
3.巩固重结晶操作。
二、实验原理烷基苯在相转移催化剂存在下,在强氧化剂的氧化下,氧化生成苯甲酸。
反应式: CH 3+2 KMnO 4相转移催化剂COOK +2 MnO 2+KOH +H 2O COOK+HCl COOH +KCl三、实验仪器及试剂仪器:250 mL 四口瓶恒压滴液漏斗温度计球形冷凝管搅拌器试剂:苯甲醇高锰酸钾二乙二醇二甲醚浓盐酸亚硫酸氢钠甘油氢氧化钠四、实验操作装置如下图。
图制备苯甲酸装置于250 mL 四口瓶上装好温度计、搅拌装置、回流冷凝器和滴液漏斗。
将8 g 高锰酸钾、0.16 g (4~5滴)二乙二醇二甲醚、0.4 g 氢氧化钠及100 mL 水依次加到四口瓶内,再将3.0mL 苯甲醇倒入滴液漏斗中。
在搅拌下回流,温度保持90℃左右。
在此温度下缓慢滴加苯甲醇,控制滴加速度使其在30 min 内加完。
滴加完毕,回流1.0-1.5 h 。
反应完毕,停止加热,冷却至室温。
在搅拌下慢慢滴加少量甘油(约3~4 mL ),使紫色消失。
抽滤,滤去二氧化锰沉淀。
溶液如仍有颜色,可加入少量亚硫酸氢钠溶液,使其褪色。
无色溶液浓缩至50 mL ,冷却至室温。
然后用浓盐酸酸化,析出的白色结晶进行抽滤,干燥。
纯苯甲酸为无色针状晶体,熔点122.4℃。
五、实验记录1.所加试剂的质量2.所得产物的质量六、思考与讨论1.在氧化反应中,影响苯甲酸产量的主要因素是哪些?2.精制苯甲酸还有哪些方法?3.相转移催化剂在反应中的催化机理是什么?七、注意事项1.甘油作为还原剂,反应较为激烈。
因此要慢慢地滴加至紫色消失。
2.苯甲酸在水中的溶解度为:温度/℃ 4 18 75溶解度/ g 0.18 0.27 2.2。
苯甲酸的制备 实验报告

苯甲酸的制备实验报告苯甲酸的制备实验报告引言:苯甲酸,化学式为C6H5COOH,是一种常见的有机酸,广泛应用于医药、染料、香料等领域。
本次实验旨在探究苯甲酸的制备方法,并通过实验验证其制备的可行性。
实验材料:1. 苯甲醇(C6H5CH2OH)2. 碳酸钠(Na2CO3)3. 稀盐酸(HCl)4. 水(H2O)5. 氯化亚铁(FeCl3)实验步骤:1. 将苯甲醇与碳酸钠按摩尔比1:1混合,加入适量水中搅拌均匀。
2. 在搅拌的过程中,缓慢滴加稀盐酸,同时保持温度在50-60摄氏度。
3. 滴加稀盐酸至反应液中出现白色沉淀,反应达到终点。
4. 将反应液过滤,得到沉淀。
5. 将沉淀洗涤至无碱性,使其纯度更高。
6. 将洗涤后的沉淀加入适量的水中,加热溶解。
7. 将溶液中加入少量氯化亚铁,观察颜色变化。
实验结果:经过以上步骤,我们成功制备出苯甲酸。
根据实验观察,反应液中出现白色沉淀,符合苯甲酸的理论应有的性质。
通过过滤和洗涤,我们得到了纯度较高的苯甲酸。
此外,在加入氯化亚铁后,溶液的颜色变为深红色,进一步证实了苯甲酸的制备成功。
实验讨论:本次实验采用的是苯甲醇与碳酸钠反应制备苯甲酸的方法。
该反应是一种酯水解反应,通过酯与碱反应生成相应的酸和醇。
实验中使用的稀盐酸起到催化剂的作用,加速酯水解反应的进行。
反应终点的判断是通过观察反应液中白色沉淀的生成。
白色沉淀即为苯甲酸钠,其生成标志着反应的完成。
在实验过程中,我们还采用了过滤和洗涤的步骤,以提高苯甲酸的纯度。
过滤可以去除反应液中的杂质,得到较为纯净的沉淀。
洗涤则是为了去除沉淀中残留的碱性物质,使得苯甲酸的纯度更高。
实验中加入氯化亚铁的目的是进行颜色检测。
苯甲酸与氯化亚铁反应生成的产物为深红色,这是由于苯甲酸中的芳香环结构与氯化亚铁的配位作用所致。
颜色变化的观察可以进一步确认苯甲酸的制备成功。
结论:通过以上实验,我们成功制备出了苯甲酸,并验证了其制备的可行性。
实验结果表明,苯甲酸的制备方法简单有效,适用于实验室规模的制备。
苯甲酸的制备
3、测熔点 文献值为 121℃。
五、实验记录
记录实验现象及苯甲酸状态
六、实验注意事项
1、高锰酸钾分批加入,避免反应激烈从回流管上端喷出。 2、非均相反应应摇动装置,使反应充分。
七、思考题
1、反应结束为什么应趁热过滤? 2、相转移催化的机理? 3、如何鉴定所得产品的纯度
4、还可用什么方法来制备苯甲酸? 5.反应完毕,滤液尚呈紫色,为什么要加入亚硫酸氢钠?
相转移催化制备苯甲酸
一、实验目的
1.了解相转移催化剂的催化原理。 2.掌握热滤、抽滤、回流、重结晶等操作技能。
二、合成反应式
CH3
COOK
+
KMnO4
+ MnO2
+ H2O
COOK
+ HCl
COOH
+ KCl
三、实验仪器及装置
加热回流装置:圆底烧瓶 回流反应
2.7mL催 催 100 mL催 催 催 催 催 催 催 0.2g 停停停停
停停
停 停 停 停 停 KMnO4
停 停 停 停 2~3h 停停停停停停停停
催催催催催催催催催催 催催催催催催 停
2、提纯 将反应混合物趁热用水泵减压抽滤,并用少量热水洗涤滤渣,合并滤液和洗 液,放在冰水浴中冷却用浓盐酸酸化,直到苯甲酸全部析出。抽滤、压干。若产品不够纯 净,可用热水重结晶,必要时加少量活性炭脱色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
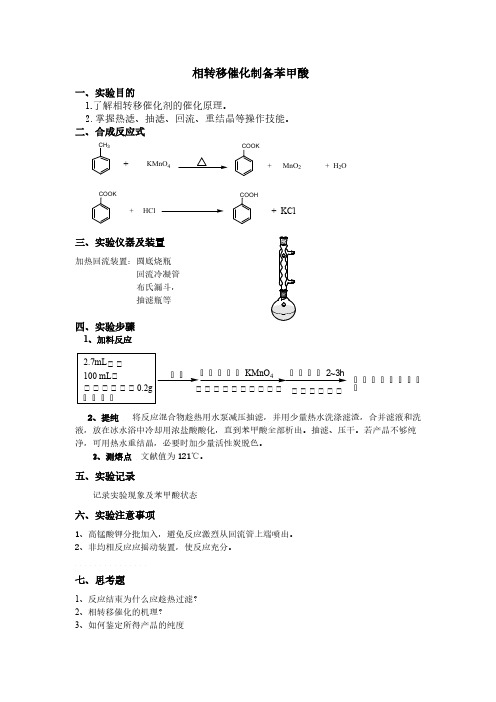
相转移催化制备苯甲酸
、实验目的
1. 了解相转移催化剂的催化原理。
2. 掌握热滤、抽滤、回流、重结晶等操作技能。
、合成反应式
三、实验仪器及装置
加热回流装置:圆底烧瓶
回流冷凝管
布氏漏斗, 抽滤瓶等
四、实验步骤
1、加料反应
2.7mL 甲苯
100 mL 水
加热 分数次加入 KMnO 4 加热回流2~3h ……,亠, IUU mL 水 一加热. ------------------- ----------- - 油层消失,停止反 相转移催化剂U.2g 少量水冲洗冷凝管内壁 时常摇动烧瓶 应 几颗沸石
2、提纯 将反应混合物趁热用水泵减压抽滤,
并用少量热水洗涤滤渣, 合并滤液和洗液, 放在冰水浴中冷却用浓盐酸酸化,直到苯甲酸全部析出。
抽滤、压干。
若产品不够纯净,可 用热水
重结晶,必要时加少量活性炭脱色。
3、测熔点 文献值为121 Co 记录实验现象及苯甲酸状态
六、实验注意事项
1、 高锰酸钾分批加入,避免反应激烈从回流管上端喷出。
2、 非均相反应应摇动装置,使反应充分。
七、思考题
1、 反应结束为什么应趁热过滤?
2、 相转移催化的机理?
3、 如何鉴定所得产品的纯度
4、还可用什么方法来制备苯甲酸?
KMnO 4 MnO 2 + H 2O
+ KCl 实验记录
CH 3 + COOK
+ COOK
HCl
5.反应完毕,滤液尚呈紫色,为什么要加入亚硫酸氢钠?。
