常见化学结构
有机化学常见官能团及结构式

有机化学常见官能团及结构式有机化学是研究有机物的合成、结构和性质的科学。
在有机化学中,官能团是有机分子中具有特定化学性质和一定结构的基团。
它们决定了有机物的性质和反应类型。
下面将介绍几种常见的官能团及其结构式。
1. 烷基(Alkyl group)烷基是碳原子组成的链状基团,只有单键,通常用R表示。
常见的烷基有甲基(-CH3)、乙基(-C2H5)、丙基(-C3H7)等。
2. 烯基(Alkenyl group)烯基是含有碳碳双键的基团,通常用R'表示。
常见的烯基有乙烯基(-CH2CH=CH2)、丙烯基(-CH2CH=CH-CH3)等。
3. 炔基(Alkynyl group)炔基是含有碳碳三键的基团,通常用R''表示。
常见的炔基有乙炔基(-C≡CH)、丙炔基(-C≡C-CH3)等。
4. 羟基(Hydroxyl group)羟基是一个氢原子被一个氧原子取代的官能团,通常用-OH表示。
常见的化合物有乙醇(CH3CH2OH)、丙醇(CH3CH2CH2OH)等。
5. 羧基(Carboxyl group)羧基由一个羰基和一个羟基组成,通常用-COOH表示。
常见的羧基化合物有甲酸(HCOOH)、乙酸(CH3COOH)等。
6. 醛基(Aldehyde group)醛基由一个羰基和一个氢原子组成,通常用-CHO表示。
常见的醛基化合物有乙醛(CH3CHO)、丙醛(CH3CH2CHO)等。
7. 酮基(Ketone group)酮基由一个羰基和两个碳原子组成,通常用-CO-表示。
常见的酮基化合物有丙酮(CH3COCH3)、丁酮(CH3CH2COCH3)等。
8. 胺基(Amino group)胺基是一个氮原子连接一个或多个碳原子的官能团,通常用-NH2表示。
常见的胺基化合物有甲胺(CH3NH2)、乙胺(CH3CH2NH2)等。
以上是有机化学中常见的官能团及其结构式。
通过组合这些官能团可以合成复杂的有机化合物,这些化合物不仅存在于化学实验室中,也广泛存在于生物体内和我们日常生活中的各种物质中。
常用有机酸结构、化学式、分子量、别名
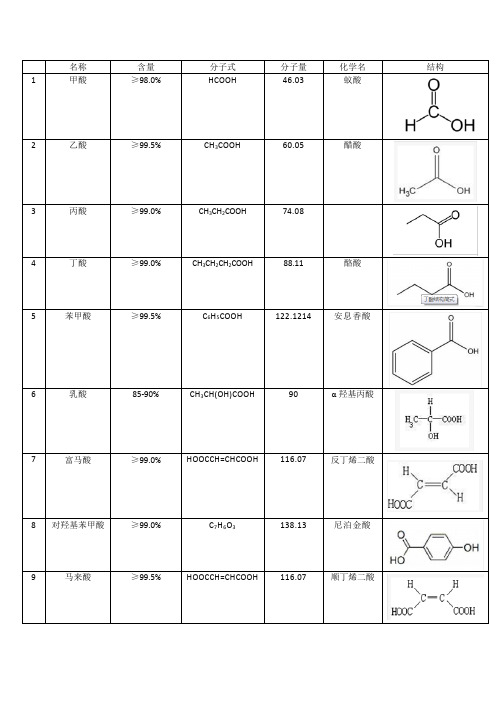
名称含量分子式分子量化学名结构1 甲酸≥98.0% HCOOH 46.03 蚁酸2 乙酸≥99.5% CH3COOH 60.05 醋酸3 丙酸≥99.0% CH3CH2COOH 74.084 丁酸≥99.0% CH3CH2CH2COOH 88.11 酪酸5 苯甲酸≥99.5% C6H5COOH 122.1214 安息香酸6 乳酸85-90% CH3CH(OH)COOH 90 α羟基丙酸7 富马酸≥99.0% HOOCCH=CHCOOH 116.07 反丁烯二酸8 对羟基苯甲酸≥99.0% C7H6O3 138.13 尼泊金酸9 马来酸≥99.5% HOOCCH=CHCOOH 116.07 顺丁烯二酸10 肉桂酸≥99.5% C6H5-CH=CH-COOH 148.17 β-苯丙烯酸、3-苯基-2-丙烯酸11 没食子酸≥99% C7H6O5 170.12 3,4,5-三羟基苯甲酸12 烟酸≥99.5%-100.5% C6H5NO2 123.11 维生素B3、维生素PP、尼克酸13 山梨酸钾≥98% CH3CH=CHCH=CHCOOK 150.22 2,4-己二烯酸钾14 丁香酸98% C9H10O5 198.18 3,5-二甲氧基-4-羟基苯甲酸15 丙二酸≥98% HOOCCH2COOH 104.06 缩苹果酸16 一水合柠檬酸≥99.5% C6H8O7 192.14 2-羟基-1,2,3-三羧基丙烷17 香草酸98% C8H8O4 168.15 4-羟基-3-甲氧基苯甲酸18 2,4-二羟基苯甲酸≥99% C7H6O4 154.1219 水杨酸≥99.5% C7H6O3138 邻羟基苯甲酸20 丁二酸≥99.5% HOOCCH2CH2COOH 118.09 琥珀酸21 DL-苹果酸≥99% C4H6O5 134.09 2-羟基丁二酸22 齐墩果酸97% C30H48O3 456.71 3β-羟基齐墩果-12-烯-28-酸23 β-甘草次酸97% C30H46O4470.643β-羟基-11-氧化-18β,20β-齐墩果烷-12-烯酸24 咖啡酸98% C9H8O4 180.15 3,4-二羟基苯基烯丙酸25 蛇床子素99% C15H16O3 244.29 7-甲氧基-8-异戊烯基香豆素26 熊果酸93% C30H48O3 456.68。
化学结构知识点总结归纳

化学结构知识点总结归纳结构化学是化学中非常重要的一个分支,它涉及到分子和原子之间的结构、键合情况和空间构型等方面。
结构化学的研究对于理解化学反应、理论计算和新材料设计等方面都具有重要的意义。
在这篇文章中,我将对结构化学的一些重要知识点进行总结归纳,希望能够对读者有所帮助。
1. 分子结构分子是由原子通过共价键连接而成的化合物,它们具有固定的结构和空间构型。
分子的结构包括分子式、键长、键角、二面角和立体构型等方面。
分子式是用来表示分子中原子种类和数量的化学式,例如H2O表示水分子,CH4表示甲烷分子。
而键长和键角则是描述分子内原子之间的相对位置关系,它们对分子的性质和反应活性都有很大影响。
此外,二面角和立体构型也是分子结构中重要的参数,它们描述了分子中的空间构型及其对分子性质和反应活性的影响。
2. 共价键共价键是原子之间通过共享电子而形成的化学键,它是最常见的一种化学键类型。
共价键的形成和特性对于分子结构和化学性质有着重要影响。
共价键可以分为σ键和π键两种类型,其中σ键是由原子轴向的轨道重叠形成的键,而π键则是由平行轨道的重叠形成的键。
另外,共价键的长度和强度也与原子的电负性和分子的结构有很大关系。
共价键的性质和特性是结构化学研究的一个重要内容。
3. 杂化轨道杂化轨道是描述分子中原子轨道混成现象的概念,它对于分子结构的解释和分析具有重要意义。
杂化轨道的形成是由于原子在形成共价键时,其原子轨道发生重叠和混合的现象。
根据杂化轨道理论,sp、sp2、sp3和sp3d等不同种类的杂化轨道可以解释分子中的不同键型和分子构型。
杂化轨道对于理解分子的稳定性、反应活性和构型优劣有着重要的帮助。
4. 共振结构共振结构是由于某些分子存在多种等价的共振式结构而导致的一种描述方式。
通过引入共振结构,可以更好地解释分子中原子位置和键型的不确定性。
共振结构对于分子结构和稳定性的理解非常重要,它可以直观地反映分子中的电子分布情况和电荷分布情况,有助于预测分子的性质和反应活性。
常用有机酸结构、化学式、分子量、别名
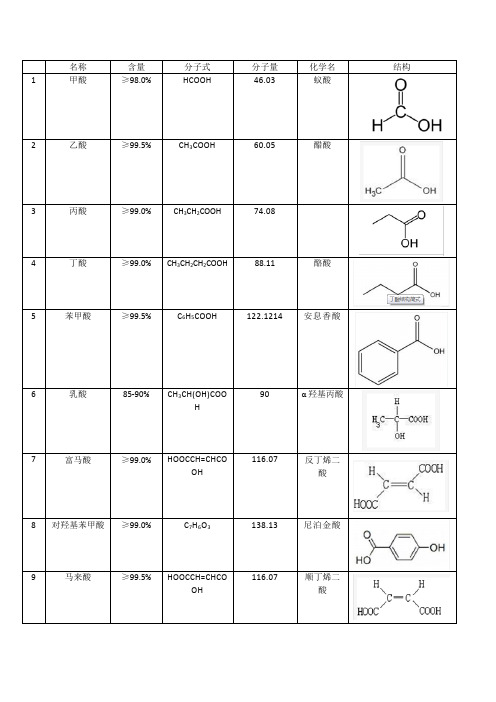
咖啡酸
98%
C9H8O4
180.15
3,4-二羟基苯基烯丙酸
25
蛇床子素
99%
C15H16O3
244.29
7-甲氧基-8-异戊烯基香豆素
26
熊果酸
93%
C30H48O3
456.68
龟裂链霉菌菌种交接说明
今由陈晓红将张江波、秦宝福老师2016年月日从上海华东理工大学寄往西北农林科技大学生命科学学院生物工程实验实训中心的土霉素发酵菌种龟裂链霉菌冻干粉(牛奶管)支,斜面支,转交给刘建党、张江波老师,并将牛奶管支保藏在陈鹏老师实验室-80℃冰箱,斜面支保藏在陈鹏老师实验室4℃冰箱。特此说明。
经办人:
日期:2016年3月11日
CH3CH(OH)COOH
90
α羟基丙酸
7
富马酸
≥99.0%
HOOCCH=CHCOOH
116.07
反丁烯二酸
8
对羟基苯甲酸
≥99.0%
C7H6O3
138.13
尼泊金酸
9
马来酸
≥99.5%
HOOCCH=CHCOOH
116.07
顺丁烯二酸
10
肉桂酸
≥99.5%
C6H5-CH=CH-COOH
148.17
β-苯丙烯酸、3-苯基-2-丙烯酸
11
没食子酸
≥99%
C7H6O5
170.12
3,4,5-三羟基苯甲酸
12
烟酸
≥99.5%-100.5%
C6H5NO2
123.11
维生素B3、维生素PP、尼克酸
13
山梨酸钾
≥98%
CH3CH=CHCH=CHCOOK
常见化学结构范文

常见化学结构范文化学结构是指描述化学物质的分子、离子和原子排列方式的图示。
化学结构的解析和理解对于研究和应用化学具有重要意义。
以下是一些常见的化学结构。
1.分子结构分子结构是描述分子中原子之间的连接方式和空间排列的表示方法。
常见的分子结构包括Lewis结构、Kekulé结构、球棍模型、空间填充模型等。
以水(H2O)分子为例,其Lewis结构表示为H-O-H,表示氢原子与氧原子之间是共用电子对连接。
2.离子结构离子结构用于描述离子化合物中阳离子和阴离子之间的排列方式。
例如,氯化钠(NaCl)是一种常见的离子化合物,其离子结构表示为Na+Cl-,表示钠离子与氯离子之间是离子键连接。
3.均匀结构均匀结构描述均匀晶体中晶格的排列方式,是晶体学研究的重要内容。
均匀结构可以通过X射线衍射等方法进行分析。
例如,钻石是一种由碳原子组成的晶体,其均匀结构由密堆积的化学基元组成。
4.非晶态结构非晶态结构是一些化学物质的特殊结构,其中原子或分子没有明确的周期性排列。
非晶体具有无定形的外观和随机的结构。
例如,玻璃就是一种非晶态结构的物质,其分子排列没有规律性。
5.生物大分子结构生物大分子结构描述生物分子(如蛋白质、核酸和多糖等)的分子结构和空间构型。
例如,DNA的结构由双螺旋的排列方式组成,而蛋白质的结构可以分为四个层次:原初结构、次级结构、三级结构和四级结构。
6.网状结构网状结构是一种特殊的结构,其中原子或分子之间通过共价键或离子键连接成为大的网络结构。
例如,金刚石是由碳原子通过共价键连接成为网状结构的晶体。
7.聚合物结构聚合物结构描述由单体通过共价键连接而成的大分子化合物。
聚合物可以具有直线链状结构、支链状结构或三维网状结构。
例如,聚乙烯是由乙烯单体通过共价键连接形成的线性聚合物。
8.微观结构微观结构描述了物质在微观尺度上的排列方式,包括晶体的晶胞和晶格结构、粗晶粒内部的晶界和位错等。
微观结构的研究对于理解材料的性质和行为具有重要意义。
各种基团化学结构式

各种基团化学结构式1. 甲醇的结构式甲醇,化学式为CH3OH,是一种简单的醇类化合物。
它的结构式可以用下面的方式表示:H|H - C - O - H|H甲醇由一个碳原子、三个氢原子和一个氧原子组成。
碳原子与氧原子之间是一个单键连接,碳原子还与三个氢原子之间有三个单键连接。
2. 甲酸的结构式甲酸,化学式为HCOOH,是一种有机酸。
它的结构式可以用下面的方式表示:H|H - C - O - O - H|H甲酸由一个碳原子、两个氢原子和一个羧基组成。
羧基由一个碳氧双键和一个氧原子上的氢原子组成。
3. 乙醇的结构式乙醇,化学式为CH3CH2OH,是一种常见的醇类化合物。
它的结构式可以用下面的方式表示:H H| |H - C - C - O - H| |H H乙醇由两个碳原子、五个氢原子和一个氧原子组成。
两个碳原子之间是一个单键连接,一个碳原子还与三个氢原子之间有三个单键连接,另一个碳原子还与一个氢原子和一个氧原子之间有一个单键连接。
4. 乙酸的结构式乙酸,化学式为CH3COOH,是一种常见的有机酸。
它的结构式可以用下面的方式表示:H H| |H - C - C - O - O - H| |H H乙酸由两个碳原子、三个氢原子和一个羧基组成。
羧基由一个碳氧双键和一个氧原子上的氢原子组成。
5. 乙烯的结构式乙烯,化学式为CH2=CH2,是一种简单的烯烃。
它的结构式可以用下面的方式表示:H H\ /C = C/ \H H乙烯由两个碳原子和四个氢原子组成。
两个碳原子之间是一个双键连接,每个碳原子还与两个氢原子之间有一个单键连接。
6. 丙酮的结构式丙酮,化学式为(CH3)2CO,是一种常见的酮类化合物。
它的结构式可以用下面的方式表示:H|H - C - C - O - (CH3)|H丙酮由三个碳原子、六个氢原子和一个酮基组成。
酮基由一个碳氧双键和一个碳原子上的甲基组成。
7. 甲基苯的结构式甲基苯,化学式为CH3C6H5,是一种芳香烃。
化学知识结构框图(超详细)
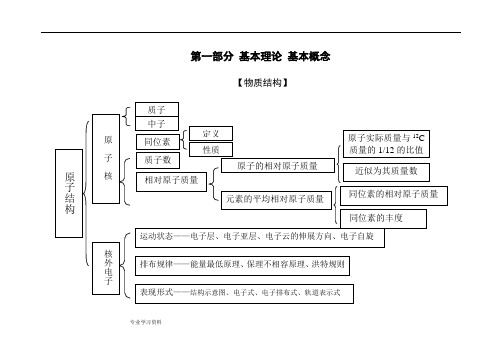
. 专业学习资料 .第一部分 基本理论 基本概念【物质结构】. 专业学习资料.晶体结构. 专业学习资料.晶体熔沸点比较表. 专业学习资料.【元素周期律】. 专业学习资料.【化学反应速率与化学平衡】. 专业学习资料.. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【胶体】【电解质溶液】.. 专业学习资料.. 专业学习资料.【氧化还原反应电化学】. 专业学习资料.【各种化学反应的关系】. 专业学习资料..专业学习资料.【化学反应规律】. 专业学习资料.. 专业学习资料.. 专业学习资料 .【物质的量】nVV n m =→nm M =Vn C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数). 专业学习资料..第二部分 元素及其化合物【元素化合物概述】【非金属元素】. 专业学习资料.【卤族元素】. 专业学习资料.PbS. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【金属元素】.. . .. . ..【铝及其化合物】. 专业学习资料.. 专业学习资料.. 专业学习资料.【化工生产】. 专业学习资料.第三部分 有机物【有机物导学】[有机物推断]浓H2SO4加热苯的硝化醇分子内、间脱水酯化光照——烷基卤代[官能团特征反应]聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3 CH CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n2HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分 化学计算。
常见官能团化学结构式

问:若一有机物结构式中有多个官能团,则在分类时依据哪个官能团
答:按官能团顺序规则;顺序是:-COOH>-SO3H>-COOR>-COX>-CONH2>-CO-O-CO->-CN>-CHO>-CO->-OH醇羟基>-OH酚羟基>-NH2>-OR>-R>-X>-NO2>-NO 含氧官能团
不同的碳氧键会因其中原子程度的不同而有性质上的差异;sp2杂化的氧原子有,而sp3则有;
ROCOOR
RCOOR' 含氮官能团
RC=ONC=OR'
吲哚基吡唑环咪唑环喹啉环
嘧啶环
吡咯
吗啉
含磷、硫官能团
与同族的氮和氧相比,和中的杂原子倾向于成更多的键;
甲基丙基膦
亚磷酸苄酯2
R'
二苯基亚砜
烃基
根据所含π键的不同,不同的官能团具有不同的性质;注意:烷烃基如甲基、亚甲基不算官能团,而苯基是官能团;
含卤素取代基
卤代烃中含有碳-键,键能随卤素不同而有变化;一般除外,卤代烃都可发生和;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
一些常見分子的結構
1.VSEPR :判斷分子形狀
2.路以士電子點式:判斷鍵結
化學式 中文命名 結構式
中心原子混成軌域 中心原子鍵結形狀 備註 CO 一氧化碳 C O sp(C) 直線形 鍵能CO >N 2
CO 2 二氧化碳 C O O
sp 直線形 H 2CO 3
碳酸
C
O O O
H H
sp 2(C)
三角形
CO 32-
碳酸根
C O O
O
2-
sp 2
三角形
3
11鍵 CH 4
甲烷
sp 3
正四體形
C 2H 6
乙烷
sp 3(C) 立體形
C 2H 4 乙烯
sp 2(C) 平面 C 2H 2 乙炔
sp(C) 直線形 HCN 氰化氫 H C
N
sp(C) 直線形
C 6H 6
苯
sp 2
平面
2
11鍵 金剛石
sp 3 立體
石墨
sp 2
平面層狀
層與層間為凡
得瓦力
C-C 鍵為3
1
1鍵
.
.
化學式 中文命名 結構式
中心原子混成軌域 中心原子鍵結形狀 備註
C 60
碳-60
sp 2
足球形
3
1
1鍵
N 2 氮 N
N
直線 NH 3
氨
N H
H
H
sp 3
角錐形
鍵角為︒7.106
NH 4
+ 銨根
N H
H
H
H
+
sp
3
正四面體 鍵角為︒5.109
NO 一氧化氮 N O sp 2(N) 直線 N 不符合八偶
體 NO 2 二氧化氮 N O O sp 2(N)
角形 N 不符合八偶
體 HNO 2
亞硝酸
N
O
O H
sp 2
(N)
角形(N)
N 符合八偶體
NO 2-
亞硝酸根
N O
O
⌒
sp 2
角形
N-O 鍵為2
1
1
HNO 3
硝酸
N
O
O O
H
sp 2(N)
NO 3-
硝酸根
N
O
O O
-
sp 2
正三角形
N-O 鍵為3
1
1
N 2O 4 四氧化二氮
O
N
O
N O
O
sp 2(N)
為非平面分子
N-O 鍵為2
1
1
化學式
中文命名
結構式
中心原子混成軌域 中心原子鍵
結形狀 備註 N 2F 2
二氟化二氮
N F
N F
sp 2
平面形分子
有順反異構物
N 2H 4
聯胺(胼) N N H H H
H
sp 3(N)
為火箭燃料
O 2 氧 O O 直線 O 3
臭氧
O O
O
sp 2
角形 O-O 鍵為2
11
鍵
H 2O
水
O
H
H
sp 3
角形
︒=∠5.104HOH O 上之lp=2 H 3O +
O H
H
H +
sp 3
角錐形 有一個O-H 鍵為配位共價鍵
S 8 硫
sp 3(s) 皇冠形
彈性硫為鏈形
SO 2
二氧化硫
S O
O
sp 2(S) 角形
S-O 間為2
1
1鍵
SO 3
三氧化硫
S O
O O
sp 2(S)
平面三角形 S-O 間為3
1
1鍵
.
H 2SO 3
亞硫酸
S O
O O
H H
sp 3(S) 角錐形 S-O 間為單鍵
SO 32-
亞硫酸根
S O
O
O 2-
sp 3(S) 角錐形 S-O 間為單鍵
化學式 中文命名
結構式
中心原子混成軌域
中心原子鍵結形狀
備註
H 2SO 4
硫酸
S O
O O
H H O
sp 3
(S)
四面體形(S)
SO
4
2- 硫酸根
sp 3
(S)
正四面體形 S-O 間為單鍵
(大學會考慮d
軌域形成 鍵)
SF 6
六氟化硫
F S F F
F F
F
sp 3d 2(S)
正八面體形 第三週期以後
的元素才會到
d 軌域的混成
H 2S 2O 7
焦硫酸根
O S O O
O S O O
O H
H
sp 3
(S)
兩個H 2SO 4脫去一個水 S 2O 32- 硫代硫酸根
S O O O
S
2-
-1
+5
sp 3(S)
兩個S 的氧化數各為+5,-1 平均氧化數為
+2
P 4
白(黃)磷
sp 3
正四面體
P 上含有孤電
子對
P 4
紅(赤)磷
sp 3 聚合物
P 上含有孤電
子對 PH 3 磷化氫
P H
H
H
sp 3
角錐形
P 上含有孤電
子對
化學式
中文命名 結構式
中心原子混成軌域 中心原子鍵結形狀
備註 PCl 3
三氯化磷
P
X
X
X
sp 3
角錐形
P 上含有孤電
子對
PCl 5
五氯化磷
sp 3d 雙三角錐
P 上無孤電子
對
P 4O 6
六氧化四磷
sp 3
P 4的六個鍵斷,接上O P 上含有孤電子對
.
P4O10十氧化四磷sp3P4的六個鍵斷
接上O , 四個
磷頂端再接O
P上無孤電子
對
H3PO4磷酸sp3四面體(P)1.為三元酸
2. P原子上無孤電子對
H3PO3亞磷酸sp3四面體(P)有一個H接在P上,為二元酸
化學式中文命名結構式中心原子
混成軌域
中心原子鍵
結形狀
備註
H2PO2次磷酸sp3四面體(P)有二個H 接在P上,為一
元酸
H4P2O7焦磷酸sp3四面體(P)兩個酸脫去一個水稱為焦酸
HClO次氯酸
ClO-次氯酸根Cl O
-Cl上有三對孤
電子對HClO2亞氯酸sp3角形(Cl)
ClO2-亞氯酸根Cl
O
O
sp3角形(Cl)
Cl上有二對孤
電子對HClO3氯酸sp3角錐形(Cl)
ClO3-氯酸根
Cl
O
O
O
sp3角錐形(Cl)
Cl上有一對孤
電子對
.
.
化學式中文命名結構式中心原子
混成軌域
中心原子鍵
結形狀
備註
HClO4過氯酸根sp3四面體形(Cl)
ClO4-過氯酸根sp3正四面體Cl上無孤電子
對
KHF2二氟氫化鉀H F
F
K -
+含有氫鍵
I3-三碘離子I I I -
sp3d直線形
中心I含有三
對孤電子對
BeF2氟化鈹F Be F sp直線形不符合八偶體BF3氟化硼B
F
F F
sp2平面三角形不符合八偶體
BF4-四氟化硼離
子
B
F
F F
F
-
sp3正四面體形符合八偶體
化學式中文命名結構式
中心原子
混成軌域
中心原子鍵
結形狀
備註
Si矽sp3正四面體形
為共價網狀固
體
SiO4-正矽酸根sp3正四面體形
所有矽酸鹽的
基礎結構
SiO2石英sp3(Si)正四面體形共價網狀晶體
如有侵权请联系告知删除,感谢你们的配合!。
