应用电化学复习思考题
电化学原理思考题答案-北航李荻版

电化学原理思考题答案-北航李荻版2.为什么不能测出电极的绝对电位?我们平常所用的电极电位是怎么得到的?答:电极电位是两类导体界面所形成的相间电位,相间电位中的内电位是无法直接测量的,故无法直接测出电极的绝对电位,我们平常所用的电极电位都是相对电极电位。
不对,虽然有电位差,但是没有电流通过,所以不能转化为电能。
17、描述腐蚀原电池的特点所在。
①阴、阳极区肉眼可分或不可分,或交替发生;②体系不稳定? 稳定,腐蚀过程是自发反应;③只要介质中存在氧化剂 (去极化剂),能获得电子使金属氧化,腐蚀就可发生;④腐蚀的二次产物对腐蚀影响很大;⑤电化学腐蚀离不开金属/电解质界面电迁移,电子由低电位金属或地区传荷到电位高的金属或地区,再转移给氧化剂;⑥腐蚀电池包括阴极、阳极、电解质溶液和电路四部分,缺一不可;⑦阴极、阳极反应相对独立,但又必须耦合,形成腐蚀电池;⑧ia=ic ,无净电荷积累;⑨腐蚀电池不对外作功,只导致金属腐蚀破坏的短路原电池。
原电池和电解池1.原电池和电解池的比较:装置实例原电池电解池原理形成条件使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
非自发的氧化还原反应由外电源决定:阳极:连电源的正极;阴极:连电源的负极;阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑ (氧化反应)电源负极→阴极;阳极→电源正极电源正极→阳极;阴极→电源负极电能→化学能①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
电化腐蚀不纯金属,表面潮湿因原电池反应而腐蚀有电流产生电化腐蚀>化学腐蚀使较活泼的金属腐蚀析氢腐蚀水膜酸性较强 2H+ + 2e-==H2↑ Fe -2e-==Fe2+ 发生在某些局部区域内电镀受直流电作用用电解的方法在金属表面镀上一层金属或合金阳极 Cu -2e- = Cu2+ 阴极Cu2++2e- = Cu 反应类型自发的氧化还原反应由电极本身性质决定:电极名称正极:性质较不活泼的电极;负极:性质较活泼的电极。
应用电化学实验相关思考题的参考答案

1、原电池负极反应:Zn – 2e Zn2+正极反应:Cu2+ + 2e Cu原电池反应:Zn + Cu2+ Zn2+ + Cu电子流动方向:从负极流向正极。
盐桥的作用:盐桥消除或降低液接电势。
饱和KCl溶液的浓度高达4.2mol/L,当盐桥插入到浓度不大的两电解质溶液之间的界面时,产生了两个接界面,盐桥中K+和Cl-向外扩散就成为这两个接界面上离子扩散的主流。
由于K+和Cl-的扩散速率相近,使盐桥与两个溶液接触产生的液接电势均很小,且两者方向相反,故相互抵消后降至1~2mV。
选择盐桥中的电解质的原则是高浓度、正负离子迁移速率接近相等,且不与电池中溶液发生化学反应。
本次实验中采用琼脂-饱和KCl盐桥。
琼脂-饱和KCl盐桥做法:烧杯中加入3g 琼脂和97ml蒸馏水,使用水浴加热法将琼脂加热至完全溶解。
然后加入30克KCl 充分搅拌,KCl完全溶解后趁热用滴管或虹吸将此溶液加入已事先弯好的玻璃管中,静置待琼脂凝结后便可使用。
伏特计是用来测定锌铜原电池的电池电动势的,将盐桥取出后,由于降低或者消除了液接电势,所以伏特计读数降低。
2、金属的电化学腐蚀:马口铁与白铁皮的腐蚀(1)铁被腐蚀溶解并产生气泡。
(2)镀锌铁挫痕处锌被腐蚀,而镀锡铁挫痕处是铁被腐蚀。
原因:两种接触的金属加上腐蚀性物质(本次实验中的腐蚀性物质为HCl 和K3[Fe(CN)6] )组成了一个电化学腐蚀模型,白铁皮是镀锌铁,锌的化学性质较铁更活泼,所以是镀层表面的锌被腐蚀;马口铁是镀锡铁,锡的化学性质比铁要稳定,所以是镀层下面的铁被腐蚀。
3、缓蚀剂的作用(1)现象:铁钉被HCl溶解产生气泡。
加入苯胺后,气泡生成速度变慢。
原因:苯胺与HCl作用生成盐,束缚了溶液中的氢离子,起缓蚀作用。
(2)现象:加入乌托品的试管与加入水的试管相比,其颜色出现得慢、浅。
原因:乌托品是六次甲基胺,与HCl作用生成盐,束缚了溶液中的氢离子,起缓蚀作用。
4、电镀——在铁上镀铜画出电镀装置图即可。
应用电化学复习题(整理)

应用电化学复习题1.在其它条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而( )(A) 增大(B) 减小(C) 先增后减(D) 不变2.在298K的含下列离子的无限稀释的溶液中,离子摩尔电导率最大的是( )(a)A13+(b)Mg2+(c)H+(d)K+3.298K时,有浓度均为0.001mol·kg-1的下列电解质溶液,其离子平均活度系数最大的是( )(a) CuS04(b) CaCl2(c) LaCl3(d) NaCl4.298K时有相同浓度的NaOH(1)和NaCl(2)溶液,两个Na+的迁移数t1与t2之间的关系为( )(a) t1 = t2(b) t1 > t2(c)t1 < t2(d)无法比较5.NaCl稀溶液的摩尔电导率Λm与Na+、、C1-的淌度U+、U-之间关系为( )(a)Λm= U+ + U- (b)Λm=U+/F + U—/F(c)Λm= U+F + U-F (d)Λm= 2 (U+ + U-)6.Al2(S04)3的化学势μ与Al3+、SO42-的化学势μ+,、μ-之间的关系为( )(a) μ = μ++μ-(b) μ =2μ++3μ-(c) μ =3μ++2μ-(d) μ = μ+· μ-7.298 K 时,在下列电池Pt│H2(p∃)│H+(a=1)‖CuSO4(0.01 mol·kg-1)┃Cu(s)右边溶液中加入0.1 mol·kg-1 Na2SO4溶液时(不考虑稀释效应), 则电池的电动势将:(A) 上升(B) 下降(C) 基本不变(D) 无法判断8.下列对原电池的描述哪个是不准确的:( )(A) 在阳极上发生氧化反应(B) 电池内部由离子输送电荷(C) 在电池外线路上电子从阴极流向阳极(D) 当电动势为正值时电池反应是自发的9.如下说法中,正确的是:( )(A) 原电池反应的∆H < Q p(B) 原电池反应的∆H = Q r(C) 原电池反应体系的吉布斯自由能减少值等于它对外做的电功(D) 原电池工作时越接近可逆过程,对外做电功的能力愈大10.若算得电池反应的电池电动势为负值时,表示此电池反应是:( )(A) 正向进行(B) 逆向进行(C) 不可能进行(D) 反应方向不确定11.当电池的电动势E=0时,表示:()(A) 电池反应中,反应物的活度与产物活度相等(B) 电池中各物质都处于标准态(C) 正极与负极的电极电势相等(D) 电池反应的平衡常数K a=112. 在电池中,当电池反应达到平衡时,电池的电动势等于:( ) (A) 标准电动势 (B) ln RTK zF $ (C) 零 (D) 不确定13. 等温下,电极-溶液界面处电位差主要决定于: ( )(A) 电极表面状态(B) 溶液中相关离子浓度(C) 电极的本性和溶液中相关离子活度(D) 电极与溶液接触面积的大小14. 某电池反应为 2 Hg(l)+O 2+2 H 2O(l)=2 Hg 2++4 OH -,当电池反应达平衡时,电池的 E 必然是: ( )(A) E >0 (B) E =E ∃ (C) E <0 (D) E =015. 测定溶液的 pH 值的最常用的指示电极为玻璃电极, 它是:( )(A) 第一类电极 (B) 第二类电极(C) 氧化还原电极 (D) 氢离子选择性电极16. 有三种电极表示式: (1) Pt,H 2(p ∃)│H +(a =1), (2)Cu │Pt,H 2(p ∃)│H +(a =1),(3)Cu │Hg(l)│Pt,H 2(p ∃)│H +(a =1),则氢电极的电极电势彼此关系为 :( )(A) 逐渐变大 (B) 逐渐变小(C) 不能确定 (D) 彼此相等 17. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg 2Cl 2(s)|Hg(l)的化学反应是: ( )(A) 2Ag(s)+Hg 22+(aq) = 2Hg(l) +2Ag +(B) 2Hg+2Ag + = 2Ag +Hg 22+(C) 2AgCl+2Hg = 2Ag +Hg 2Cl 2(D) 2Ag+Hg 2Cl 2 = 2AgCl +2Hg18. 下列电池的电动势,哪个与Br -的活度无关:( ) (A) Ag(s)|AgBr(s)|KBr(aq)|Br 2(l),Pt(B) Z n(s)|ZnBr 2(aq)|Br 2(l),Pt(C) P t,H 2(g)|HBr(aq)|Br 2(l),Pt(D) Hg(l)|Hg 2Br 2(s)|KBr(aq)||AgNO 3(aq)|Ag(s)19. 298 K 时, 在下列电池 Pt │H 2(p ∃)│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s)右边溶液中通入 NH 3, 电池电动势将:( )(A) 升高 (B) 下降 (C) 不变 (D) 无法比较20. 如果规定标准氢电极的电极电势为1V ,则可逆电极的电极电势Ф0值和电池的电动势E 0值将有何变化 ( )(a)E0,Ф0各增加1V (b)E0和Ф0各减小1V(c)E0不变,Ф0增加1V (d)E0不变,Ф0减小1V21.下列电池中,电动势与Cl-的活度无关的是 ( )(a).Zn(s)|ZnCl2(a)|Cl2(p0)|Pt (b).Zn(s)|ZnCl2(a1)||KCI(a2)|AgCI(s)|Ag(c).Ag(s)|AgCI|KCI(a)|CI2(p0)|Pt(d).Pt|H2(p0)|HCI(a)|Cl2(p0)|Pt22.某电池反应为2Hg(1)+02+2H2O(1)=2Hg2++40H-,当电池反应达平衡时,电池的E必然是 (a)E>0 (b)E=E0 (c)E<0 (d)E=023.金属与溶液间电势差的大小和符号主要取决于 ( )(a)金属的表面性质 (b)溶液中金属离子的浓度(c)金属与溶液的接触面积 (d)金属的本性和溶液中原有的金属离子浓度24.不能用于测定溶液pH值的电极是 ( )(a)氢电极 (b)醌氢醌电极 (c)玻璃电极 (d)CI-|AgCI(s)|Ag电极25.下列4组组成不同的混合溶液,当Pb(s)插入各组溶液时,金属Sn有可能被置换出来的是(已知Ф0 (Sn2+,Sn)=-0.136VФ0 (Pb2+,Pb)=- 0.126V ( )(a)a(Sn2+)=1.0,a(Pb2+)=1.0 (b)a(Sn2+)=0.1,a(Pb2+)=1.0(c)a(Sn2+)=l.0,a(Pb2+)=0.1 (d)a(Sn2+)=0.5,a(Pb2+)=0.526.常见的燃料电池为: Pt,H2(p1)|NaOH(aq)|O2(p2),Pt,设其电动势为E1,如有另一电池可以表示为:Cu(s)|Pt|H2(p)|NaOH(aq)|O2(p)|Pt|Cu(s),其电动势为E2,若保持各物质的活度相同,则E1与E2的关系为:()(A) E1>E2(B) E1<E2(C) E1=E2(D) 无法判断27.极谱分析仪所用的测量阴极属于下列哪一种?( )(A) 浓差极化电极(B) 电化学极化电极(C) 难极化电极(D) 理想可逆电极28.用铜电极电解CuCl2的水溶液,不考虑超电势,在阳极上将会发生什么反应。
电化学原理部分思考题

第二章1 电化学体系中包括哪些相间电位?有何不同2 分析电化学反应和非电化学反应的氧化还原的区别3 比较原电池,电解池和腐蚀电池之间的不同1 电化学体系中包括哪些相间电位?有何不同2分析电化学反应和非电化学反应的氧化还原的区别答:电化学反应:不接触、不同地点、定向运动、电极电势、电能、可控制;非电化学的氧化还原反应:碰撞接触、同一地点、混乱运动、内能及活化能的比值、热效应。
3 比较原电池,电解池和腐蚀电池之间的不同2020-3-16作业题-第三章1 什么是电毛细现象,解释抛物线形状的电毛细曲线为什么具有极大值?2 为什么双电层的电容会随电极电位变化?3 理想极化电极和不极化电极的区别是什么?1 什么是电毛细现象,解释抛物线形状的电毛细曲线为什么具有极大值?答:对电极体系来说,界面张力不仅与界面层的物质组成有关,而且与电极电位有关。
这种界面张力随电极电位变化的现象叫做电毛细现象。
由李普曼公式⑴如果电极表面剩余电荷等于零,即无离子双电层存在时,则有q=0。
这种情况对应于电毛细曲线的最高点。
⑵当电极表面存在正的剩余电荷时,q>0,σϕ∂∂p 。
这对应于电毛细曲线的左半部分(上升分支)。
在这种情况下,电极电位变正,界面张力减小。
(3)当电极表面存在负的剩余电荷时,q<0,σϕ∂∂f 。
相对于电毛细曲线的右半部分(下降分支)。
此时,随电极电位变负,界面张力也不断减小。
2. 为什么双电层的电容会随电极电位变化?答:双电层结构的分散性随溶液浓度的增加和电极电位的绝对值而减小。
双电层结构分散性的减小意味着它的有效厚度减小,因而界面电容值增大。
3. 理想极化电极和不极化电极的区别是什么?答:当电极反应速率为0,电流全部用于改变双电层的电极体系的电极称为理想极化电极,可用于界面结构和性质的研究。
理想不极化电极是指当电极反应速率和电子反应速率相等时,极化作用和去极化作用平衡,无极化现象,通向界面的电流全部用于电化学反应,可用作参比电极。
高中化学专题复习《电化学及其应用》含答案
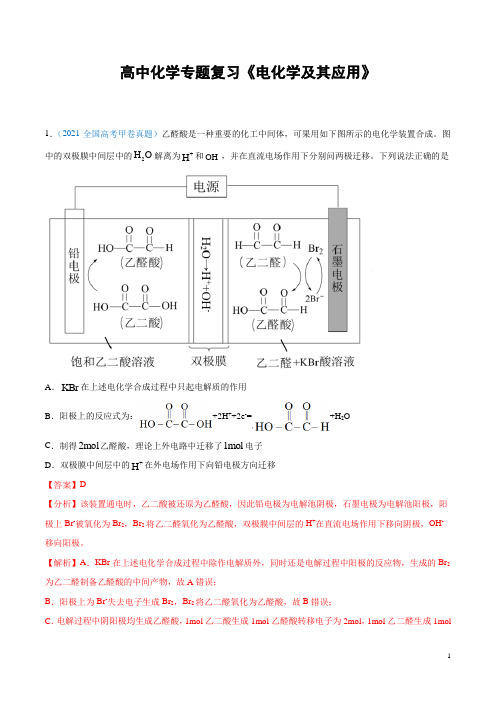
高中化学专题复习《电化学及其应用》1.(2021·全国高考甲卷真题)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。
图中的双极膜中间层中的2H O 解离为+H 和-OH ,并在直流电场作用下分别问两极迁移。
下列说法正确的是A .KBr 在上述电化学合成过程中只起电解质的作用B .阳极上的反应式为:+2H ++2e -=+H 2OC .制得2mol 乙醛酸,理论上外电路中迁移了1mol 电子D .双极膜中间层中的+H 在外电场作用下向铅电极方向迁移 【答案】D【分析】该装置通电时,乙二酸被还原为乙醛酸,因此铅电极为电解池阴极,石墨电极为电解池阳极,阳极上Br -被氧化为Br 2,Br 2将乙二醛氧化为乙醛酸,双极膜中间层的H +在直流电场作用下移向阴极,OH -移向阳极。
【解析】A .KBr 在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br 2为乙二醛制备乙醛酸的中间产物,故A 错误;B .阳极上为Br -失去电子生成Br 2,Br 2将乙二醛氧化为乙醛酸,故B 错误;C .电解过程中阴阳极均生成乙醛酸,1mol 乙二酸生成1mol 乙醛酸转移电子为2mol ,1mol 乙二醛生成1mol乙醛酸转移电子为2mol ,根据转移电子守恒可知每生成1mol 乙醛酸转移电子为1mol ,因此制得2mol 乙醛酸时,理论上外电路中迁移了2mol 电子,故C 错误;D .由上述分析可知,双极膜中间层的H +在外电场作用下移向阴极,即H +移向铅电极,故D 正确; 综上所述,说法正确的是D 项,故答案为D 。
2.(2021·全国高考乙卷真题)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是A .阳极发生将海水中的Cl 氧化生成2Cl 的反应B .管道中可以生成氧化灭杀附着生物的NaClOC .阴极生成的2H 应及时通风稀释安全地排入大气D .阳极表面形成的2Mg(OH)等积垢需要定期清理 【答案】D【分析】海水中除了水,还含有大量的Na +、Cl -、Mg 2+等,根据题干信息可知,装置的原理是利用惰性电极电解海水,阳极区溶液中的Cl -会优先失电子生成Cl 2,阴极区H 2O 优先得电子生成H 2和OH -,结合海水成分及电解产物分析解答。
应用电化学习题及答案

应用电化学,杨辉卢文庆 全书思考题和习题 第一章习题解答:1试推导下列各电极反应的类型及电极反应的过程。
(1)++→+242Ce e Ce解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种4Ce +借助于电极得到电子,生成还原态的物种2Ce+而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, (2)-→++OH e O H O 44222解:多孔气体扩散电极中的气体还原反应。
气相中的气体2O 溶解于溶液后,再扩散到电极表面,然后借助于气体扩散电极得到电子,气体扩散电极的使用提高了电极过程的电流效率。
(3)Ni e Ni →++22解:金属沉积反应。
溶液中的金属离子2Ni +从电极上得到电子还原为金属Ni ,附着于电极表面,此时电极表面状态与沉积前相比发生了变化。
(4)-+→++OH s MnOOH O H e s MnO )()(22解:表面膜的转移反应。
覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)2)(22OH Zn e OH Zn→-+-;--→+242])([2)(OH Zn OH OH Zn解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。
即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
高考化学复习《电化学极其应用》知识点解析及练习题含答案

1.了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因。
了解金属腐蚀的危害和防止金属腐蚀的措施。
电化学是氧化还原反应知识的应用和延伸,是历年高考的热点内容。
考查的主要知识点:原电池和电解池的工作原理、电极反应式的书写和判断、电解产物的判断、金属的腐蚀和防护。
对本部分知识的考查仍以选择题为主,在非选择题中电化学知识可能与工业生产、环境保护、新科技、新能源知识相结合进行命题。
复习时,应注意:1.对基础知识扎实掌握,如电极反应式的书写、燃料电池的分析等。
2.电化学问题的探究设计、实物图分析及新型电池的分析是近年来高考中的热点,通过在练习中总结和反思,提高在新情境下运用电化学原理分析解决实际问题的能力。
知识点一、原电池电极的判断以及电极方程式的书写1.原电池正、负极的判断方法:(1)由组成原电池的两极材料判断。
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断。
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
(5)电极增重或减轻。
工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。
(6)有气泡冒出。
高考化学复习《电化学极其应用》知识点解析及练习题含答案电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。
2.原电池电极反应式和总反应式的书写(1)题目给定原电池的装置图,未给总反应式:①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合介质判断出还原产物和氧化产物。
③写出电极反应式(注意两极得失电子数相等),将两电极反应式相加可得总反应式。
物理化学 电化学思考题

物理化学电化学思考题物理化学电化学思考题电化学思考题(请判别对错,并简单说明原因)1.通常把熔化在水或其它溶剂中具备电离性质的物质称作电解质(-)2.离子导体的电阻随其温度的增高而减小(-)3.凡是离子都带有电荷,因此它在溶液中的移动现象称为离子的电迁移现象.(-)4.在电迁移过程中,溶液中正、负离子传递的电量恰等于流过电极的电量.(-)5.离子淌度或离子电迁移率即为离子的运动速率(-)6.使用法拉第定律需注意温度和压力的条件(-)7.若在通电的电解质溶液中正、负离子的移动速率相同,电荷相同,则他们分摊导电任务的百分数也不相同(+)8.因为溶液是电中性的,溶液中正负离子所带的电量相等,所以正负离子的迁移数也相等.(-)9.离子的搬迁数与离子搬迁的速率成正比,当温度、浓度及某正离子的运动速率为一定时,其搬迁数也一定.(-)10.离子的迁移数是指该离子分担导电任务的分数,同一种离子在不同电解质中的迁移数总是相同(-)11.溶液中所有正负离子的搬迁数之和必定就是1.(+)12.在温度、电位梯度相同的情况下,无限稀释的氯化钾、氯化氢、氯化钠三种溶液中,氯离子的运动速率相同,但氯离子的迁移数不同(+)13.对只所含单一电解质所电离的也已负离子溶液,离子的青草度越大,其搬迁数也越大;但在混合电解质溶液中,离子青草度小的其搬迁数不一定也小.(+)14.一定温度下的叶唇柱溶液,电解质摩尔电导率随其溶液浓度增加而增加。
(-)15.对于强电解质水溶液,其电导率随其浓度的减少而减少。
(-)16.在水溶液中,带有相同电荷数的离子,其离子半径越大,则其迁移率和离子的摩尔电导率越小。
(-)17.离子的摩尔电导率与其价数有关,价数越高,离子的摩尔电导率越大,反之亦然.(-)18.离子独立运动定律是指溶液中每一种离子是独立移动的,不受其他离子的影响.(-)19.浓度藻酸的强电解质溶液的摩尔电导率与其浓度的平方根成直线关系。
(+)20.在恒温、恒压、可逆的放电过程中,电池所吸收的热量等于t△s。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
应用电化学复习思考题第一章一. 基本概念1.法拉第过程和非法拉第过程法拉第过程:即电荷经过电极/溶液界面进行传递而引起的某种物质发生氧化或还原反应时的过程,其规律符合法拉第定律,所引起的电流称法拉第电流。
非法拉第过程:在一定条件下,一定电势范围内施加电位时,电荷没有经过电极/溶液界面进行传递,而仅是电极溶液界面的结构发生变化的过程。
形成一定的界面结构只需耗用有限的电量,只会在外电路引起瞬间电流(与电容器充电过程相似)。
2.双电层电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧的现象。
3.极化在电极上有电流通过时,随着电极上电流密度的增加,电极实际分解电位值对平衡值的偏离也愈来愈大,这种对平衡电位的偏离称为电极的极化。
4.循环伏安法循环伏安法是指加在工作电极上的电势从原始电位E0开始,以一定速度v扫描到一定电势E1,再将扫描方向反向进行扫描到原始电位E0,然后在E0和E1之间进行循环扫描(循环三角波电压)。
二. 问答1.试说明参比电极具有的性能和用途。
用于测定研究电势的电极。
1.参比电极应具有良好的可逆性,电极电势符合Nernst方程2.参比电极应不易极化;3.参比电极应具有好的恢复性,4.参比电极应具有良好的稳定性5.参比电极应具有良好的重现性;2.试描述双电层理论的概要。
双电层理论的发展经历了若干发展阶段 1.亥姆荷茨(Helmholtz)模型(紧密层模型)2. 估依(Gouy)和恰帕曼(Chapman)模型3.斯特恩(Stern)模型(紧密层和分散层模型)、GCS(Gouy-Chapman-Stern)模型4. BDM(Bockris-Davanathan-Muller) 双电层模型。
(详见PPT 第一章82)3.什么是零电荷电势?零电荷电势有什么作用?可以用来测定零电荷电势的主要实验方法有哪些?电极表面不带电,相应的电极电势称为“零电荷电势”。
在计算电池的电动势时不能用合理电势处理电极过程动力学问题。
真正起作用的仍然是相对于某一参比电极测得的相对电极电势。
零电荷电势有一定参考意义。
通过测量电毛细曲线(液态金属电极,求得与最大界面张力所对应的电极电位值)和微分电容法4.试述电极反应的种类和机理。
主要类型:1. 简单电子迁移反应2.金属沉积反应3.表面膜的转移反应 4.伴随着化学反应的电子迁移反应 5.多孔气体扩散电极中的气体还原或氧化反应6.气体析出反应7.腐蚀反应机理:电极反应除简单电子迁移反应外,绝大多数电极反应过程是以多步骤进行的,如伴随电荷迁移过程的吸、脱附反应和化学反应。
伴随化学反应的电子迁移反应的机理:CE机理、 EC机理、催化机理、ECE机理5.试述电极过程的基本历程和特点。
历程:1. 物质传递:反应物从溶液本体相传递到电极表面以及产物从电极表面传递到本体溶液。
2. 电极/溶液界面的电子传递(异相过程)。
3.电荷传递反应前置或后续的化学反应:该反应可能是均相过程也可能是异相过程。
4. 吸脱附、电沉积等其他的表面的反应。
特点:1.电极是电子的传递介质,电极表面又是“反应地点”2.电极表面上存在双电层和表面电场,可以在一定范围内任意地和连续地改变电极表面的电场强度和方向,因而可以在一定范围内改变电极反应的活化能和反应速率6. 电化学反应的核心步骤是什么?电子转移步骤(电化学反应步骤)系指反应物质在电极/溶液界面得到电子或失去电子,从而还原或氧化成新物质的过程。
这一单元步骤包含了化学反应和电荷传递两个内容,是整个电极过程的核心步骤。
7. 物质传递的形式有哪些?物质传递形式有三种,即扩散(扩散是指在浓度梯度的作用下,带电的或不带电的物种由高浓度区向低浓度区的移动。
扩散过程可以分为非稳态扩散和稳态扩散两个阶段。
)、电迁移(电解质溶液中的带电粒子(离子)在电场作用下沿着一定的方向移动,这种现象就叫做电迁移。
)、对流(流体借助本身的流动携带物质转移的传质方式。
分为自然对流和强制对流)。
第二章一. 基本概念1.电催化在电场的作用下,存在于电极表面或溶液中的修饰物(可以是电活性的和非电活性的物种)能促进或抑制在电极上发生的电子转移反应,而电极表面或溶液相中的修饰物本身并不发生变化的一类化学作用。
2.火山型效应当中间态粒子具有适中的能量(适中的吸附键强度和覆盖度)时,往往具有最高的反应速率,称为“火山型效应”。
二. 问答1.电催化的主要类型有哪些?各自的特点是什么,彼此有什么区别?媒介体电催化中媒介体应具备哪些性质?类型:(1)氧化-还原电催化:催化剂本身发生了氧化还原反应(2)非氧化还原电催化:催化剂本身在催化过程中不发生氧化-还原反应,发生的电催化反应的电势与媒介体式电位有差别。
性质:(1).一般能稳定吸附或滞留在电极表面。
(2).氧化-还原的式电位与被催化反应发生的式电位相近,且氧化-还原电势与溶液的pH 值无关。
(3).呈现可逆电极反应的动力学特征,且氧化态和还原态均能稳定的存在。
(4).可与被催化的物质之间发生快速的电子传递。
(5).一般要求对氧气惰性或非反应活性。
2.评价电催化性能的方法有哪一些?试选择一种方法说明它是如何评价电催化性能的。
方法:循环伏安法、旋转圆盘(环盘)电极伏安法、计时电势法、稳态极化曲线的测定eg:通过施加一定的电势(或电流)于催化电极上,然后观测电流(或电势)随时间的变化,直到电流(或电势)不随时间而变化或随时间变化很小时,记录电势-电流的关系曲线。
3.试写出Tafel公式,并说明公式是哪些物理量的定量关系式?公式中常数a的物理意义及影响因素是什么?通过a值,可以将常见电极材料分为几种类型?Tafel公式表示氢气析出的超电势与电流密度的定量关系。
常数a的物理意义是:电流密度为1A/cm-2时超电势的数值,它与电极材料、电极表面状态、溶液组成及实验温度有关。
分为:低超电势金属、中超电势金属、高超电势金属4.简述氢气析出的总过程和基本步骤。
总过程:酸性介质中性或碱性介质基本步骤:(1). 电化学反应步骤:电化学还原产生吸附于电极表面的氢原子。
酸性介质中性或碱性介质(2).复合脱附步骤(3). 电化学脱附步骤酸性介质中性或碱性介质5.在氧气的电催化还原机理中,如何区分直接四电子和二电子途径?直接四电子途径与二电子反应途径的区别是“液相中没有产生过氧化物中间体”。
以“能否生成溶液中的过氧化氢”作为区分直接四电子和二电子途径的依据。
第三章一. 基本概念1.化学电源化学电源又称电池,是一种能将化学能直接转变成电能的装置,它通过化学反应,消耗某种化学物质,输出电能。
2.电池即化学电源3.二次电池又称蓄电池或可充电电池,为电池放电后可通过充电方法使活性物质复原后能够再放电,且充电、放电过程能反复多次循环进行的一类电池。
4.开路电位电池的开路电压是在无负荷情况下的电池电压。
5.燃料电池燃料电池是一种不经过燃烧,直接以电化学反应的方式将燃料和氧化剂的化学能转变成电能的连续发电装置。
6.自放电指由于电池中一些自发过程的进行而引起的电池容量的损失。
二. 问答1.简述锂离子电池的有哪些正极材料,各自有哪些优缺点?(1)层状结构材料(LiCoO2、LiNiO2等)前者实际比容量与理论值有较大差距;钴资源匮乏,成本高;有一定毒害。
后者不存在过充电现象,并具有价廉、无毒,制备困难,结构不稳定。
(2)尖晶石结构材料(LiMn2O4)资源丰富、价格低。
结构热稳定性差,易形成氧缺位,使得循环性能较差。
(3)动力电池正极材料(LiFePO4)优异的安全性能;优异的循环稳定性;适于大电流放电;成本低,环保。
离子迁移率低;电子导电率低。
2.质子交换膜燃料电池(PEMFC)和直接甲醇燃料电池(DMFC)各自的特点是什么?后者较前者不同之处是哪些?PEMFC: 电解质为具有离子电导的固态高分子聚合物的一类燃料电池。
直接甲醇燃料电池(DMFC)以质子交换膜或酸性电解液为电解质时反应。
第四章一.基本概念1. 金属电沉积是指简单金属离子或络离子通过电化学方法在固体(导体或半导体)表面上放电还原为金属原子附着于电极表面,从而获得一金属层的过程。
2. 电镀金属电沉积过程的一种,它是由改变固体表面特性从而改善外观,提高耐蚀性、抗磨性,增强硬度,提供特殊的光、电、磁、热等表面性质的金属电沉积过程。
3. 整平剂能够在微观不平整的镀件表面获得平整表面的添加剂。
4. 电泳涂装将水溶性的带有正电荷或负电荷的阳、阴离子树脂的电泳漆通过类似金属电镀的方法覆到金属表面,从而对金属进行精饰的一种电镀方法。
二. 问答1.电镀一般分为哪几种类型?电镀一般分为单金属电镀、合金电镀、复合电镀和熔盐电镀等几种类型。
2.水溶液中,金属离子阴极还原的规律和特点是什么?溶液中的任何金属离子,只要电极电势足够负,原则上都可能在电极上得到还原。
但是:若溶液中某一组分的还原电势较金属离子的还原电势更正时,则就不可能实现金属离子的还原。
如果阴极还原过程的产物是合金,由于还原产物中金属的活度一般要较纯金属的小、此时仍有可能实现金属的电沉积。
水溶液中金属的电沉积一般以第ⅥB族元素(Cr、Mo、W)为分界线。
越靠右边,则金属离子在电极上还原的可能性就越大。
3.电镀时常常加入络离子,请解释原因。
在金属电沉积过程中,为获得均匀、致密的镀层,常要求电沉积过程在较大的电化学极化条件下进行,而当简单金属离子的溶液中加入络离子时可使平衡电极电势变负,即可满足金属电沉积在较大的超电势下进行。
4.试述电结晶层结构随施加电势的变化关系。
当施加电势(负值)小时,电流密度低,晶面只有很小生长点,吸附原子表面扩散路程长,沉积过程的速度控制步骤是表面扩散。
当施加电势高(较大的负值)时,电流密度也大,晶面上生长点多,表面扩散容易进行,电子传递成为速度控制步骤。
5.评价电镀层质量的重要指标是什么?影响镀层的质量因素主要有镀液的组成及性能、电镀工艺、阳极等因素的影响,其中电镀工艺中又包括如电流密度、温度、pH值、溶液的搅拌等。
6.复合电镀中的固体微粒有哪几种?分别是什么?第一类是提高镀层耐磨性的高硬度、高熔点、耐腐蚀的微粒如-,-Al2O3,SiO2,SiC,TiC,TiO2,金刚石等;第二类是提供自润滑特性的固体润滑剂微粒,这类颗粒有MoS2,聚四氟乙烯、氟化石墨(CF)m、石墨等;第三类是提供具有电接触功能的微粒,如WC,SiC,BN等。
7. 电镀工艺一般包括哪些步骤?电镀生产工艺流程一般包括镀前处理、电镀和镀后处理三大步。
8. 要在塑料表面实现金属化涂装必须具备哪些条件?阴极电泳涂装的优点是什么?条件:(1)镀层与基底之间不是简单的结合,而必须牢固、坚实、经久耐用;(2)外观及成本须符合使用要求。
