应用电化学简单题附答案
应用电化学简单题附答案

应⽤电化学简单题附答案1.何谓电⽑细曲线?何谓零电荷电势?由lippman 公式可进⼀步得到界⾯双电层的微分电容Cd ,请给出Cd 的数学表达式。
答:①将理想极化电极极化⾄不同电势(Φ),同时测出相应的界⾯张⼒(σ值),表征Φ-6关系的曲线为“电⽑细曲线”。
②“零电荷电势”是指σ-Φ曲线上最⾼点处d σ/d Φ=0即q=0(表⾯不带有剩余电荷)相应的电极电势,⽤Φ0表⽰。
③由lippman 公式:q=-(d σ/d Φ)µ1 ,µ2 ,...µi ;及Cd=dq/d Φ得Cd=-d 2σ/d Φ22.何谓电化学极化?产⽣极化的主要原因是什么?试分析极化在电解⼯业(如氯碱⼯业)﹑电镀⾏业和电池⼯业的利弊。
答:①电化学极化是指外电场作⽤下,由于电化学作⽤相对于电⼦运动的迟缓性改变了原有的电偶层⽽引起电极电位变化。
(即电极有净电流通过时,阴、阳电流密度不同,使平衡状态受到了破坏,⽽发⽣了电极电位的“电化学极化”)。
②原因:电化学反应迟缓、浓差极化。
③从能量⾓度来看,极化对电解是不利的;超电势越⼤,外加电压越⼤,耗能⼤。
极化在电镀⼯业中是不利的,氢在阴极上析出是不可避免的副反应,耗能⼤,但同时使阴极上⽆法析出的⾦属有了析出的可能。
极化使电池放电时电动势减少,所做电功也减⼩,对电池⼯业不利3.参⽐电极需选⽤理想极化电极还是不极化电极?⽬前参⽐电极有那些类型?选择参⽐电极需考虑什么?答:①参⽐电极选⽤理想不极化电极。
②类型:标准氢电极,饱和⽢汞电极,Ag/Agcl 电极,Hg/HgO/OH -电极。
③考虑的因素:电极反应可逆,稳定性好,重现性好,温度系数⼩以及固相溶解度⼩,与研究体系不反应4.零电荷的电势可⽤哪些⽅法测定?零电荷电势说明什么现象?能利⽤零电荷电势计算绝对电极电位吗?答:①电⽑细法和微分电容法。
②零电荷电势表明了“电极/溶液”界⾯不会出现由于表⾯剩余电荷⽽引起的离⼦双电层现象;③不能将此电势看成相间电势的绝对零点,该电势也是在⼀定参⽐电极下测得的,所以不能⽤于计算绝对电极电位。
完整版)电化学练习题带答案

完整版)电化学练习题带答案1.铁镍蓄电池是一种常见的电池,其放电反应为Fe +NiO3 + 3H2O → Fe(OH)2 + 2Ni(OH)2.下列说法中,错误的是:A。
电池的电解液为碱性溶液,正极为NiO3,负极为Fe。
B。
电池放电时,负极反应为Fe + 2OH- → Fe(OH)2 + 2e。
C。
电池充电过程中,阴极附近溶液的pH降低。
D。
电池充电时,阳极反应为2Ni(OH)2 + 2OH- + 2e → NiO3 + 3H2O。
2.当镀锌铁发生析氢腐蚀时,有0.2mol电子发生转移。
正确的说法是:④在标准状况下有1.12L气体放出。
3.某固体酸燃料电池以CsHSO4固体为电解质传递H,其基本结构如图,电池总反应可表示为:2H2 + O2 → 2H2O。
以下说法正确的是:A。
电子通过外电路从b极流向a极。
B。
b极上的电极反应式为:O2 + 2H2O + 4e → 4OH-。
C。
每转移0.1mol电子,消耗1.12L的H2.D。
H由a极通过固体酸电解质传递到b极。
4.如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。
甲醇在催化剂作用下提供质子(H)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH + 3O2 → 2CO2 + 4H2O。
以下说法中,错误的是:A。
右边的电极为电池的负极,b处通入的是空气。
B。
左边的电极为电池的正极,a处通入的是甲醇。
C。
电池负极的反应式为:2CH3OH + 2H2O - 12e → 2CO2↑ + 12H+。
D。
电池正极的反应式为:3O2 + 12H+ + 12e → 6H2O。
5.铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4 →2PbSO4 + 2H2O。
以下判断不正确的是:A。
K闭合时,d电极反应式:PbSO4 + 2H2O - 2e → PbO2 + 4H+。
B。
当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol。
高中化学专题复习《电化学及其应用》含答案
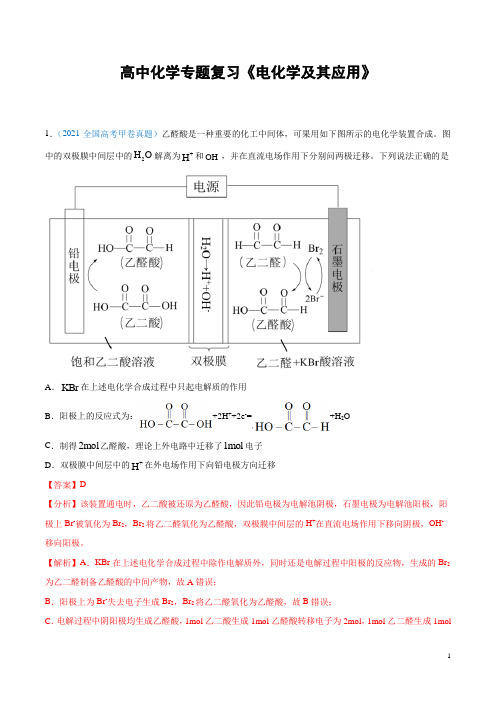
高中化学专题复习《电化学及其应用》1.(2021·全国高考甲卷真题)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。
图中的双极膜中间层中的2H O 解离为+H 和-OH ,并在直流电场作用下分别问两极迁移。
下列说法正确的是A .KBr 在上述电化学合成过程中只起电解质的作用B .阳极上的反应式为:+2H ++2e -=+H 2OC .制得2mol 乙醛酸,理论上外电路中迁移了1mol 电子D .双极膜中间层中的+H 在外电场作用下向铅电极方向迁移 【答案】D【分析】该装置通电时,乙二酸被还原为乙醛酸,因此铅电极为电解池阴极,石墨电极为电解池阳极,阳极上Br -被氧化为Br 2,Br 2将乙二醛氧化为乙醛酸,双极膜中间层的H +在直流电场作用下移向阴极,OH -移向阳极。
【解析】A .KBr 在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br 2为乙二醛制备乙醛酸的中间产物,故A 错误;B .阳极上为Br -失去电子生成Br 2,Br 2将乙二醛氧化为乙醛酸,故B 错误;C .电解过程中阴阳极均生成乙醛酸,1mol 乙二酸生成1mol 乙醛酸转移电子为2mol ,1mol 乙二醛生成1mol乙醛酸转移电子为2mol ,根据转移电子守恒可知每生成1mol 乙醛酸转移电子为1mol ,因此制得2mol 乙醛酸时,理论上外电路中迁移了2mol 电子,故C 错误;D .由上述分析可知,双极膜中间层的H +在外电场作用下移向阴极,即H +移向铅电极,故D 正确; 综上所述,说法正确的是D 项,故答案为D 。
2.(2021·全国高考乙卷真题)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是A .阳极发生将海水中的Cl 氧化生成2Cl 的反应B .管道中可以生成氧化灭杀附着生物的NaClOC .阴极生成的2H 应及时通风稀释安全地排入大气D .阳极表面形成的2Mg(OH)等积垢需要定期清理 【答案】D【分析】海水中除了水,还含有大量的Na +、Cl -、Mg 2+等,根据题干信息可知,装置的原理是利用惰性电极电解海水,阳极区溶液中的Cl -会优先失电子生成Cl 2,阴极区H 2O 优先得电子生成H 2和OH -,结合海水成分及电解产物分析解答。
高中化学电化试题及答案

高中化学电化试题及答案1. 单选题:下列关于电解水实验的描述中,正确的是:A. 电解水时,连接电源负极的一端产生的气体是氧气B. 电解水时,连接电源正极的一端产生的气体是氧气C. 电解水时,产生的氢气和氧气体积比为1:2D. 电解水时,产生的氢气和氧气体积比为2:1答案:D2. 填空题:在电解池中,阳极发生______反应,阴极发生______反应。
答案:氧化;还原3. 判断题:电解池中,电流通过电解质溶液时,溶液中的离子会向相反的电极移动。
A. 正确B. 错误答案:A4. 多选题:下列关于电镀的描述中,正确的有:A. 电镀是一种利用电解原理在金属表面镀上一层金属膜的过程B. 电镀过程中,镀层金属作为阴极C. 电镀过程中,待镀金属作为阳极D. 电镀过程中,待镀金属作为阴极答案:A, D5. 简答题:请简述电解池和原电池的区别。
答案:电解池和原电池都是基于氧化还原反应的电化学装置,但它们的主要区别在于能量的转换方向。
电解池是将电能转换为化学能的装置,通过外部电源提供电能,使电解质中的离子发生氧化还原反应。
而原电池则是将化学能转换为电能的装置,它利用自发的氧化还原反应产生电流。
在电解池中,阳极发生氧化反应,阴极发生还原反应;而在原电池中,阳极发生氧化反应,阴极发生还原反应。
此外,电解池需要外部电源供电,而原电池则能够自发产生电流。
6. 实验题:设计一个简单的实验,验证锌和铜的电化学活性顺序。
答案:实验步骤如下:(1) 准备一根锌棒和一根铜棒,以及一个电源和导线。
(2) 将锌棒和铜棒分别连接到电源的正负极。
(3) 观察连接铜棒的电极上是否有气泡产生。
(4) 根据实验现象,可以得出锌比铜更容易失去电子,因此锌的电化学活性比铜高。
7. 计算题:在电解饱和食盐水的实验中,若通电时间为2小时,电流强度为1安培,计算生成氢气和氯气的体积(标准状况下)。
答案:根据法拉第定律,Q = It,其中Q是电量,I是电流强度,t是时间。
电化学原理及其应用(习题及答案)

电化学原理及其应用(习题及答案)work Information Technology Company.2020YEAR第六章电化学原理及其应用一、选择题1.下列电极反应中,溶液中的pH值升高,其氧化态的氧化性减小的是( C )A. Br2+2e = 2Br-B. Cl2+2e=2Cl—C. MnO4—+5e+8H+=2Mn2++4H2OD. Zn2++2e=Zn2.已知H2O2在酸性介质中的电势图为 O2 0.67V H2O2 1.77V H2O,在碱性介质中的电势图为O2-0.08V H2O2 0.87V H2O,说明H2O2的歧化反应(C)A.只在酸性介质中发生B.只在碱性介质中发生C.无论在酸、碱性介质中都发生D.与反应方程式的书写有关3.与下列原电池电动势无关的因素是 Zn | Zn2+‖H+,H2 | Pt (B)A. Zn2+的浓度B. Zn电极板的面积C.H+的浓度D.温度4.298K时,已知Eθ(Fe3+/Fe)=0.771V,Eθ(Sn4+/Sn2+)=0.150V,则反应2Fe2++Sn4+=2Fe3++Sn2+的△r G mθ为(D)kJ/mol。
A. -268.7B. -177.8C. -119.9D. 119.95.判断在酸性溶液中下列等浓度的离子哪些能共存(D)A Sn2+和Hg2+ B. SO32—和MnO4—C. Sn4+和FeD. Fe2+和Sn4+已知Eθ(Hg2+/Hg)=0.851V,Eθ(Sn4+/Sn2+)=0.15V ,Eθ(MnO4—/Mn2+)=1.49V Eθ(SO42—/H2SO3)=1.29V ,Eθ(Fe2+/Fe)= —0.44V6.已知下列反应在标准状态下逆向自发进行Sn4++Cu = Sn2++Cu2+Eθ(Cu2+/Cu)=(1) , Eθ(Sn4+/Sn2+)=(2) 则有(C)A. (1) = (2)B. (1)<(2)C. (1)>(2)D. 都不对二、填空题1.将下列方程式配平3 PbO2 + 2 Cr3+ + ____H2O___ =1 Cr2O72— + 3 Pb2+ + __2H+___ (酸性介质)2 MnO2 +3 H2O2 +__2OH-___ =2 MnO4— + ___4H2O______ (碱性介质)2.现有三种氧化剂Cr2O72—,H2O2,Fe3+,若要使Cl—、Br—、I—混合溶液中的I—氧化为I2,而Br-和Cl-都不发生变化,选用Fe3+最合适。
电化学方法原理和应用习题答案

电化学方法原理和应用习题答案1. 电化学方法的原理电化学方法是一种利用电化学过程来研究物质性质和进行分析的方法。
它基于物质与电流之间的相互作用,通过测量电流、电势和电荷量等参数来获得与物质性质相关的信息。
电化学方法的原理基于两个基本的电化学过程:电解和电化学反应。
电解是指通过外加电势将电解质溶液中的离子转化为氧化还原反应中的氧化剂和还原剂。
电化学反应是指在电极表面发生的氧化还原反应,通过测量电极电势的变化来了解物质的电化学性质。
2. 电化学方法的应用2.1 电化学分析:电化学分析是利用电化学方法来定量或定性地分析化合物和物质的方法。
常见的电化学分析方法包括电位滴定法、极谱法、电位滴定法等。
这些方法可以广泛应用于环境监测、水质分析、生化分析等领域。
2.2 电化学腐蚀研究:电化学腐蚀研究是通过电化学方法来研究和评估材料在特定环境条件下的腐蚀性能。
它可以帮助我们了解材料在不同环境中的腐蚀行为,并采取措施来延缓或防止材料的腐蚀。
2.3 电化学储能:电化学储能是指利用电化学反应来存储和释放能量的技术。
常见的电化学储能装置包括电池和超级电容器。
电化学储能技术在电动汽车、可再生能源储存、能量回收等领域有着广泛的应用。
2.4 电化学合成:电化学合成是通过电流驱动反应来合成化合物的方法。
它可以用于有机合成、金属粉末的制备等。
电化学合成具有高选择性、高效率等优点,是一种绿色、可持续发展的合成方法。
3. 习题答案3.1 问题1:电解质溶液中是如何进行电解的?电解质溶液中的电解过程可以分为两个步骤:阳极反应和阴极反应。
在阳极处,氧化反应会发生,而在阴极处会进行还原反应。
阳极和阴极之间通过电解质溶液中的离子传递电荷。
3.2 问题2:电极电势的测量原理是什么?电极电势可以通过将电极与参比电极相连,通过测量电势差来确定。
参比电极是一个具有已知电势的电极,它提供了一个稳定的电势参考。
电极与参比电极之间的电势差可以通过测量电流或电势差来确定。
必刷题 电化学及其应用(解析版)
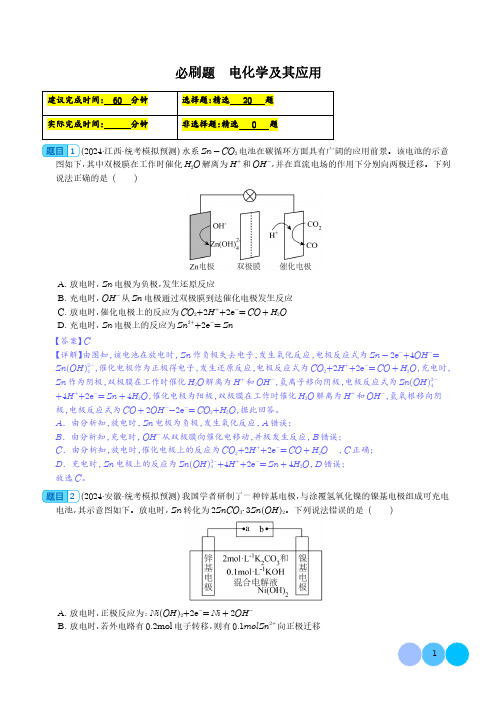
必刷题电化学及其应用建议完成时间:60分钟选择题:精选20题实际完成时间:分钟非选择题:精选0题1(2024·江西·统考模拟预测)水系Zn-CO2电池在碳循环方面具有广阔的应用前景。
该电池的示意图如下,其中双极膜在工作时催化H2O解离为H+和OH-,并在直流电场的作用下分别向两极迁移。
下列说法正确的是()A.放电时,Zn电极为负极,发生还原反应B.充电时,OH-从Zn电极通过双极膜到达催化电极发生反应C.放电时,催化电极上的反应为CO2+2H++2e-=CO+H2OD.充电时,Zn电极上的反应为Zn2++2e-=Zn【答案】C【详解】由图知,该电池在放电时,Zn作负极失去电子,发生氧化反应,电极反应式为Zn-2e-+4OH-=Zn(OH)2-4,催化电极作为正极得电子,发生还原反应,电极反应式为CO2+2H++2e-=CO+H2O,充电时,Zn作为阴极,双极膜在工作时催化H2O解离为H+和OH-,氢离子移向阴极,电极反应式为Zn(OH)2-4+4H++2e-=Zn+4H2O,催化电极为阳极,双极膜在工作时催化H2O解离为H+和OH-,氢氧根移向阴极,电极反应式为CO+2OH--2e-=CO2+H2O,据此回答。
A.由分析知,放电时,Zn电极为负极,发生氧化反应,A错误;B.由分析知,充电时,OH-从双极膜向催化电移动,并极发生反应,B错误;C.由分析知,放电时,催化电极上的反应为CO2+2H++2e-=CO+H2O ,C正确;D.充电时,Zn电极上的反应为Zn(OH)2-4+4H++2e-=Zn+4H2O,D错误;故选C。
2(2024·安徽·统考模拟预测)我国学者研制了一种锌基电极,与涂覆氢氧化镍的镍基电极组成可充电电池,其示意图如下。
放电时,Zn转化为2ZnCO3⋅3Zn(OH)2。
下列说法错误的是()A.放电时,正极反应为:Ni(OH)2+2e-=Ni+2OH-B.放电时,若外电路有0.2mol电子转移,则有0.1molZn2+向正极迁移C.充电时,a为外接电源负极D.充电时,阴极反应为:2ZnCO3⋅3Zn(OH)2+10e-=5Zn+2CO2-3+6OH-【答案】B【详解】放电时,锌基电极为负极,Zn转化为2ZnCO3⋅3Zn(OH)2,电极反应式为:5Zn+2CO2-3+6OH--10e-=2ZnCO3⋅3Zn(OH)2,镍基电极为正极,电极反应式为:Ni(OH)2+2e-=Ni+2OH-,充电时,a接电源负极,锌基电极为阴极,电极反应式为:2ZnCO3⋅3Zn(OH)2+10e-=5Zn+2CO2-3+6OH-,b接电源正极,镍基电极为阳极,电极反应式为:Ni+2OH--2e-=Ni(OH)2。
应用电化学习题及答案

应用电化学,辉卢文庆 全书思考题和习题 第一章习题解答:1试推导下列各电极反应的类型及电极反应的过程。
(1)++→+242Ce e Ce解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种4Ce +借助于电极得到电子,生成还原态的物种2Ce+而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, (2) -→++OH e O H O 44222解:多孔气体扩散电极中的气体还原反应。
气相中的气体2O 溶解于溶液后,再扩散到电极表面,然后借助于气体扩散电极得到电子,气体扩散电极的使用提高了电极过程的电流效率。
(3) Ni e Ni→++22解:金属沉积反应。
溶液中的金属离子2Ni +从电极上得到电子还原为金属Ni ,附着于电极表面,此时电极表面状态与沉积前相比发生了变化。
(4) -+→++OH s MnOOH O H e s MnO )()(22解:表面膜的转移反应。
覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)2)(22OH Zn e OH Zn→-+-;--→+242])([2)(OH Zn OH OH Zn解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。
即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.何谓电毛细曲线?何谓零电荷电势?由lippman 公式可进一步得到界面双电层的微分电容Cd,请给出Cd的数学表达式。
答:①将理想极化电极极化至不同电势(①),同时测出相应的界面张力(c值),表征①-6关系的曲线为“电毛细曲线”。
②“零电荷电势” 是指c -①曲线上最高点处d c /d①=0即q=0(表面不带有剩余电荷)相应的电极电势,用①0表示。
③由lippman 公式:q=- (d c/d①)卩i ,卩2, (i)及Cd=dq/d①得Cd=-d2c/d ①22•何谓电化学极化?产生极化的主要原因是什么?试分析极化在电解工业(如氯碱工业)、电镀行业和电池工业的利弊。
答:①电化学极化是指外电场作用下,由于电化学作用相对于电子运动的迟缓性改变了原有的电偶层而引起电极电位变化。
(即电极有净电流通过时,阴、阳电流密度不同,使平衡状态受到了破坏,而发生了电极电位的“电化学极化”)。
②原因:电化学反应迟缓、浓差极化。
③从能量角度来看,极化对电解是不利的;超电势越大,外加电压越大,耗能大。
极化在电镀工业中是不利的,氢在阴极上析出是不可避免的副反应,耗能大,但同时使阴极上无法析出的金属有了析出的可能。
极化使电池放电时电动势减少,所做电功也减小,对电池工业不利3•参比电极需选用理想极化电极还是不极化电极?目前参比电极有那些类型?选择参比电极需考虑什么?答:① 参比电极选用理想不极化电极。
②类型:标准氢电极,饱和甘汞电极,Ag/Agcl 电极,Hg/HgO/OH-电极。
③考虑的因素:电极反应可逆,稳定性好,重现性好,温度系数小以及固相溶解度小,与研究体系不反应4. 零电荷的电势可用哪些方法测定?零电荷电势说明什么现象?能利用零电荷电势计算绝对电极电位吗?答:①电毛细法和微分电容法。
②零电荷电势表明了“电极/溶液”界面不会出现由于表面剩余电荷而引起的离子双电层现象;③不能将此电势看成相间电势的绝对零点,该电势也是在一定参比电极下测得的,所以不能用于计算绝对电极电位。
5. 为什么卤素离子在汞电极上吸附依F< Cl < I 的顺序而增强,特性吸附在电毛细曲线和微分电容曲线上有何表现?答:①卤素离子为表面活性物质,阴离子吸附主要发生在比零电荷电势更正的电势范围,由于F-、c 「、I■离子半径依次增大,可极化度增大,吸附能力增强,所以在汞电极上,l->c「>F-.②特性吸附在两种曲线上的左半支曲线不同,零电荷电势负移。
6•何谓非稳态扩散?其初始条件和一个边界条件是什么?另一边界条件由极化条件决定。
答:①非稳态扩散:在电化学反应开始阶段,由于反应粒子浓度变化幅度较小,液相传质不足,粒子被消耗,此时浓度极化处于发展阶段,称之为传质过程的非稳态阶段②初始条件:C i (x,0)=C i0开始电极前扩散粒子完全均匀分布在液相中。
边界条件:C i (^,t)=C i0,无穷远处不出现浓度极化。
③另一边界条件:极化条件7. 溶液中有哪几种传质方式,产生这些传质过程的原因是什么?答:对流、扩散、电迁移。
①对流:由于流体各部分之间存在浓度或温度差或者外部机械作用力下所引起;②扩散:由于某一组分存在浓度梯度,粒子由高浓度向低浓度转移;③电迁移:在外电场作用下,液相中带电粒子作定向移动。
8. 稳态扩散和非稳态扩散的特点是什么,可以用什么定律来表示?答:①稳态扩散:扩散粒子的浓度只与距离有关,与时间无关。
用Fick第一定律表示, J表示扩散流量。
②非稳态扩散:扩散粒子的浓度同时是距离和时间的函数。
用Fick第二定律9. 说明标准电极反应速度常数k s和交换电流密度i0的物理意义,并比较两者的区别。
答:①k s:当电极电势为反应体系的标准平衡及反应粒子为单位浓度时,电极反应进行的速率(md/s)。
i°:反应在平衡电势下的电流密度,即有i0=i a=i k②相同点:数值越大,表示该反应的可逆性越强。
不同点:k S与浓度无关,i0与反应体系各种组分的浓度有关。
10. 为什么有机物在电极上的可逆吸附总是发生在一定的电位区间内?答:越正的电势,有机物易被氧化;电势越负,易被还原,因此其可逆吸附发生在平衡电势附近值,即一定的电位区间内。
11. 试说明锂离子电池的正极和负极材料是何物质?为什么其溶剂要用非水有机溶剂?锂离子电池比一般的二次电池具有什么特点?答:①正极:主要是嵌锂化合物,包括三维层状的LiCoQ 丄iNiO 2,三维的TiO?。
负极:主要是碳素材料,如石墨、碳纤维。
②锂遇水反应生成H2, 可能有爆炸的危险,所以要用非水有机溶剂。
③ 特点:工作电压高,比能量高,稳定性好,寿命长,自放电小,无记忆效应,工作温度范围宽,不含有害金属铅、镉,无污染。
12. 何谓电池的放电曲线?从放电曲线可得到那些有关电池性能的信息?答:①放电曲线:在指定负载和温度下放电时,工作电压随时间的变化曲线;②从曲线上可知工作电压、终止电压、开路电压、理论电动势的值,放电平台越长,电池性能越好。
13. 如何得到Eva ns图?从该图可达到那些电化学信息?在一般条件下钢铁发生吸氧腐蚀,说明钢铁腐蚀过程的控制步骤是什么?答:①Evans图即腐蚀极化图,这种图是把表征腐蚀电池的阴、阳极极化曲线画在同一图上而成的②从该图可知极化曲线较陡,表明电极的极化率较大,反应阻力大;反之,反应容易进行。
极化作用使阴阳的电位交于一点,对应电位为腐蚀电位(Ecorr),电流为腐蚀电流(Icorr);金属以此电流不断地腐蚀。
③过程:阴极氧的扩散14. 钢铁腐蚀使用的电化学保护主要有几种?简述它们的基本原理。
答:阳极保护法和阴极保护法。
原理:阳极保护法是把被保护金属变成阳极,用极化的方式使金属钝化,并维持稳定状态,腐蚀速率降低,得以保护。
阴极保护法是提供阴极极化,改变金属表面电子能级结构,使金属电位负移进入免蚀区。
15•两种金属共沉积形成合金的基本条件是什么?如何才能实现合金电沉积?答:①基本条件:析出电位十分相近或相等;② 若析出电位相差较小,可采用改变浓度和改变沉积电流密度;若相差较大,可采用加入络合剂和添加剂。
16. —般金属镀层大多为多晶体,试根据金属电结晶理论,若要得到晶体细小的镀层一般要采用什么措施进行电沉积?答:即抑制核的生长速度,通过增加阴极极化、适当的降低主盐浓度,在较大的电流密度下进行电沉积。
17. 目前氯碱工业阳极广泛使用形稳电极代替石墨,其组成是什么?什么叫形稳电极?答:DSA的组成:以钛为基地,涂镀Ti02、RuO2 加催化剂(Pt、PbO2)。
形稳电极是指电解过程中耐腐蚀、尺寸稳定、寿命长的不溶性阳极。
18. 二次电池要求充放电反应可逆性要好,一般要求电极的结构具备什么特点?试举例说明之。
答:如锂离子电池,电极材料二维层状;自由嵌入、嵌出;体积膨胀率小;尖晶石,三维轨道结构。
19. 镍氢电池(储氢电池)是一种重要的二次电池,该电池正极和负极材料是何物质?写出电池反应。
何谓储氢合金?答:①正极材料:Ni(OH)2;负极:混合稀土氢合金(LaNiH x)或钛镍合金(MH x)。
电池反应:M N Ni5H6+6NiOH M z Ni+6Ni (OH)2储氢合金:在一定条件下可逆的吸收放出H2的新型合金。
20. 海洋性环境下钢铁主要发生电化学腐蚀,其阴极电极反应主要是什么反应?控制步骤是什么?答:①阴极反应为吸氧反应:O2+4H++4e— 2H2O②控制步骤:氧的扩散步骤21. 何谓电解提取?何谓电解精炼?举例说明两者之间的区别?答:①电解提取:直接利用通电的方式提取电解质中的金属。
②电解精炼:利用电解方法将含有金属的物质进行提纯。
③区别:电解提取采用不溶性阳极,如以Pt为电极,电解Al 2O3得到Al ;电解精炼采用可溶性阳极,如以粗铜为阳极,用以精炼.22. 试叙述赫尔槽的结构特点和在电镀中的用途。
答:特点:阴极各个部位与阳极的距离不同,有近端与远端,其电流密度不同。
用途:①确定渡液各组分的合适含量;②确定渡液中添加剂或杂质的大致含量;③可用于选择不同的操作条件,如改变为温度,pH值、电流密度23. 与其它阴极过程相比,金属电沉积有何特点?答:①液相传质,反应粒子向电极表面迁移;② 前置转化,发生化学转化反应;③电荷传递,反应粒子还原为吸附态金属原子;④电结晶,吸附态金属原子形成晶体。
24. 采用钢铁电极以丙稀氰为主要原料电合成己二氰,写出阴极和阳极反应?答:阴极:2CH2=CHCN+2H++2e— NC(CH2)4CN 阳极:H20—20—1/2O2+2H+25. 碱性锌氧化银电池以锌粉为负极,以氧化银粉(Ag20)压制成正极,电解液为饱和了锌酸盐的浓碱溶液试写出其正极反应,负极反应,电池反应。
答:正极:负极:总反应:26. 试述有关化学电源主要性能的概念,如电动势、开路电压、工作电压、截止电压。
答:①电动势E:电池两极在断路且处于可逆平衡状态时两极电势之差。
②开路电压U:电池两极在断路时的稳定电极电势之差。
③工作电压V: 有电流通过外电路时,两极的电势差。
④截止电压:放电时,电压下降到不宜继续放电的最低工作电压。
⑤数值:E>U> V截止电压27. 防止钢铁腐蚀主要措施有?答:①阴极保护法中的外加电流法;②涂防锈漆;③镀上惰性金属镀层;④用缓蚀剂加以保护28. 什么是析氢腐蚀和耗氧腐蚀?答:①析氢腐蚀:以H"还原反应为阴极,生成“ 的过程。
②耗氧腐蚀:消耗O的还原反应为阴极,生成OH或HO的过程。
碱性介质:2HO+2e=H+2OH (析氢)1/2O 2+2e+HO=2OH(耗氧)酸性介质:2H h+2e-=H l (析氢)2H ++1/2Q+2e=HO(耗氧)29. 阴极保护的方法有哪几种,画图并简述一下各种方法,也可举例说明。
答:①外加电流法:在电解质中加入辅助电极,将需要保护的金属基体连接到外电源负极,调节施加电流,从而保护金属。
图示,把阴极极化曲线的电流调到a点,对应的腐蚀电流I corr '即I a 变小,若调制b点,则为0,起到对阴极的保护。
②牺牲阳极法:在金属基体上附上更活泼的金属,构成短路的原电池,活泼金属为阳极,不断溶解,阴极得到保护,例:钢板上镀锌,防止被海水腐蚀。
30. 发生钝化的金属或合金具有的一些特点?有哪几种主要的钝化理论?答:①特点:形成致密氧化膜,隔离腐蚀介质,包括Al。
Cr、Ti。
②理论:成相膜理论和吸附理论。
31. 什么叫缓冲剂,其防蚀机理如何?答:①缓蚀剂:加入到一定介质中能明显抑制金属腐蚀的少量物质。
②机理:形成氧化膜促进钝化;形成沉淀膜;形成吸附膜32. 金属离子还原继而形成结晶层的电结晶一般过程由哪些基本步骤组成及次序?答:①溶液中的离子向电极表面扩散一②电子迁移反应—③失去溶剂化外壳,形成吸附原子—④ 吸附原子经表面扩散,到缺陷等位置一⑤电还原的金属原子聚集,核化—⑥结合到晶格中,核化生长—⑦沉积物的结晶及形态发展31、什么是电解的电流效率和电能效率?两者区别是?n I =n E=区别:电流效率反映副反应的程度大小,电能效率反映能量的利用率32. 简述电解冶金的方法,并说出电解冶金与火法冶金比较有哪些特点?答:①电解治金可分为水溶液电解,熔盐电解,有机溶剂电解。
