应用电化学部分习题答案(供参考)
完整版)电化学练习题带答案

完整版)电化学练习题带答案1.铁镍蓄电池是一种常见的电池,其放电反应为Fe +NiO3 + 3H2O → Fe(OH)2 + 2Ni(OH)2.下列说法中,错误的是:A。
电池的电解液为碱性溶液,正极为NiO3,负极为Fe。
B。
电池放电时,负极反应为Fe + 2OH- → Fe(OH)2 + 2e。
C。
电池充电过程中,阴极附近溶液的pH降低。
D。
电池充电时,阳极反应为2Ni(OH)2 + 2OH- + 2e → NiO3 + 3H2O。
2.当镀锌铁发生析氢腐蚀时,有0.2mol电子发生转移。
正确的说法是:④在标准状况下有1.12L气体放出。
3.某固体酸燃料电池以CsHSO4固体为电解质传递H,其基本结构如图,电池总反应可表示为:2H2 + O2 → 2H2O。
以下说法正确的是:A。
电子通过外电路从b极流向a极。
B。
b极上的电极反应式为:O2 + 2H2O + 4e → 4OH-。
C。
每转移0.1mol电子,消耗1.12L的H2.D。
H由a极通过固体酸电解质传递到b极。
4.如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。
甲醇在催化剂作用下提供质子(H)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH + 3O2 → 2CO2 + 4H2O。
以下说法中,错误的是:A。
右边的电极为电池的负极,b处通入的是空气。
B。
左边的电极为电池的正极,a处通入的是甲醇。
C。
电池负极的反应式为:2CH3OH + 2H2O - 12e → 2CO2↑ + 12H+。
D。
电池正极的反应式为:3O2 + 12H+ + 12e → 6H2O。
5.铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4 →2PbSO4 + 2H2O。
以下判断不正确的是:A。
K闭合时,d电极反应式:PbSO4 + 2H2O - 2e → PbO2 + 4H+。
B。
当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol。
第10章应用电化学习题及答案

第十章 应用电化学习题及答案10-1 水的标准生成自由能是-237.191kJ mol -1,求在25℃时电解纯水的理论分解电压。
解:H 2O=H 2 +1/2O 2, 电子转移数为2,则有ΔG = - n F E mf = -237.191kJ mol -1(n =2), -237191=-2×96485×E mf , E mf =1.229V10-2 298.15K 时测得电池: Pt(s)| H 2( O p ) | HCl(b ) | Hg 2Cl 2(s) | Hg(l) 的电动势与HCl 溶液的质量摩尔浓度的关系如下 b ×103/(mol kg -1)75.08 37.69 18.87 5.04 E mf / V 0.4119 0.4452 0.4787 0.5437求(1)O E 甘汞 (2)b= 0.07508 mol kg -1时HCl 溶液的±γ。
解:负极反应:H 2-2e -→2H + 正极反应: Hg 2Cl 2 +2e -→2Hg +2Cl -电池反应:H 2+ Hg 2Cl 2 →2H ++2Hg +2Cl -所以 有:E mf = E Θ-RT/2Fln ⎪⎪⎭⎫ ⎝⎛)()()()(22222Cl Hg a H a HCl a Hg a = E Θ-RT/2Fln ())(2HCl a a(HCl)=a (H +) a(Cl -)=(±γb/b Θ)2E mf =O E 甘汞 - (2RT/F ) ln(b/O b )对于稀溶液,ln ±γ=-A ’(I/b Θ)1/2, 1-1价电解质I=b(1) E mf + (2RT/F ) ln(b/O b )=O E 甘汞 + (2RT/F ) A’ (b/O b )0.5 , 以E mf +(2RT/F )ln(b/O b )对(b/O b )0.5作图,直线的截距O E 甘汞=0.2685 V(2) E mf =O E 甘汞 - (2RT/F ) ln(b/O b ) - (2RT/F ) ln ±γ , ±γ=0.81510-3 298.2K 时,在有玻璃电极的电池中,加入pH=4.00的缓冲溶液,测得电动势为0.1122V;则当电动势为0.2305V时,溶液的pH为多少?解:pH x= pH s +F(E x-E s)/(2.303RT)= 6.0010-4 求298.15K时下列电池中待测液pH值(所需电极电势数值自查)。
高中化学专题复习《电化学及其应用》含答案
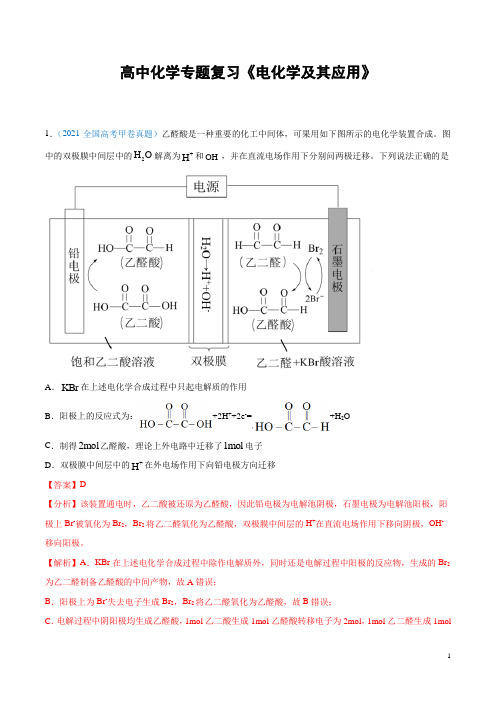
高中化学专题复习《电化学及其应用》1.(2021·全国高考甲卷真题)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。
图中的双极膜中间层中的2H O 解离为+H 和-OH ,并在直流电场作用下分别问两极迁移。
下列说法正确的是A .KBr 在上述电化学合成过程中只起电解质的作用B .阳极上的反应式为:+2H ++2e -=+H 2OC .制得2mol 乙醛酸,理论上外电路中迁移了1mol 电子D .双极膜中间层中的+H 在外电场作用下向铅电极方向迁移 【答案】D【分析】该装置通电时,乙二酸被还原为乙醛酸,因此铅电极为电解池阴极,石墨电极为电解池阳极,阳极上Br -被氧化为Br 2,Br 2将乙二醛氧化为乙醛酸,双极膜中间层的H +在直流电场作用下移向阴极,OH -移向阳极。
【解析】A .KBr 在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br 2为乙二醛制备乙醛酸的中间产物,故A 错误;B .阳极上为Br -失去电子生成Br 2,Br 2将乙二醛氧化为乙醛酸,故B 错误;C .电解过程中阴阳极均生成乙醛酸,1mol 乙二酸生成1mol 乙醛酸转移电子为2mol ,1mol 乙二醛生成1mol乙醛酸转移电子为2mol ,根据转移电子守恒可知每生成1mol 乙醛酸转移电子为1mol ,因此制得2mol 乙醛酸时,理论上外电路中迁移了2mol 电子,故C 错误;D .由上述分析可知,双极膜中间层的H +在外电场作用下移向阴极,即H +移向铅电极,故D 正确; 综上所述,说法正确的是D 项,故答案为D 。
2.(2021·全国高考乙卷真题)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是A .阳极发生将海水中的Cl 氧化生成2Cl 的反应B .管道中可以生成氧化灭杀附着生物的NaClOC .阴极生成的2H 应及时通风稀释安全地排入大气D .阳极表面形成的2Mg(OH)等积垢需要定期清理 【答案】D【分析】海水中除了水,还含有大量的Na +、Cl -、Mg 2+等,根据题干信息可知,装置的原理是利用惰性电极电解海水,阳极区溶液中的Cl -会优先失电子生成Cl 2,阴极区H 2O 优先得电子生成H 2和OH -,结合海水成分及电解产物分析解答。
电化学分析习题答案

电化学分析习题一、选择题1.不属于电化学分析法的是CA.电位分析法 B. 极谱分析法 C. 电子能谱法 D. 库仑滴定2. Ag-AgCl参比电极的电极电位取决于电极内部溶液中的 BA.Ag+活度 B. Cl-活度 C. AgCl活度 D.Ag+和Cl-活度之和3.正确的饱和甘汞电极半电池组成为BA. Hg/Hg2Cl2(1mol/L)/KCl(饱和)B.Hg/Hg2Cl2(固)/KCl(饱和)C.Hg/Hg2Cl2(固)/KCl(1mol/L)D.Hg/HgCl2(固)/KCl(饱和)4.pH玻璃电极的膜电位产生是由于测定时,溶液中的 DA.H+离子穿过了玻璃膜 B.电子穿过了玻璃膜C.Na+与水化玻璃膜上的Na +交换作用 D.H+与水化玻璃膜上的H+交换作用5.玻璃电极使用前,需要CA.在酸性溶液中浸泡1h B.在碱性溶液中浸泡1hC.在水溶液中浸泡24hD.测量的pH不同,浸泡溶液不同6.氟离子选择电极对氟离子具有较高的选择性是由于 BA.只有F-能透过晶体膜 B.F-能与晶体膜进行离子交换C.由于F-体积比较小 D.只有F-能被吸附在晶体膜上7. 在电位法中离子选择性电极的电位应与待测离子的浓度 DA. 成正比B. 的对数成正比C. 符合扩散电流公式的关系D. 符合能斯特方程式8. 当金属插入其金属盐溶液时,金属表面和溶液界面会形成双电层,所以产生了电位差。
此电位差为BA.液接电位B.电极电位C.电动势D.膜电位9. 用pH玻璃电极测定pH为13的试液,pH的测定值与实际值的关系为 BA.测定值大于实际值B.测定值小于实际值C.二者相等D.不确定10.直接电位中,加入TISAB的目的是为了 CA.提高溶液酸度B.恒定指示电极电位C.固定溶液中离子强度和消除共存离子干扰D.与待测离子形成配合物11.测量pH时,需要用标准pH溶液定位,这是为了 DA.避免产生酸差 B.避免产生碱差C.消除温度的影响 D.消除不对称电位和液接电位的影响12.玻璃电极不包括 CA.Ag-AgCl内参比电极B.一定浓度的HCl溶液C.饱和KCl溶液D.玻璃膜13.电位测定水中F-含量时,加入TISAB溶液,其中NaCl的作用是 BA.控制溶液的pH在一定范围内B.使溶液的离子强度保持一定值C.掩蔽Al3+和Fe3+干扰离子D.加快响应时间14.用离子选择性电极测定离子活度时,与测定的相对误差无关的是 CA.待测离子的价态B.电池电动势的本身是否稳定C.温度D.搅拌速度15.pH玻璃电极玻璃膜属于 DA.单晶膜B.多晶膜C.混晶膜 D.非晶体膜16.通常组成离子选择电极的部分为 AA.内参比电极、内参比溶液、功能膜、电极管B.内参比电极、饱和KCl溶液、功能膜、电极管C.内参比电极、pH缓冲溶液、功能膜、电极管D.电极引线、功能膜、电极管17.测量溶液pH通常所适用的两支电极为 AA.玻璃电极和饱和甘汞电极B.玻璃电极和Ag-AgCl电极C.玻璃电极和标准甘汞电极D.饱和甘汞电极和Ag-AgCl电极18.液接电位的产生是由于 BA 两种溶液接触前带有电荷B 两种溶液中离子扩散速度不同所产生的C 电极电位对溶液作用的结果D 溶液表面张力不同所致19. 电位滴定法是以测量电位的变化为基础的,下列因素中对测定影响最大的是 B A.内参比电极电位B.待测离子的活度C.液接电位D.不对称电位20. 用电位法测定溶液的pH值时,电极系统由玻璃电极与饱和甘汞电极组成,其中玻璃电极是作为测量溶液中氢离子活度(浓度)的__C_。
电化学分析测试题及参考答案

电化学分析习题及参考答案一、填空题1、原电池的写法,习惯上把?????极写在左边,?????极写在右边,故下列电池中Zn︳ZnSO4︳CuSO4︳Cu??????极为正极,??????极为负极。
2、当加以外电源时,反映可以向相反的方向进行的原电池叫?????????,反之称为???????,铅蓄电池和干电池中,干电池为?????????。
3、在电位滴定中,几种确定终点方法之间的关系是:在E-V图上的????就是一次微商曲线上的??????也就是二次微商的????????点。
4、极谱定性分析的依据是????????????????,定量分析的依据是??????????????。
5、电解分析通常包括???????????法和????????法两类,均可采用???????和???????电解过程进行电解。
6、在电极反应中,增加还原态的浓度,该电对的电极电位值??????????,表明电对中还原态的?????????增强。
反之增加氧化态的浓度,电对的电极电位值?????????,表明此电对的????????????增强。
7、电导分析的理论依据是????????????。
利用滴定反应进行时,溶液电导的变化来确定滴定终点的方法叫?????????????法,它包括???????????和????????????8、极谱分析的基本原理是????????。
在极谱分析中使用??????电极作参比电极,这是由于它不出现浓度差极化现象,故通常把它叫做????????。
9、电解过程中电极的电极电位与它????????发生偏离的现象称为极化。
根据产生极化的原因不同,主要有???????极化和?????????极化两种。
10、离子选择性电极的电极斜率的理论值为??????????。
25℃时一价正离子的电极斜率是?????????;二价正离子是??????????。
11、某钠电极,其选择性系数K Na+,H+约为30。
如用此电极测定PNa等于3的钠离子溶液,并要求测定误差小于3%,则试液的PH值应大于________。
电化学原理及应用习题答案

R - ne →O
* R
cR (0, t ) = c (1 − ( ) )
1/ 2
t
τ
τ 1/ 2
* cR nfA(πDR )1/ 2 = 2i
DR 1/ 2 t 1/ 2 * 1 t 1/ 2 * co (0, t ) = ( ) ( ) cR = ( ) cR τ ξ τ Do
ξ = ( Do / DR )1/ 2
Z re = RΩ + Rct = 31.25 Ω 2 2 1 + ω 2Cd Rct
2 ωCd Rct = 41.56 Ω Z im = 2 2 1 + ω 2Cd Rct
得,Rct=103 Ω 交换电流: i0=RT/(nFRct)= 8.314x298/(96500x102.51)=2.5x10-4 A 标准速率常数:k0=i0/(nFAc01-acRa)=2.5x10-4/(96500x1 cm2x0.001/1000 mol.cm3)=2.59x10-3 cm/s
独立组分中由式1212cnfad12120onfad2ico02i可得1212nfad2ic0pb2pbo2273259121mmmas12mm1212cd2nfad2ic0cdo21364212069mmmas12mm因?pb2pb?cd2cd所以判定pb2发生还原对于混合溶液708s属于单一pb2pb反应170s属于pb2pb和cd2cd反应共同参与2前者表现极限电流pb2
nF|Φ|
ΔGa
ΔGa,o
Φ<0
ΔGc=ΔGc,0-nF|Φ| + (1-a)nF|Φ|=ΔGc,0-anF|Φ|=ΔGc,0+anFΦ ΔGa=ΔGa,0 + (1-a)nF|Φ|=ΔGa,0-(1-a)nFΦ
应用电化学(杨辉_卢文庆编)课后习题答案

不同研究体系可以选择不同的参比电极,水溶液体系中常见的参比电极有:饱和甘汞电极(SCE)、Ag/AgCl电极、标淮氢电极(SHE或NHE)等。许多有机电化学测量是在非水溶剂中进行的,尽管水溶液参比电极也可以使用,但不可避免地会给体系带入水分,影响研究效果,因此,建议最好使用非水参比体系。常用的非水参比体系为Ag/Ag+(乙腈)。工业上常应用简易参比电极,或用辅助电极兼做参比电极。在测量工作电极的电势时,参比电极内的溶液和被研究体系的溶液组成往往不—样,为降低或消除液接电势,常选用盐桥;为减小末补偿的溶液电阻,常使用鲁金毛细管。
解:表面膜的转移反应。覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)Zn?2OH??2e?Zn(OH)2;Zn(OH)2?2OH??[Zn(OH)4]2?
解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
第一章习题解答:
1试推导下列各电极反应的类型及电极反应的过程。
(1)Ce4??2e?Ce2?
4?解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种Ce
态的物种Ce
(2) 2?借助于电极得到电子,生成还原而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, O2?2H2O?4e?4OH?
3.试描述双电层理论的概要。
解:电极/溶液界面区的最早模型是19世纪末Helmholtz提出的平板电容器模型(也称紧密层模型),他认为金属表面过剩的电荷必须被溶液相中靠近电极表面的带相反电荷的离子层所中和,两个电荷层间的距离约等于离子半
《应用电化学》复习思考题参考答案

《应用电化学》复习思考题参考答案第一章电化学理论基础1.什么是电化学体系?基本单元有那些?(1)由两类不同导体组成,且在电荷转移时不可避免地伴随有物质变化的体系,通常有原电池、电解池、腐蚀电池三大类型。
(2)1.电极2.电解质溶液3.隔膜2.试举例说明隔膜的作用。
隔膜是将电解槽分隔为阳极区和阴极区,以保证阴极、阳极上发生氧化-还原反应的反应物和产物不互相接触和干扰。
例如采用玻璃滤板隔膜、盐桥和离子交换膜,起传导电流作用的离子可以透过隔膜。
3.试描述现代双电层理论的概要.电极\\溶液界面的双电层的溶液一侧被认为是由若干“层”组成的。
最靠近电极的一层为内层,它包含有溶剂分子和所谓的特性吸附的物质(离子或分子),这种内层也称为紧密层、helmholtz层或tern层,如图1.5所示。
实际上,大多数溶剂分子(如水)都是强极性分子,能在电极表面定向吸附形成一层偶极层。
特性吸附离子的电中心位置叫内holmholtz层(IHP),它是在距离为某1处。
溶剂化离子只能接近到距电极为某2的距离处,这些最近的溶剂化离子中心的位置称外helmholtz层(OHP)。
非特性吸附离子由于电场的作用会分布于称为分散层(扩散层)的三维区间内并延伸到本体溶液。
在OHP层与溶液本体之间是分散层。
4.什么是电极的法拉第过程和非法拉第过程。
电极上发生的反应过程有两种类型,法拉第过程和非法拉第过程。
前者是电荷经过电极/溶液界面进行传递而引起的某种物质发生氧化或还原反应时的法拉第过程,其规律符合法拉第定律,所引起的电流称法拉第电流。
后者是在一定条件下,当在一定电势范围内施加电位时,电极/溶液界面并不发生电荷传递反应,仅仅是电极/溶液界面的结构发生变化,这种过程称非法拉第过程。
5.试述电极反应的种类和机理。
电极反应种类:(1)简单电子迁移反应;(2)金属沉积反应;(3)表面膜的转移反应;(4)伴随着化学反应的电子迁移反应;(5)多孔气体扩散电极中的气体还原或氧化反应;(6)气体析出反应;(7)腐蚀反应电极反应的机理:(1)CE机理:指在发生电子迁移反应之前发生了化学反应,其通式为:某O某+neRed如:酸性介质中HCHO的还原反应:OHH2CHCHO+H2OC步骤OHHCHO+2H++2e→CH3OHE步骤(2)EC机理:指在电极/溶液界面发生电子迁移反应后又发生了化学反应,其通式为:O某+Ze→Red某如:对氨基苯酚在Pt电极上的氧化反应(3)催化机理a、“外壳层”催化:EC机理中的一种,指在电极和溶液之间的电子传递反应,通过电极表面物种氧化—还原的媒介作用,使反应在比裸电极低的超电势下发生,其通式可表示如下:某+neRedE步骤Red+某O某+YC步骤如:Fe3+/Fe2+电对催化H2O2的还原反应:1/2H2O2+e→OH-Fe3++e→Fe2+Fe2++1/2H2O2→Fe3++OH-b、“内壳层”催化:也称为化学氧化—还原催化,即当反应物的总电化学反应中包括旧键的断裂和新键的形成时,发生在电子转移步骤的前、后或其中而产生了某种化学加成物或某些其它的电活性中间体,总的活化能会被某些“化学的”氧化—还原催化剂所降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章习题解答:1试推导下列各电极反应的类型及电极反应的过程。
(1)++→+242Ce e Ce解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种4Ce +借助于电极得到电子,生成还原态的物种2Ce +而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化,(2)-→++OH e O H O 44222解:多孔气体扩散电极中的气体还原反应。
气相中的气体2O 溶解于溶液后,再扩散到电极表面,然后借助于气体扩散电极得到电子,气体扩散电极的使用提高了电极过程的电流效率。
(3)Ni e Ni →++22解:金属沉积反应。
溶液中的金属离子2Ni +从电极上得到电子还原为金属Ni ,附着于电极表面,此时电极表面状态与沉积前相比发生了变化。
(4)-+→++OH s MnOOH O H e s MnO )()(22解:表面膜的转移反应。
覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)2)(22OH Zn e OH Zn→-+-;--→+242])([2)(OH Zn OH OH Zn解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。
即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
不同研究体系可以选择不同的参比电极,水溶液体系中常见的参比电极有:饱和甘汞电极(SCE)、Ag/AgCl 电极、标淮氢电极(SHE 或NHE)等。
许多有机电化学测量是在非水溶剂中进行的,尽管水溶液参比电极也可以使用,但不可避免地会给体系带入水分,影响研究效果,因此,建议最好使用非水参比体系。
常用的非水参比体系为Ag/Ag+(乙腈)。
工业上常应用简易参比电极,或用辅助电极兼做参比电极。
在测量工作电极的电势时,参比电极内的溶液和被研究体系的溶液组成往往不—样,为降低或消除液接电势,常选用盐桥;为减小末补偿的溶液电阻,常使用鲁金毛细管。
3.试描述双电层理论的概要。
解:电极/溶液界面区的最早模型是19世纪末Helmholtz 提出的平板电容器模型(也称紧密层模型),他认为金属表面过剩的电荷必须被溶液相中靠近电极表面的带相反电荷的离子层所中和,两个电荷层间的距离约等于离子半径,如同一个平板电容器。
这种由符号相反的两个电荷层构成的界面区的概念,便是“双电层”一词的起源。
继Helmholtz 之后,Gouy 和Chapman 在1913年不谋而合地提出了扩散双电层模型。
他们考虑到界面溶液侧的离子不仅受金属上电荷的静电作用,而且受热运动的影响,因此,电极表面附近溶液层中的离子浓度是沿着远离电极的方向逐渐变化的,直到最后与溶液本体呈均匀分布。
该模型认为在溶液中与电极表面离子电荷相反的离子只有一部分紧密地排列在电极/溶液界面的溶液一侧(称紧密层,层间距离约为一、二个离子的厚度),另一部分离子与电极表面的距离则可以从紧密层一直分散到本体溶液中(称扩散层),在扩散层中离子的分布可用玻尔兹曼分布公式表示。
Gouy-Chapman 模型的缺点是忽略了离子的尺寸,把离子视为点电荷,只能说明极稀电解质溶液的实验结果。
由于亥姆霍茨模型和古依—查普曼模型都有不足之处,1924年,Stern 吸取了Helmholtz 模型和Gouy-Chapman 模型的合理因素,提出整个双电层是出紧密层和扩散层组成的,从而使理论更加切合实际。
Stern 还指出离子特性吸附的可能性,可是没有考虑它对双电层结构的影响。
目前普遍公认的是在GCS 模型基础上发展起来的BDM (Bockris-Davanathan-muller )模型最具有代表性,其要点如下。
电极/溶液界面的双电层的溶液一侧被认为是由若干”层”组成的。
最靠近电极的一层为内层,它包含有溶剂分子和所谓的特性吸附的物质(离子成分子),这种内层也称为紧密层、Helmholtz 层或Stern 层。
4.根据电极反应ne Ox +Red ,已知:*R c =*Ox c =1mmol ·L —l ,θk =10-7cm ·s -1,α=03,1=n ;(1)计算交换电流密度A I j /00=(以2-⋅cm A μ表示);(2)试画出阳极电流和阴极电流在6002-⋅cm A μ范围内的Tafel曲线(η-I lg)。
T=298K ,忽略物质传递的影响。
解:(1)*(1)*000/OX R j I A zFk c C αα-===1×96500 C·mol -1×10-7cm ·s -1×(1 mmol ·L —l )0.7×(1 mmol ·L —l)0.3=1×96500 C×10-7cm -2·s -1×1×10-6=9.65×10-9c ·cm -2·s -1=9.65×10-9A ·cm -2=9.65×10-3μA ·cm -2(1C=1A ·s ) 也可以等于9.6484×10-3μA ·cm -2。
(2)对于阴极:000RT RTln ln 0.059120.05912 lg lg 0.1971(lg /)0.30.3i i zF zFi i i i ηαα-=-=⨯=(1)对于阳极极:00RT RTln ln 0.08446lg(/)i i i i zF zFηββ-==(2) 电流/μ A ·cm -2100 200 300 400 500 600 lgi2.000 2.301 2.477 2.602 2.699 2.778 阴极超电势/V -0.7914 -0.8508 -0.8855 -0.9101 -0.9292 -0.9448 阳极超电势/V-0.33910.36460.37940.39000.39820.4049η解:高超电势时,方程(1.43)右式两项中的一项可以忽略。
当电极上发生阴极还原反应,且η很大时(此时,电极电势非常负,阳极氧化反应是可以忽略的),对于一定条件下在指定电极上发生的特定反应,0ln )/(i zF RT α和zF RT α/-为一确定的值,即方程(1.47)可以简化为:i b a lg +=η。
因此,在强极化的条件下,由Butler-Volmer 方程可以推导出Tafel 经验方程。
Tafel 经验方程中的a,b 可以确定为: 6.根据文献提供的数据,Pt|)20()(136-+⋅L mmol CN Fe ,)20()(146-+⋅L mmol CN Fe ,)0.1(1-⋅L mmol NaCl 在25℃时的A I j /00==20.2-⋅cm mA ,这个体系的电子传递系数为0.50,计算:(1)θk 的值;(2)溶液中两种络合物浓度都为11-⋅L mol 时,的交换电流密度0j ;(3)电极面积为0.12cm ,溶液中两种络合物浓度为410-1-⋅L mol 时的电荷传递电阻。
解:(1)θk 的值:(2)**11OX R c c mol L -==⋅(3)7.根据文献J Am .Chem. Soc. ,77,6488(1955)报道,研究电极反应:)(22Hg Cd e Hg Cd→+++,当40.0)(=Hg Cd c 1-⋅L mol 时,得到如下实验数据:试计算α和θk 的值。
解:2*(1)**(1)*0()OX R Cd Hg Cd j zFk c c zFk c c θαβθαβ+--==由标中数据可得:1113010.4117.30.50.40.5ααβαβ---⨯⎛⎫== ⎪⨯⎝⎭(1)11117.30.50.40.510.10.250.40.25ααβαβ---⨯⎛⎫== ⎪⨯⎝⎭(2)11110.10.250.40.254.940.100.40.10ααβαβ---⨯⎛⎫== ⎪⨯⎝⎭(3)对方程(1)取对数:30ln(1)ln 217.3α=- 得:1-α=0.7942,α=0.2058对方程(2)取对数:17.3ln(1)ln 210.1α=- 得:1-α=0.7764,α=0.2236 对方程(3)取对数:10.10ln (1)ln 2.54.94α=- 得:1-α=0.7805,α=0.2195所以:α=(0.2058+0.2236+0.2195)/3=0.2163 ……………………………8. 对于一个旋转圆盘电极,应用稳态物质传递控制电极反应的处理,物质传递系数0m =0.626/2/13/20-νωD ,式中,0D 为扩散系数(1-⋅s cm ),ω为圆盘的角速度(1-s)(fπω2=,f 为旋转频率1-⋅sr ),ν是动力强度,水溶液中ν为0.010(cm 21-⋅s )。
使用0.30 cm 2的圆盘电极,在11-⋅Lmol 42SO H 中使0.0101-⋅L mol +3Fe 还原为+2Fe。
已知+3Fe的0D 为5.2×10-6 cm 21-⋅s,计算因盘电极转速为101-⋅sr 时的还原极限电流。
解:0m =0.626/2/13/20-νωD=0.0252cm·s -19.现用70A ·m -2的电流密度电解析出铜,假定溶液中Cu 2+的活度为1,实验测得其Tafel 曲线斜率为(0.06V)-1,交换电流密度j 0为1A ·m -2,试问电解析出铜时阴极电位应为多少? 解:010.06lg 0.06lg 0.06(lg)0.110770eq i i V ηϕϕ=-=-==- 补充题目:1. 试说明工作电极应具有的性能和用途。
解:答:工作电极(working electrode ,简称WE):又称研究电极,是指所研究的反应在该电极上发生。
一般来讲,工作电极应具有的性能:所研究的电化学反应不会因电极自身所发生的反比而受到影响,并且能够在较大的电位区域中进行测定;电极必须不与溶剂或电解液组分发生反应;电极面积不宜太大,电极表面最好应是均一、平滑的,且能够通过简单的方法进行表面净化等等。
