应用电化学习题及答案
完整版)电化学练习题带答案

完整版)电化学练习题带答案1.铁镍蓄电池是一种常见的电池,其放电反应为Fe +NiO3 + 3H2O → Fe(OH)2 + 2Ni(OH)2.下列说法中,错误的是:A。
电池的电解液为碱性溶液,正极为NiO3,负极为Fe。
B。
电池放电时,负极反应为Fe + 2OH- → Fe(OH)2 + 2e。
C。
电池充电过程中,阴极附近溶液的pH降低。
D。
电池充电时,阳极反应为2Ni(OH)2 + 2OH- + 2e → NiO3 + 3H2O。
2.当镀锌铁发生析氢腐蚀时,有0.2mol电子发生转移。
正确的说法是:④在标准状况下有1.12L气体放出。
3.某固体酸燃料电池以CsHSO4固体为电解质传递H,其基本结构如图,电池总反应可表示为:2H2 + O2 → 2H2O。
以下说法正确的是:A。
电子通过外电路从b极流向a极。
B。
b极上的电极反应式为:O2 + 2H2O + 4e → 4OH-。
C。
每转移0.1mol电子,消耗1.12L的H2.D。
H由a极通过固体酸电解质传递到b极。
4.如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。
甲醇在催化剂作用下提供质子(H)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH + 3O2 → 2CO2 + 4H2O。
以下说法中,错误的是:A。
右边的电极为电池的负极,b处通入的是空气。
B。
左边的电极为电池的正极,a处通入的是甲醇。
C。
电池负极的反应式为:2CH3OH + 2H2O - 12e → 2CO2↑ + 12H+。
D。
电池正极的反应式为:3O2 + 12H+ + 12e → 6H2O。
5.铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4 →2PbSO4 + 2H2O。
以下判断不正确的是:A。
K闭合时,d电极反应式:PbSO4 + 2H2O - 2e → PbO2 + 4H+。
B。
当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol。
高二化学电化学原理及其应用练习题(含答案)

高二化学电化学原理及其应用练习题(含答案)专题2 第4讲电化学原理及其应用一、选择题1.(2011•河北刑台一模)工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。
有人设想利用原电池原理直接制盐酸,下列说法正确的是()A.假设这种想法可行,则可能在制取盐酸的同时,获取电能B.负极材料用锌,正极材料用石墨,用氢氧化钠作电解质溶液C.通入氢气的电极为原电池的正极D.电解质溶液中的阴离子向通氯气的电极移动答案:A点拨:该原电池应用惰性电极,氢气通入负极区,氯气通入正极区,稀盐酸作电解质溶液,B、C项错误;在原电池中,阳离子向正极区移动,阴离子向负极区移动,D项错误。
2.(2011•石家庄一模)镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成为人们研制绿色电池所关注的焦点。
某种镁二次电池的反应为xMg+放电充电MgxMo3S4,下列叙述不正确的是()A.放电时正极的电极反应为:Mo3S4+2xe-===Mo3S42x-B.充电时阴极的电极反应为:xMg2++2xe-===xMgC.放电时Mg2+向正极移动D.放电时Mo3S4发生氧化反应答案:D点拨:放电时,Mg在负极发生氧化反应:xMg-2xe-===xMg2+,Mo3S4在正极发生还原反应:Mo3S4+2xe-===Mo3S2x-4,放电过程中,阳离子向正极移动,阴离子向负极移动。
充电时,阴极的电极反应式为:xMg2++2xe-===xMg,阳极的电极反应式为:Mo3S42x-===Mo3S4+2xe-。
故选项D错误。
3.(2011•湖北黄冈质量检测)用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+放电充电2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是()A.电路中通过1 mol电子时,Y电极质量增加48 gB.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)C.c、d电极产生气体的物质的量之比为1∶2D.X极为负极答案:A点拨:a极质量增加,即析出了Ag,a为阴极,则Y为负极,X为正极,D项错;B项,所写电极反应式为正极的电极反应式;C项,c为阴极放出H2,d为阳极放出O2,物质的量之比为2∶1。
高中化学专题复习《电化学及其应用》含答案
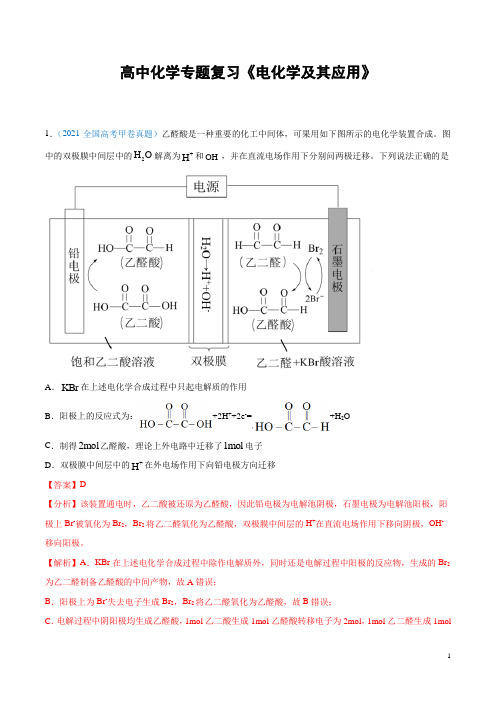
高中化学专题复习《电化学及其应用》1.(2021·全国高考甲卷真题)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。
图中的双极膜中间层中的2H O 解离为+H 和-OH ,并在直流电场作用下分别问两极迁移。
下列说法正确的是A .KBr 在上述电化学合成过程中只起电解质的作用B .阳极上的反应式为:+2H ++2e -=+H 2OC .制得2mol 乙醛酸,理论上外电路中迁移了1mol 电子D .双极膜中间层中的+H 在外电场作用下向铅电极方向迁移 【答案】D【分析】该装置通电时,乙二酸被还原为乙醛酸,因此铅电极为电解池阴极,石墨电极为电解池阳极,阳极上Br -被氧化为Br 2,Br 2将乙二醛氧化为乙醛酸,双极膜中间层的H +在直流电场作用下移向阴极,OH -移向阳极。
【解析】A .KBr 在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br 2为乙二醛制备乙醛酸的中间产物,故A 错误;B .阳极上为Br -失去电子生成Br 2,Br 2将乙二醛氧化为乙醛酸,故B 错误;C .电解过程中阴阳极均生成乙醛酸,1mol 乙二酸生成1mol 乙醛酸转移电子为2mol ,1mol 乙二醛生成1mol乙醛酸转移电子为2mol ,根据转移电子守恒可知每生成1mol 乙醛酸转移电子为1mol ,因此制得2mol 乙醛酸时,理论上外电路中迁移了2mol 电子,故C 错误;D .由上述分析可知,双极膜中间层的H +在外电场作用下移向阴极,即H +移向铅电极,故D 正确; 综上所述,说法正确的是D 项,故答案为D 。
2.(2021·全国高考乙卷真题)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是A .阳极发生将海水中的Cl 氧化生成2Cl 的反应B .管道中可以生成氧化灭杀附着生物的NaClOC .阴极生成的2H 应及时通风稀释安全地排入大气D .阳极表面形成的2Mg(OH)等积垢需要定期清理 【答案】D【分析】海水中除了水,还含有大量的Na +、Cl -、Mg 2+等,根据题干信息可知,装置的原理是利用惰性电极电解海水,阳极区溶液中的Cl -会优先失电子生成Cl 2,阴极区H 2O 优先得电子生成H 2和OH -,结合海水成分及电解产物分析解答。
应用电化学习题及答案

应用电化学,杨辉卢文庆 全书思考题和习题 第一章习题解答:1试推导下列各电极反应的类型及电极反应的过程。
(1)++→+242Ce e Ce解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种4Ce +借助于电极得到电子,生成还原态的物种2Ce+而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, (2)-→++OH e O H O 44222解:多孔气体扩散电极中的气体还原反应。
气相中的气体2O 溶解于溶液后,再扩散到电极表面,然后借助于气体扩散电极得到电子,气体扩散电极的使用提高了电极过程的电流效率。
(3)Ni e Ni →++22解:金属沉积反应。
溶液中的金属离子2Ni +从电极上得到电子还原为金属Ni ,附着于电极表面,此时电极表面状态与沉积前相比发生了变化。
(4)-+→++OH s MnOOH O H e s MnO )()(22解:表面膜的转移反应。
覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)2)(22OH Zn e OH Zn→-+-;--→+242])([2)(OH Zn OH OH Zn解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。
即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
应用电化学答案

一,简比较电子导体和离子导体的异同点(1)电子导体(第一类导体):荷电粒子是电子或电子空穴,它既包括普通的金属导体也包括半导体。
离子导体(第二类导体):荷电粒子是离子,例如,电解质溶液或熔融盐。
(2)电子导体的特点:A.自由电子或电子空穴作定向移动而导电 B.导电过程中导体本身不发生变化 C.温度升高,电阻也升高 D.导电总量全部由电子承担(3)离子导体的特点:A.正、负离子作反向移动而导电 B.导电过程中有化学反应发生 C.温度升高,电阻下 D.导电总量分别由正、负离子分担二,简述电极极化的原因(1)在有限的电流通过时,电极系统的电极电势偏离其平衡电极电势的现象,称为电极的极化现象。
(2)A,浓差极化在有限电流通过电极时,因离子传质过程的迟缓性而导致电极表面附近离子浓度与本体溶液中不同,从而使电极电位偏离其平衡电极电位的现象,叫作浓差极化。
B,活化极化(电化学极化)在有限电流通过电极时,由于电化学反应进行的返缓造成电极上带电程度与可逆状态下不同,从而导致的电极电位偏离其平衡电极电位的现象,叫做‘活化极化”.三,试说明参比电极因具有的性能和用途答:参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
参比电极是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
实际上,参比电极起着既提供热力学参比,又将工作电极作为研究体系隔离的双重作用。
四,试描述双电层理论的概述(1)Helmholtz“平板电容器”模型(1853年)按照这种模型,认为“电极/溶液”界面两侧的剩余电荷都紧密地排列在界面的两侧,形成类似于荷电平板电容器的界面双电层结构。
按照这种模型,界面微分电容值只依赖于界面层厚度(d),而与q和Φ值均无关系。
电化学原理及应用习题答案

R - ne →O
* R
cR (0, t ) = c (1 − ( ) )
1/ 2
t
τ
τ 1/ 2
* cR nfA(πDR )1/ 2 = 2i
DR 1/ 2 t 1/ 2 * 1 t 1/ 2 * co (0, t ) = ( ) ( ) cR = ( ) cR τ ξ τ Do
ξ = ( Do / DR )1/ 2
Z re = RΩ + Rct = 31.25 Ω 2 2 1 + ω 2Cd Rct
2 ωCd Rct = 41.56 Ω Z im = 2 2 1 + ω 2Cd Rct
得,Rct=103 Ω 交换电流: i0=RT/(nFRct)= 8.314x298/(96500x102.51)=2.5x10-4 A 标准速率常数:k0=i0/(nFAc01-acRa)=2.5x10-4/(96500x1 cm2x0.001/1000 mol.cm3)=2.59x10-3 cm/s
独立组分中由式1212cnfad12120onfad2ico02i可得1212nfad2ic0pb2pbo2273259121mmmas12mm1212cd2nfad2ic0cdo21364212069mmmas12mm因?pb2pb?cd2cd所以判定pb2发生还原对于混合溶液708s属于单一pb2pb反应170s属于pb2pb和cd2cd反应共同参与2前者表现极限电流pb2
nF|Φ|
ΔGa
ΔGa,o
Φ<0
ΔGc=ΔGc,0-nF|Φ| + (1-a)nF|Φ|=ΔGc,0-anF|Φ|=ΔGc,0+anFΦ ΔGa=ΔGa,0 + (1-a)nF|Φ|=ΔGa,0-(1-a)nFΦ
应用电化学(杨辉_卢文庆编)课后习题答案
不同研究体系可以选择不同的参比电极,水溶液体系中常见的参比电极有:饱和甘汞电极(SCE)、Ag/AgCl电极、标淮氢电极(SHE或NHE)等。许多有机电化学测量是在非水溶剂中进行的,尽管水溶液参比电极也可以使用,但不可避免地会给体系带入水分,影响研究效果,因此,建议最好使用非水参比体系。常用的非水参比体系为Ag/Ag+(乙腈)。工业上常应用简易参比电极,或用辅助电极兼做参比电极。在测量工作电极的电势时,参比电极内的溶液和被研究体系的溶液组成往往不—样,为降低或消除液接电势,常选用盐桥;为减小末补偿的溶液电阻,常使用鲁金毛细管。
解:表面膜的转移反应。覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)Zn?2OH??2e?Zn(OH)2;Zn(OH)2?2OH??[Zn(OH)4]2?
解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
第一章习题解答:
1试推导下列各电极反应的类型及电极反应的过程。
(1)Ce4??2e?Ce2?
4?解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种Ce
态的物种Ce
(2) 2?借助于电极得到电子,生成还原而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, O2?2H2O?4e?4OH?
3.试描述双电层理论的概要。
解:电极/溶液界面区的最早模型是19世纪末Helmholtz提出的平板电容器模型(也称紧密层模型),他认为金属表面过剩的电荷必须被溶液相中靠近电极表面的带相反电荷的离子层所中和,两个电荷层间的距离约等于离子半
《应用电化学》复习思考题参考答案
《应用电化学》复习思考题参考答案第一章电化学理论基础1.什么是电化学体系?基本单元有那些?(1)由两类不同导体组成,且在电荷转移时不可避免地伴随有物质变化的体系,通常有原电池、电解池、腐蚀电池三大类型。
(2)1.电极2.电解质溶液3.隔膜2.试举例说明隔膜的作用。
隔膜是将电解槽分隔为阳极区和阴极区,以保证阴极、阳极上发生氧化-还原反应的反应物和产物不互相接触和干扰。
例如采用玻璃滤板隔膜、盐桥和离子交换膜,起传导电流作用的离子可以透过隔膜。
3.试描述现代双电层理论的概要.电极\\溶液界面的双电层的溶液一侧被认为是由若干“层”组成的。
最靠近电极的一层为内层,它包含有溶剂分子和所谓的特性吸附的物质(离子或分子),这种内层也称为紧密层、helmholtz层或tern层,如图1.5所示。
实际上,大多数溶剂分子(如水)都是强极性分子,能在电极表面定向吸附形成一层偶极层。
特性吸附离子的电中心位置叫内holmholtz层(IHP),它是在距离为某1处。
溶剂化离子只能接近到距电极为某2的距离处,这些最近的溶剂化离子中心的位置称外helmholtz层(OHP)。
非特性吸附离子由于电场的作用会分布于称为分散层(扩散层)的三维区间内并延伸到本体溶液。
在OHP层与溶液本体之间是分散层。
4.什么是电极的法拉第过程和非法拉第过程。
电极上发生的反应过程有两种类型,法拉第过程和非法拉第过程。
前者是电荷经过电极/溶液界面进行传递而引起的某种物质发生氧化或还原反应时的法拉第过程,其规律符合法拉第定律,所引起的电流称法拉第电流。
后者是在一定条件下,当在一定电势范围内施加电位时,电极/溶液界面并不发生电荷传递反应,仅仅是电极/溶液界面的结构发生变化,这种过程称非法拉第过程。
5.试述电极反应的种类和机理。
电极反应种类:(1)简单电子迁移反应;(2)金属沉积反应;(3)表面膜的转移反应;(4)伴随着化学反应的电子迁移反应;(5)多孔气体扩散电极中的气体还原或氧化反应;(6)气体析出反应;(7)腐蚀反应电极反应的机理:(1)CE机理:指在发生电子迁移反应之前发生了化学反应,其通式为:某O某+neRed如:酸性介质中HCHO的还原反应:OHH2CHCHO+H2OC步骤OHHCHO+2H++2e→CH3OHE步骤(2)EC机理:指在电极/溶液界面发生电子迁移反应后又发生了化学反应,其通式为:O某+Ze→Red某如:对氨基苯酚在Pt电极上的氧化反应(3)催化机理a、“外壳层”催化:EC机理中的一种,指在电极和溶液之间的电子传递反应,通过电极表面物种氧化—还原的媒介作用,使反应在比裸电极低的超电势下发生,其通式可表示如下:某+neRedE步骤Red+某O某+YC步骤如:Fe3+/Fe2+电对催化H2O2的还原反应:1/2H2O2+e→OH-Fe3++e→Fe2+Fe2++1/2H2O2→Fe3++OH-b、“内壳层”催化:也称为化学氧化—还原催化,即当反应物的总电化学反应中包括旧键的断裂和新键的形成时,发生在电子转移步骤的前、后或其中而产生了某种化学加成物或某些其它的电活性中间体,总的活化能会被某些“化学的”氧化—还原催化剂所降低。
大学应用电化学习题
二、选择题。
1.以下哪一项不是影响电镀层质量的因素(B)A、阳极B、阴极C、电镀工艺条件D、镀液的性质2.以下哪一项不是评价电催化性能的方法(A)A、热重分析法 B.旋转圆盘电极伏安法 C.计时电位法 D 循环伏安法3.3.以下哪一项不是优良的电子传递媒介体应具有的性质(D)A、能稳定吸附或滞留在电极表面B、与被催化的五之间发生快速的电子传递具自负单出有和劳址.C、呈现可逆电极反应的动力学特征D、对氧气具有反应活性4.以下哪一项不是电解合成的优点(A)A、电能消耗少B.易控制反应的方向 C.环境污染少D、合成许多化学合成不能生产的物质5.依据工作原理分类,以下哪一项不是化学传感器( B )A、光学式B.磁学式C.电化学式D、质量式6.选择合适的电催化剂是实现复杂电极反应的关键,以下哪一项不是电催化剂必须具备的性能(C)A、高的催化活性B.一定的电子导电性c.良好的热稳定性D.电化学稳定性7.以下哪一项不属于化学电源的性能指标(A)A.稳态电极曲线B.电池的容量 c.电池的寿命 D.比能量8.有关Clark型氧气电极基本原理的描述。
以下哪一项不正确(C)A检测氧的封闭式氧电极B氧气进入膜后在电模表面迅速还原C外电路检测氧还原电流反比气相中氧的分压D.从电流的值可以测定氧气的浓度外电路检测的氧气还原电流反比气相中中氧气的分压9.以下哪一项不是氨碱工业中常用的电解槽(D)A、汞槽B、离子膜槽C、隔膜槽 D.熔融盐电10.以下哪项不是电催化剂载体的作用(C) A、作为一种惰性支撑物的有B、载体与活性组分之间存在某种作用c.不改变电催化剂的活性选择性山断D.、修饰了催化剂的电子状态9.以下哪一项不是氯碱工业中常用的电解槽D)A、汞槽B、离子膜槽C、隔膜槽D.熔融盐电解槽10.以下哪一项不是电10催化剂载体的作用(C)A、作为一种情性支撑物B、载体与活性组分之间存在某种作用C、不改变电催化剂的活性选择性D、修饰了催化剂的电子状态三、判断题。
应用电化学习题及答案
应用电化学,辉卢文庆 全书思考题和习题 第一章习题解答:1试推导下列各电极反应的类型及电极反应的过程。
(1)++→+242Ce e Ce解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种4Ce +借助于电极得到电子,生成还原态的物种2Ce+而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, (2) -→++OH e O H O 44222解:多孔气体扩散电极中的气体还原反应。
气相中的气体2O 溶解于溶液后,再扩散到电极表面,然后借助于气体扩散电极得到电子,气体扩散电极的使用提高了电极过程的电流效率。
(3) Ni e Ni→++22解:金属沉积反应。
溶液中的金属离子2Ni +从电极上得到电子还原为金属Ni ,附着于电极表面,此时电极表面状态与沉积前相比发生了变化。
(4) -+→++OH s MnOOH O H e s MnO )()(22解:表面膜的转移反应。
覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)2)(22OH Zn e OH Zn→-+-;--→+242])([2)(OH Zn OH OH Zn解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。
即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
应用电化学,辉卢文庆 全书思考题和习题 第一章习题解答:1试推导下列各电极反应的类型及电极反应的过程。
(1)++→+242Ce e Ce解:属于简单离子电迁移反应,指电极/溶液界面的溶液一侧的氧化态物种4Ce +借助于电极得到电子,生成还原态的物种2Ce+而溶解于溶液中,而电极在经历氧化-还原后其物理化学性质和表面状态等并未发生变化, (2)-→++OH e O H O 44222解:多孔气体扩散电极中的气体还原反应。
气相中的气体2O 溶解于溶液后,再扩散到电极表面,然后借助于气体扩散电极得到电子,气体扩散电极的使用提高了电极过程的电流效率。
(3)Ni e Ni →++22解:金属沉积反应。
溶液中的金属离子2Ni +从电极上得到电子还原为金属Ni ,附着于电极表面,此时电极表面状态与沉积前相比发生了变化。
(4)-+→++OH s MnOOH O H e s MnO )()(22解:表面膜的转移反应。
覆盖于电极表面的物种(电极一侧)经过氧化-还原形成另一种附着于电极表面的物种,它们可能是氧化物、氢氧化物、硫酸盐等。
(5)2)(22OH Zn e OH Zn→-+-;--→+242])([2)(OH Zn OH OH Zn解:腐蚀反应:亦即金属的溶解反应,电极的重量不断减轻。
即金属锌在碱性介质中发生溶解形成二羟基合二价锌络合物,所形成的二羟基合二价锌络合物又和羟基进一步形成四羟基合二价锌络合物。
2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
不同研究体系可以选择不同的参比电极,水溶液体系中常见的参比电极有:饱和甘汞电极(SCE)、Ag/AgCl 电极、标淮氢电极(SHE 或NHE)等。
许多有机电化学测量是在非水溶剂中进行的,尽管水溶液参比电极也可以使用,但不可避免地会给体系带入水分,影响研究效果,因此,建议最好使用非水参比体系。
常用的非水参比体系为Ag/Ag+(乙腈)。
工业上常应用简易参比电极,或用辅助电极兼做参比电极。
在测量工作电极的电势时,参比电极的溶液和被研究体系的溶液组成往往不—样,为降低或消除液接电势,常选用盐桥;为减小末补偿的溶液电阻,常使用鲁金毛细管。
3.试描述双电层理论的概要。
解:电极/溶液界面区的最早模型是19世纪末Helmholtz 提出的平板电容器模型(也称紧密层模型),他认为金属表面过剩的电荷必须被溶液相中靠近电极表面的带相反电荷的离子层所中和,两个电荷层间的距离约等于离子半径,如同一个平板电容器。
这种由符号相反的两个电荷层构成的界面区的概念,便是“双电层”一词的起源。
继Helmholtz 之后,Gouy 和Chapman 在1913年不谋而合地提出了扩散双电层模型。
他们考虑到界面溶液侧的离子不仅受金属上电荷的静电作用,而且受热运动的影响,因此,电极表面附近溶液层中的离子浓度是沿着远离电极的方向逐渐变化的,直到最后与溶液本体呈均匀分布。
该模型认为在溶液中与电极表面离子电荷相反的离子只有一部分紧密地排列在电极/溶液界面的溶液一侧(称紧密层,层间距离约为一、二个离子的厚度),另一部分离子与电极表面的距离则可以从紧密层一直分散到本体溶液中(称扩散层),在扩散层中离子的分布可用玻尔兹曼分布公式表示。
Gouy-Chapman 模型的缺点是忽略了离子的尺寸,把离子视为点电荷,只能说明极稀电解质溶液的实验结果。
由于亥姆霍茨模型和古依—查普曼模型都有不足之处,1924年,Stern 吸取了Helmholtz 模型和Gouy-Chapman 模型的合理因素,提出整个双电层是出紧密层和扩散层组成的,从而使理论更加切合实际。
Stern 还指出离子特性吸附的可能性,可是没有考虑它对双电层结构的影响。
目前普遍公认的是在GCS 模型基础上发展起来的BDM (Bockris-Davanathan-muller )模型最具有代表性,其要点如下。
电极/溶液界面的双电层的溶液一侧被认为是由若干”层”组成的。
最靠近电极的一层为层,它包含有溶剂分子和所谓的特性吸附的物质(离子成分子),这种层也称为紧密层、Helmholtz 层或Stern 层。
4.根据电极反应ne Ox +Red ,已知:*R c =*Ox c =1mmol ·L —l ,θk =10-7cm ·s -1,α=03,1=n;(1)计算交换电流密度A I j /00=(以2-⋅cm A μ表示);(2)试画出阳极电流和阴极电流在6002-⋅cmA μ围的Tafel 曲线(η-I lg )。
T=298K ,忽略物质传递的影响。
解:(1)*(1)*000/OX R j I A zFk c C αα-===1×96500 C·mol -1×10-7 cm ·s -1×(1 mmol ·L —l )0.7×(1 mmol ·L —l )0.3 =1×96500 C×10-7 cm -2·s -1×1×10-6=9.65×10-9 c ·cm -2·s -1 =9.65×10-9 A ·cm -2=9.65×10-3μ A ·cm -2 (1C=1A ·s ) 也可以等于9.6484×10-3μ A ·cm -2 。
(2)对于阴极:000RT RTln ln 0.059120.05912 lg lg 0.1971(lg /)0.30.3i i zF zFi i i i ηαα-=-=⨯=(1)对于阳极极:00RT RTln ln 0.08446lg(/)i i i i zF zFηββ-==(2)电流/μ A ·cm -2 100 200 300 400 500 600 lgi2.0002.301 2.477 2.602 2.699 2.778 阴极超电势/V-0.7914-0.8508-0.8855-0.9101-0.9292-0.9448阳极超电势/V -0.3391 0.3646 0.3794 0.3900 0.3982 0.40495.试推导高正超电势时η~I关系式,并同Tafel方程比较。
解:高超电势时,方程(1.43)右式两项中的一项可以忽略。
当电极上发生阴极还原反应,且η很大时(此时,电极电势非常负,阳极氧化反应是可以忽略的),对于一定条件下在指定电极上发生的特定反应,ln)/(izFRTα和zFRTα/-为一确定的值,即方程(1.47)可以简化为:iba lg+=η。
因此,在强极化的条件下,由Butler-Volmer方程可以推导出Tafel经验方程。
Tafel经验方程中的a,b 可以确定为:6.根据文献提供的数据,Pt| )20()(136-+⋅LmmolCNFe,)20()(146-+⋅LmmolCNFe,)0.1(1-⋅LmmolNaCl在25℃时的AIj/==20.2-⋅cmmA,这个体系的电子传递系数为0.50,计算:(1) θk的值;(2)溶液中两种络合物浓度都为11-⋅Lmol时,的交换电流密度j;(3)电极面积为0.12cm,溶液中两种络合物浓度为410-1-⋅Lmol时的电荷传递电阻。
解:(1) θk的值:*(1)*2110.510.52331112.0196500(20)(20)2.0=10 1.03610cm19650020ROXiAzFc cmA cmkC mol mmol L mmol LmA cmsC mol mmol Lαβθ----------⋅==⨯⋅⨯⋅⋅⋅⨯=⨯⋅⨯⋅⨯⋅(2)**11OX Rc c mol L-==⋅0*(1)*030.50.521.036101965001199.974i OX RA j k zFc c mA cmθαβ---===⨯⨯⨯⨯⨯=⋅(3)*(1)*01231410.5410.57272 1965000.1 1.03610(10)(10) 9.9974109.997410OX Ri zFAk c c C mol cm cm s mol L mol L C cm A s cm θαβ------------==⨯⋅⨯⨯⨯⋅⨯⋅⨯⋅=⨯⋅=⨯⋅⋅708.314298.1525693.921965009.997410ct RT R zFi -⨯===Ω⨯⨯⨯ 7.根据文献J Am .Chem. Soc. ,77,6488(1955)报道,研究电极反应:)(22Hg Cd e Hg Cd →+++,当40.0)(=Hg Cd c 1-⋅L mol 时,得到如下实验数据:试计算α和θk 的值。
解:2*(1)**(1)*0()OX R Cd Hg Cd j zFk c c zFk c c θαβθαβ+--==由标中数据可得:1113010.4117.30.50.40.5ααβαβ---⨯⎛⎫== ⎪⨯⎝⎭(1)11117.30.50.40.510.10.250.40.25ααβαβ---⨯⎛⎫== ⎪⨯⎝⎭(2)11110.10.250.40.254.940.100.40.10ααβαβ---⨯⎛⎫== ⎪⨯⎝⎭(3)对方程(1)取对数:30ln(1)ln 217.3α=- 得:1-α=0.7942,α=0.2058对方程(2)取对数:17.3ln (1)ln 210.1α=- 得:1-α=0.7764,α=0.2236 对方程(3)取对数:10.10ln(1)ln 2.54.94α=- 得:1-α=0.7805,α=0.2195 所以:α=(0.2058+0.2236+0.2195)/3=0.2163232*(1)*13110.216310.7837()321630.7837330.783733010296500(1.010)(0.4)3010 296500(1.010)(0.410)3010 =Cd Hg Cd j A cm k zFc c C mol mol L mol L A cm A s mol mol cm mol cm A c θαβ+----------------⨯⋅==⨯⋅⨯⨯⋅⨯⋅⨯⋅=⨯⋅⋅⨯⨯⋅⨯⨯⋅⨯⋅1-416=0.15544=1..554410 2965009.68110m cm s m s A s ---⋅⨯⋅⨯⋅⋅⨯……………………………8. 对于一个旋转圆盘电极,应用稳态物质传递控制电极反应的处理,物质传递系数0m =0.626/2/13/20-νωD ,式中,0D 为扩散系数(1-⋅s cm ),ω为圆盘的角速度(1-s)(fπω2=,f 为旋转频率1-⋅s r),ν是动力强度,水溶液中ν为0.010(cm 21-⋅s)。
