铁的化学性质及其化合物(精)
铁及其化合物

Fe2+
Fe2+和Fe3+的检验
试剂 Fe2+ Fe3+
生成白色沉淀,迅速变为灰 NaOH溶液 绿色,最后变成红褐色。 生成红褐色沉淀
KSCN溶液 KMnO4溶液
无明显现象 KMnO4溶液褪色
无明显现象 蓝色沉淀
生成红色溶液 Fe3++3SCN-=Fe(SCN)3 无明显现象 溶液变蓝 无明显现象
氧化性酸:
Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O
冷、浓H2SO4、浓HNO3: 常温
钝化
2Fe+6H2SO4(浓) = Fe2(SO4)3+3SO2↑+6H2O
④与盐溶液反应:
Fe+Cu2+ == Fe2+ + Cu Fe+2Fe3+ == 3Fe2+ Fe+2Ag+ == Fe2+ + 2Ag
FeO与酸反应后生成的Fe2+ 具有较强的还原
性,但能否体现出Fe2+ 的还原性,则要看与其 反应的酸是否有强氧化性。如果有,则Fe2+会被 氧化成 Fe3+ 。 Fe2O3 具有弱的氧化 性,但能否体现出Fe3+ 的氧化性,则要看与其 反应的酸是否有强还原性。如果有,则Fe3+会还 原成 Fe2+ 。
二、化学性质
①与非金属反应: 2Fe+3Cl2 ==2FeCl3 卤素
点燃
2Fe+3Br2= 2FeBr3
Fe+I2==FeI2
氧气
点燃
3Fe+2O2== Fe3O4 Fe+S==FeS
铁及其化合物+课件+2022-2023学年高中化学人教版(2019)必修第一册

F_e_(_O_H__)_3+__3_H__+_=_=_=_F_e_3_+_+__3_H__2O_
极易被空气中氧气氧化成 氢氧化铁
4Fe(OH)2+2H2O+O2= 4Fe(OH)3
_2_F_e_(O__H_)_3_=_=_△=_=_=_F_e_2_O_3_+__3_H__2O__
问题: 如何制备得到较长时间稳定存在的Fe(OH)2 ?
在如图所示的装置中,用NaOH溶液、铁屑、
稀H2SO4等试剂制备。思考解答下列问题: (3)在试管Ⅰ里加入的试剂是 稀H2SO4、铁屑 。 (4)在试管Ⅱ里加入的试剂是 NaOH溶液 。 (5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞 子后的实验步骤是_打__开__止__水__夹__a_,__待__Ⅰ___中__反__应__生__成__的__氢__气__排__净__装__置__中___的_ _空_气__后__,__再__关__闭__止__水__夹__a__。 (6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_试__管__Ⅰ__中__反__ _应_生__成__的__H__2_充__满__了__试__管__Ⅰ__和__试__管__Ⅱ__,__且__外__界__空__气__不__容__易__进__入_。
2. Fe2+、Fe3+相互转化的实验探究
常见还原剂
Fe2+
Cu、Fe粉、 KI溶液、 H2S水溶液……
氧化剂 Fe3+
还原剂
常见氧化剂
新制氯水、 过氧化氢、 酸性高锰酸、 硝酸……
2. Fe2+、Fe3+相互转化的实验探究
实验操作
FeCl3溶液中加入 KSCN溶液,加入铁
粉
取适量上层清液加氯 水,震荡
高中化学必修一铁及其化合物

高中化学必修一铁及其化合物要点一:单质铁的物理及化学性质1、铁单质的物理性质铁具有金属的通性,具有被吸引的特性,一般铁粉为黑色,铁块为银白色。
2、化学性质3、注意事项(1)铁与弱氧化剂(如S、I2、H+、Fe3+、Cu2+)等反应所得产物为Fe2+,铁元素的价态为+2价。
(2)铁与强氧化剂(如Cl2、Br2、浓H2SO4、硝酸等)反应所得产物为Fe3+,铁元素的价态为+3价。
①在氯气中燃烧,只生成氯化铁;与稀硝酸反应时则先产生+3价铁,若铁过量时则+3价铁再变为+2价铁;②铁在常温下遇到冷的浓硫酸、浓硝酸时发生钝化,属于化学反应。
(3)铁在纯氧中燃烧以及在高温下与H2O(g)反应得到的产物为Fe3O4,铁元素的价态为+2、+3价。
(4)铁不能与冷、热水反应,但能与水蒸气反应,与水蒸汽反应的产物也是Fe3O4。
典型例题1、某稀溶液中含有4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe,充分反应(已知NO3﹣被还原为NO).下列说法正确的是()A.反应后生成NO的体积为28 LB.所得溶液中c(Fe2+):c(Fe3+)=1:1C.所得溶液中c(NO3﹣)=2.75 mol/LD.所得溶液中的溶质只有FeSO4解:溶液中氢离子总物质的量为:n(H+)=2.5mol×2=5mol,n(NO3﹣)=4mol,铁粉的物质的量为1.5mol,由3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O,3 2 81.5mol 1mol 4mol,则1.5molFe完全反应时,硝酸根离子与氢离子均过量,则发生Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,若1.5molFe完全反应时,氢离子不足,则两个反应均发生,Fe+NO3﹣+4H+=Fe3++NO↑+2H2Ox 4x x x3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2Oy y y y则:x+y=1.5、4x+y=5,解得:x=0.75mol,y=0.75mol生成NO的体积为(0.75mol+0.75mol×)×22.4L/mol=28L,A.根据分析可知,反应后生成标况下28LNO,不是标况下,NO气体不一定为28L,故A错误;B.反应后生成铁离子为0.75mol,亚铁离子为0.75mol,c(Fe2+):c(Fe3+)=n(Fe2+):n(Fe3+)=1:1,故B正确;C.反应消耗硝酸根离子等于生成NO的量=0.75mol+0.75mol×=1.25mol,缺少溶液体积,无法计算溶液中硝酸根离子浓度,故C错误;D.反应后中含有硫酸铁和硫酸亚铁,故D错误;故选B.变式训练1、向500mL 2mol/L 的CuSO4溶液中插入一块铁片,反应片刻后取出铁片,经洗涤、烘干,称其质量比原来增重2.0g.下列说法错误的是(设反应后溶液的体积不变)()A.则此过程中参加反应的铁的质量是14gB.析出铜物质的量是0.25molC.反应后溶液中溶质物质的量浓度:c(CuSO4)=1.5mol/LD.反应后溶液中溶质物质的量浓度:c(FeSO4)=1.5mol/L2、将15g两种金属的混合物投入足量的盐酸中,反应完全后得到11.2L H2(标准状况),该混合物的组成可能是()A.钠和铁B.镁和铜C.铝和镁D.锌和铁要点二:铁的氧化物要点三:铁的氢氧化物1、常见的物理及化学性质4Fe(OH)2 + O2 + 2H2O =4Fe(OH)32Fe(OH)3Fe2O3+3H2O(受热分解)(2)Fe(OH)2的制备Fe(OH)2易被空气中的氧气氧化,生成Fe(OH)3,所以在制备Fe(OH)2时:①要确保Fe2+溶液中无Fe3+,故需加Fe粉,把Fe3+转化为Fe2+。
化学铁及其化合物的知识点总结

化学铁及其化合物的知识点总结
铁是一种常见的金属元素,它在自然界中广泛存在,并且在人类历史上也扮演了非常重要的角色。
以下是关于化学铁及其化合物的知识点总结:
1. 铁的物理性质:铁是一种银灰色的金属,具有良好的延展性和导电性。
它的密度约为7.87克/立方厘米,熔点为1538℃,沸点为2862℃。
2. 铁的化学性质:铁可以与许多元素和化合物反应,包括氧气、水、酸、碱等。
与氧气反应生成的氧化铁是最常见的铁化合物之一。
3. 铁的同位素:铁具有多种同位素,其中最常见的是铁-56。
其他铁同位素包括铁-54、铁-57、铁-58等。
4. 铁的存在形式:铁可以以多种形式存在,包括天然铁矿石、铁合金、生铁等。
天然铁矿石包括赤铁矿、磁铁矿、菱铁矿等。
5. 铁的生产:铁的生产通常通过高炉冶炼来实现。
该过程涉及将铁矿石和焦炭一起加热,以将铁从矿石中分离出来。
6. 铁的化合物:铁可以形成多种化合物,包括氧化铁、氯化铁、硫酸铁、亚硫酸铁等。
这些化合物在生活和工业中都有广泛的应用。
7. 铁的生物学作用:铁是人体必需的元素之一,它在体内参与形成血红蛋白和肌红蛋白,帮助携带氧气。
铁还是许多酶的重要组成部分。
总之,化学铁及其化合物在我们的生活和工业中都具有重要的地位。
了解铁的性质和应用有助于我们更好地利用和保护这种资源。
元素铁化学知识点总结

元素铁化学知识点总结一、铁的基本性质1. 原子结构:铁的原子序数为26,原子结构为1s2 2s2 2p6 3s2 3p6 4s2 3d6。
它是一种过渡金属,具有6种价态:-2、-1、0、+2、+3、+6。
2. 物理性质:铁是一种银白色的金属,具有良好的延展性和导电性。
在常温下,铁的晶体结构为面心立方,熔点为1535°C,沸点为2750°C。
3. 化学性质:铁能够与许多元素发生化学反应,如氧气、水、卤素等。
它易氧化,因此常常需要进行防腐处理,以延长其使用寿命。
二、铁的化合物1. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
2. 氢化物:铁和氢的化合物包括FeH2和FeH3等。
这些化合物在高压高温条件下可以稳定存在,但在常温常压下会发生分解反应。
3. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
4. 硫化物:铁和硫的化合物包括FeS、FeS2等。
这些化合物在自然界中普遍存在,如闪锌矿、辰砂等就是铁的硫化物。
5. 卤化物:铁和卤素的化合物包括FeCl2、FeCl3、FeBr2、FeI2等。
这些化合物具有不同的颜色和溶解性质,可用于化学实验和工业生产中。
6. 碳化物:铁和碳的化合物主要是Fe3C,即碳化铁,也称为水钢。
它是一种硬度很高的物质,常用于制作工具和机械部件。
三、铁的化学反应1. 与氧气的反应:铁在高温条件下能够和氧气发生燃烧反应,生成氧化铁。
4Fe + 3O2 → 2Fe2O32. 与水的反应:铁在冷水中不发生反应,但在热水或蒸汽中能够发生还原反应,生成氢气和氢氧化铁。
3Fe + 4H2O → Fe3O4 + 4H23. 与酸的反应:铁在稀盐酸或稀硫酸中能够发生还原反应,生成氢气和铁离子。
铁及其化合物的性质

铁及其化合物的性质铁是一种化学元素,其化学符号为Fe,原子序数为26,属于过渡元素。
在自然界中,铁广泛存在于岩石、土壤和矿物中,也是人类历史上最早被使用的金属之一。
铁的性质:1. 物理性质:铁是一种银白色或灰色的金属,密度为7.87 g/cm³,熔点为1535°C,沸点为2750°C。
在常温下易氧化,变成红色锈。
2. 化学性质:铁与氧气反应,生成黑色的三氧化二铁(Fe3O4),也叫做磁性氧化铁。
铁还可与二氧化碳反应,生成一种黑色的碳酸铁(FeCO3)。
铁可以与盐酸和硫酸反应,产生氢气和相应的铁盐或硫酸盐。
3. 磁性:铁是有磁性的金属。
在未受磁场影响时,铁原子的磁矩互相抵消,没有总的磁性。
但在受到外加磁场时,铁原子的磁矩会趋向于沿磁场方向排列,从而形成磁性体。
4. 导电性:铁是良好的导电体,因为铁原子中含有不少自由电子,可以在金属内部自由移动。
铁的化合物性质:1. 氧化铁:氧化铁是铁和氧气反应得到的一种化合物。
常见的氧化铁有三种:亚铁氧化物(FeO)、氧化亚铁(Fe2O3)和磁性氧化铁(Fe3O4)。
氧化铁具有一定的酸碱性,可以中和酸或碱,是一种常用的化学试剂。
2. 碳酸铁:碳酸铁是铁与二氧化碳反应得到的一种化合物。
在空气中易受到氧化反应,从而变成亚铁氧化物。
碳酸铁是一种不溶于水的白色粉末,可以作为一种矿物材料,广泛应用于建筑、陶瓷等行业。
3. 偏铁酸盐:偏铁酸盐是一类含有羟基的铁离子的化合物,如三偏铁酸钾(KFeO4)。
这些偏铁酸盐具有氧化性和还原性,在某些化学反应中有重要的作用。
4. 亚铁离子:亚铁离子是铁在溶液中的一种离子形式,可以形成各种铁盐。
亚铁离子在氧气存在的条件下,容易被氧化为氧化亚铁和磁性氧化铁。
5. 铁配合物:铁可以和许多有机配体形成稳定的铁配合物,如血红蛋白、酰胺铁等。
这些铁配合物对生命活动具有重要作用,在药物、生化学等领域具有广泛的应用。
总体来说,铁及其化合物具有多样的性质和广泛的应用,是现代工业和生活中不可或缺的重要物质之一。
铁及其重要化合物

铁及其重要化合物的性质1.铁的性质(1)(2)化学性质铁单质性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应:a.与O2的反应:常温:铁被腐蚀生成铁锈,其主要成分为Fe2O3。
点燃:b.与Cl2的反应:c.与S的反应:②与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:③与酸的反应:a.与非氧化性酸反应的离子方程式:b.与氧化性酸反应:遇冷的浓硫酸或浓硝酸,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应,但无H2产生。
④与某些盐溶液的反应:a.与CuSO4溶液反应的离子方程式:b.与FeCl3溶液反应的离子方程式:。
提醒:①铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe与Cl2反应生成FeCl3,而Fe与盐酸反应生成FeCl2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
③铁与硫蒸气反应生成的是FeS而不是Fe2S3;铁与碘蒸气反应生成的是FeI2而不是FeI3。
2.铁的化合物(1)铁的氧化物②化学性质FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式为,,。
(2)铁的氢氧化物①物理性质②化学性质a.稳定性Fe(OH)2:不稳定,分解产物复杂;在空气中易被氧化成Fe(OH)3,反应的化学方程式为,现象为白色固体变成,最终变为。
Fe(OH)3:不稳定,受热易分解,化学方程式为。
b.碱性Fe(OH)2属于二元弱碱,Fe(OH)3属于三元弱碱,与非氧化性强酸反应的离子方程式分别为。
③制备分别由可溶性的亚铁盐和铁盐与碱反应制得,离子方程式分别为。
(3)Fe2+和Fe3+的相互转化上述转化关系中标号反应的离子方程式为①,②,③。
提醒:①Fe3O4的组成可理解为FeO·Fe2O3,与非氧化性酸(如盐酸、稀硫酸)反应时生成Fe2+和Fe3+;与氧化性酸(如HNO)反应时生成Fe3+;与还原性酸(如HI)反应时生成Fe2+。
高中化学知识点:铁及其化合物
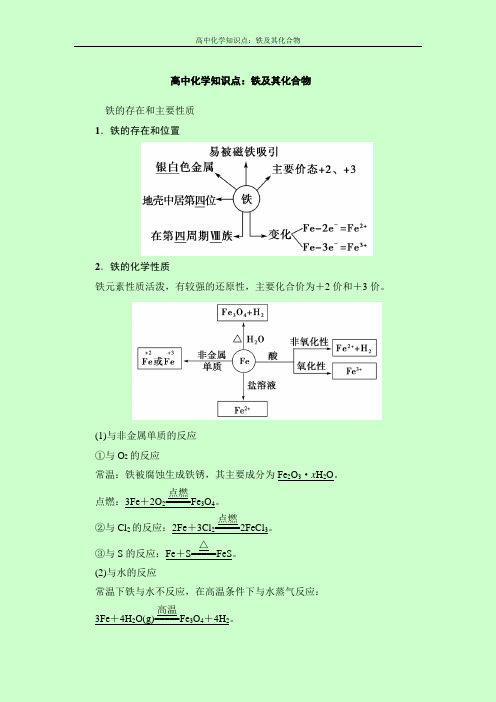
高中化学知识点:铁及其化合物铁的存在和主要性质 1.铁的存在和位置2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应 ①与O 2的反应常温:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3·x H 2O 。
点燃:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应: 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。
②与氧化性酸遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H2产生。
Fe与足量稀HNO3反应的离子方程式为Fe+4H++NO-3===Fe3++NO↑+2H2O。
(4)与某些盐溶液的反应①与CuSO4溶液反应的离子方程式:Fe+Cu2+===Cu+Fe2+。
②与FeCl3溶液反应的离子方程式:Fe+2Fe3+===3Fe2+。
铁的重要化合物1.铁的氧化物氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4) 俗名铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体铁元素价态+2 +3 +2、+3 说明:①FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式:FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O、Fe3O4+8H+===2Fe3++Fe2++4H2O。
②FeO与硝酸反应的化学方程式:3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O。
2.铁的氢氧化物Fe(OH)2Fe(OH)3色态白色固体红褐色固体与H+反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O二者的关在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+系O2+2H2O===4Fe(OH)3说明:Fe(OH)2、Fe(OH)3的制备可利用相应亚铁盐、铁盐与碱液反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁的化学性质及其化合物
化学性质铁的电子构型为(Ar)3d64s2,氧化态有0、+2、+3、+4、+5、+6。
铁的化学性质活泼,为强还原剂,在室温条件下可缓慢地从水中置换出氢,在500℃以上反应速率增高:
3Fe+4H O─→Fe O+4H
铁在干燥空气中很难与氧发生作用,但在潮湿空气中很易腐蚀,若含有酸性气或卤素蒸气时,腐蚀更快。
铁可从溶液中还原金、铂、银、汞、铋、锡、镍或铜等离子,如:
CuSO+Fe─→FeSO+Cu
铁溶于非氧化性的酸如盐酸和稀硫酸中,形成二价铁离子并放出氢气;在冷的稀硝酸中则形成二价铁离子和硝酸铵:
Fe+H SO─→FeSO+H4Fe+10HNO─→4Fe(NO)+NH NO+3H O
铁溶于热的或较浓的硝酸中,生成硝酸铁并释放出氮的氧化物。
在浓硝酸或冷的浓硫酸中,铁的表面形成一层氧化薄膜而被钝化。
铁与氯在加热时反应剧烈。
铁也能与硫、磷、硅、碳直接化合。
铁与氮不能直接化合,但与氨作用,形成氮化铁Fe N。
铁的最重要的氧化态是+2和+3。
二价铁离子呈淡绿色,在碱性溶液中易被氧化成三价铁离子。
三价铁离子的颜色随水解程度的增大而由黄色经橙色变到
棕色。
二价和三价铁均易与无机或有机配位体形成稳定的配位化合物,如FeCl、Fe(CN)、Fe(CN)、 Fe(Phen)、Fe(C O)等(Phen为菲罗林),配位数通常
为6。
零价铁还可与一氧化碳形成各种羰基铁,如Fe(CO)、Fe(CO)、Fe(CO)。
羰基铁有挥发性,蒸气剧毒。
铁也有+4、+5、+6价态的化合物,但在水溶液中只有+6价的。
化合物主要有两大类:亚铁Fe(Ⅱ)和正铁Fe(Ⅲ)化合物,亚铁化合物有氧化亚铁、氯化亚铁、硫酸亚铁、氢氧化亚铁等;正铁化合物有三氧化二铁、三氯化铁、硫酸铁、氢氧化铁等。
亚铁和正铁离子与氰根都可形成很稳定的配离子
Fe(CN)和 Fe(CN),如在亚铁氰化钾 K[Fe(CN)]·3H O和铁氰化钾K
[Fe(CN)]中。
铁与环戊二烯的化合物二茂铁,是一种具有夹心结构的金属有机化合物。
