蛋白不表达常见原因及分析
蛋白不表达原因
蛋白质不表达:常见原因及分析1.载体构建错误。
这个屡见不鲜,很多克隆新人经常弄错读码框。
比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。
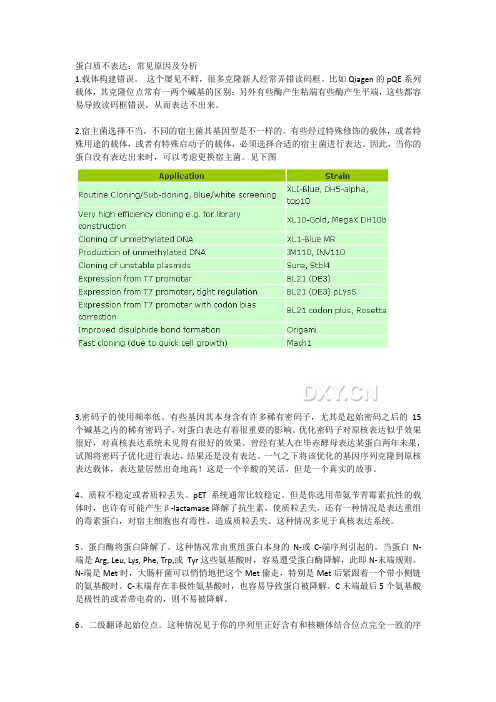
2.宿主菌选择不当。
不同的宿主菌其基因型是不一样的。
有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。
因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。
见下图3.密码子的使用频率低。
有些基因其本身含有许多稀有密码子,尤其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。
优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。
曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。
一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。
4、质粒不稳定或者质粒丢失。
pET系统通常比较稳定。
但是你选用带氨苄青霉素抗性的载体时,也许有可能产生β-lactamase降解了抗生素,使质粒丢失。
还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。
这种情况多见于真核表达系统。
5、蛋白酶将蛋白降解了。
这种情况常由重组蛋白本身的N-或C-端序列引起的。
当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或Tyr这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。
N-端是Met时,大肠杆菌可以悄悄地把这个Met偷走,特别是Met后紧跟着一个带小侧链的氨基酸时。
C-末端存在非极性氨基酸时,也容易导致蛋白被降解。
C末端最后5个氨基酸是极性的或者带电荷的,则不易被降解。
6、二级翻译起始位点。
这种情况见于你的序列里正好含有和核糖体结合位点完全一致的序列。
那就怪不得人家了,核糖体会很高兴地找到这个位点,然后开始翻译,致使你的蛋白被截短,在电泳时看不到预期大小的片段。
蛋白不表达常见原因及分析

蛋白不表达常见原因及分析在生物学和医学研究中,蛋白表达是一个至关重要的环节。
然而,经常会遇到蛋白不表达的情况,这给研究工作带来了很大的困扰。
要解决蛋白不表达的问题,首先需要了解导致这一现象的常见原因。
一、基因层面的问题1、基因序列错误基因在转录和翻译过程中,需要遵循严格的碱基互补配对原则。
如果基因序列本身存在错误,比如碱基的缺失、插入或突变,就可能导致 mRNA 无法正确合成,或者合成的 mRNA 无法翻译成有功能的蛋白质。
2、基因调控元件异常基因的表达受到多种调控元件的控制,如启动子、增强子、沉默子等。
如果这些调控元件发生突变或缺失,可能会影响基因的转录起始效率,导致蛋白表达水平降低甚至不表达。
3、基因拷贝数不足在某些情况下,基因的拷贝数过低会导致转录产生的 mRNA 量不足,从而无法合成足够的蛋白质。
二、转录层面的问题1、 RNA 聚合酶活性受影响RNA 聚合酶负责将 DNA 转录为 mRNA,如果其活性受到抑制或者出现功能障碍,就会影响 mRNA 的合成,进而导致蛋白不表达。
2、转录因子异常转录因子能够与基因的调控元件结合,促进或抑制基因的转录。
当转录因子的表达水平、活性或与调控元件的结合能力出现异常时,可能会影响基因的正常转录。
三、翻译层面的问题1、密码子偏好性不同的生物体对某些密码子的使用频率存在差异。
如果在表达系统中使用了不常用的密码子,可能会导致翻译效率低下甚至停滞,从而造成蛋白不表达。
2、 tRNA 丰度不足tRNA 负责携带氨基酸参与蛋白质的合成。
如果某些特定 tRNA 的丰度不足,无法及时供应相应的氨基酸,就会影响蛋白质的翻译进程。
3、核糖体结合位点问题核糖体需要结合在 mRNA 上的特定位点才能启动翻译。
如果核糖体结合位点的序列发生突变或缺失,核糖体无法有效结合,蛋白合成也会受到阻碍。
四、蛋白折叠与修饰问题1、错误折叠即使蛋白质成功合成,若折叠过程出现错误,形成的错误构象可能会被细胞内的质量控制系统识别并降解,导致蛋白无法积累。
蛋白不表达

蛋白不表达引言蛋白质是生物体中最基本的组成部分之一,它们在生物体内发挥着重要的功能。
然而,在某些情况下,蛋白质的表达可能会出现问题,导致一系列的生物学和医学问题。
本文将探讨蛋白质不表达的原因、影响以及可能的解决方法。
为什么蛋白不表达蛋白质的表达受到多种因素的调控,包括基因转录、蛋白翻译、蛋白质修饰等。
蛋白质不表达的原因可以是多方面的。
1. 基因转录问题基因转录是蛋白质表达的第一步,如果基因没有被正确地转录成mRNA,则无法进行后续的蛋白质翻译过程。
基因转录问题可能包括基因突变、转录因子缺失、启动子区域的变异等。
2. 蛋白翻译问题蛋白翻译是将mRNA转化为蛋白质的过程。
如果翻译过程中出现错误,或者翻译过程被抑制,都会导致蛋白质不表达。
蛋白翻译问题可能包括启动子序列的变异、翻译起始子的缺失、翻译因子的不足等。
3. 蛋白修饰问题蛋白修饰是调控蛋白质功能和活性的重要过程。
如果蛋白修饰过程出现问题,也会导致蛋白质不表达。
常见的蛋白修饰问题包括磷酸化、甲基化、乙酰化等修饰方式的缺失或错误。
蛋白不表达的影响蛋白质不表达可能会对生物体的正常功能产生重大影响。
1. 细胞功能受损蛋白质作为细胞内重要的功能分子,参与了细胞的各种生物学过程。
如果某些关键的蛋白质不表达,细胞的正常功能将受到严重的影响,可能导致细胞死亡、代谢紊乱等现象。
2. 器官和组织功能受损蛋白质的功能不仅限于细胞内部,还可以参与组织和器官的正常功能调控。
如果某些关键的蛋白质不表达,可能导致器官和组织的功能受损,进而影响整个生物体的生理活动。
3. 疾病的发生和发展蛋白质的不表达也可能与一些疾病的发生和发展密切相关。
例如,某些肿瘤细胞中特定的肿瘤抑制因子蛋白质不表达,导致异常的细胞增殖和分化,从而促进肿瘤的发展。
解决蛋白不表达的方法针对蛋白质不表达的问题,科学家们提出了一系列的解决方法。
1. 基因治疗基因治疗是利用基因传递手段将正常的基因传递给患者,从而恢复蛋白质的表达。
蛋白诱导不出来的原因

蛋白诱导不出来的原因
蛋白诱导是一种常用的生物实验技术,可用于表达外源蛋白,生
成特定蛋白及其片段,以及研究蛋白质互作等。
然而,在实验中,我
们也经常会遇到蛋白诱导不出来的情况,这可能是由以下原因引起的。
一、表达条件不优
蛋白质的诱导表达通常需要适宜的温度、培养时间、诱导剂浓度
等条件,这些条件可能会因不同蛋白而不同。
如温度过高或过低、培
养时间太短或太长,或者诱导剂的浓度不够,都可能导致蛋白质无法
被充分表达,从而无法诱导出来。
二、质粒或表达宿主株问题
质粒或表达宿主株问题也可能导致蛋白质不容易诱导出来。
比如,质粒本身可能受到污染或损伤,导致表达蛋白的缺陷;表达宿主株则
可能存在蛋白降解酶、异物毒性等问题,导致蛋白质无法得到稳定的
表达。
三、蛋白本身的问题
有时,蛋白本身的物理和化学性质也会影响蛋白诱导表达的效果,比如蛋白质的折叠、稳定性和荷电性等。
这些因素可能导致蛋白质不
易被表达,并可能影响到其生物活性和稳定性。
四、下游操作条件不佳
蛋白质诱导成功后,如不合适的后续操作条件(如提取、纯化、
储存等)也会影响蛋白质的稳定性和生物活性。
此外,若操作时存在
空气接触、低pH、高温等问题,也可能导致蛋白质的结构和功能性质
受到破坏。
综上所述,蛋白质的诱导表达需要严格的实验操作和优化条件,
只有在正确的操作和适宜的条件下,才能成功地诱导出蛋白质。
为此,实验人员需要对每个实验参数进行仔细研究和调整,以充分利用蛋白
质诱导技术的优点。
重组蛋白表达技术的使用中常见问题

重组蛋白表达技术的使用中常见问题蛋白质是生命体内重要的组成部分,它们参与了几乎所有的生物过程。
为了研究和利用蛋白质的功能,科学家们通过重组蛋白表达技术来大量产生目标蛋白。
然而,在使用重组蛋白表达技术的过程中,常常会遇到一些问题。
本文将详细探讨重组蛋白表达技术使用中的一些常见问题,并提供相应的解决方法。
1. 表达水平低在使用重组蛋白表达技术时,常常会遇到表达水平低的问题。
低表达水平可能由多种原因引起,包括启动子的活性不足、转录过程中的阻塞或降解、翻译后期的限制以及蛋白质的不稳定性等。
解决方法:- 优化启动子选择:选择活性较高的启动子,如T7、CMV或SP6启动子。
- 优化培养条件:优化培养基组分、培养温度、表达宿主菌的载体拷贝数等,以提高蛋白表达水平。
- 优化转化方法:尝试使用电转化、化学转化或峰值冲击转化等方法来提高表达宿主菌的转化效率。
- 优化培养时间:延长培养时间,以便提高目标蛋白的表达水平。
2. 目标蛋白形成包含体在表达过程中,目标蛋白常常形成包含体(inclusion body),即蛋白质以不溶性的聚集体形式存在。
解决方法:- 优化培养条件:调整培养温度、培养基成分,提高溶解蛋白的折叠效率。
- 引入辅助蛋白质:结合引入辅助蛋白质的策略,帮助目标蛋白的正确折叠和溶解。
- 进行亲和纯化:通过抗标签或亲和层析等技术,将包含体中包含的目标蛋白从非特异性蛋白质中进行纯化。
3. 目标蛋白磷酸化或糖基化不足重组蛋白质常常需要进行修饰,包括磷酸化和糖基化等。
然而,有时目标蛋白表达后,修饰的程度不足,影响功能和稳定性。
解决方法:- 优化培养条件:调整培养基中相关原料的浓度,如添加合适的磷酸盐或糖类物质,促进修饰的进行。
- 引入修饰相关基因:将相关调控基因引入到表达宿主菌中,提高修饰相关酶的表达水平。
- 转化进化系统:构建具有修饰相关基因的酵母或细菌转化进化系统,通过长时间的适应培养,提高修饰效率。
4. 目标蛋白的折叠和稳定性问题有些目标蛋白在表达和纯化过程中容易失去活性或不稳定。
大量蛋白表达下调的原因

大量蛋白表达下调的原因有多种,包括:
1. 基因表达调控:基因的表达受到多种因素的影响,如转录水平、翻译水平、蛋白质降解等。
这些因素可能因细胞生理状态、环境因素、药物处理等因素而发生变化,导致蛋白表达下调。
2. 基因突变:基因突变可能导致蛋白质结构异常,从而影响其功能和稳定性,导致表达下调。
3. 染色体变异:染色体变异可以改变基因的表达调控序列,如启动子区域的顺式元件、增强子等,从而影响蛋白表达。
4. 信号转导通路异常:信号转导通路异常可以影响细胞对各种刺激的反应性,进而影响蛋白表达。
5. 转录因子失衡:转录因子可以调节基因表达,如果这些因子的平衡发生变化,也可能导致蛋白表达下调。
6. 蛋白降解途径增强:有些蛋白可能通过降解途径被迅速降解,如果这种途径增强,就会导致相应蛋白表达下调。
7. 细胞周期和凋亡:细胞周期和凋亡过程会动态调整细胞内蛋白质的表达。
以上是常见的一些原因,具体情况可能会因个体差异而有所不同。
如遇到特定情况,建议咨询专业医生。
外源蛋白表达失败或不表达的原因和解决方法

外源蛋白表达失败或不表达的原因和解决方法外源蛋白表达的定义和意义外源蛋白表达是指在一个生物体(如细菌、酵母、昆虫、哺乳动物等)中表达另一个生物体(如植物、动物、病毒等)的蛋白质的技术,它是生物技术的重要手段和工具。
外源蛋白表达可以用于研究蛋白质的结构和功能,开发新型的药物和疫苗,生产工业用途的酶和激素等。
外源蛋白表达失败或不表达的原因外源蛋白表达失败或不表达的原因很多,可以分为上游和下游两类。
上游原因上游原因是指与外源基因本身特性或重组蛋白细胞毒性等相关的原因,它们只能通过上游的合理设计来解决。
上游原因包括以下几种:•外源基因与宿主细胞的密码子用法不匹配,导致翻译效率低或错误。
•外源基因含有宿主细胞不能识别或不能正确加工的信号序列,导致转运或定位异常。
•外源基因含有宿主细胞不能识别或不能正确剪切的内含子,导致转录或翻译中断。
•外源基因含有宿主细胞不能识别或不能正确修饰的位点,导致糖基化、磷酸化等后期修饰缺失或异常。
•外源基因含有宿主细胞不能兼容或不能稳定保存的序列,导致重组质粒不稳定或降解。
•重组蛋白对宿主细胞产生毒性或抑制作用,导致细胞生长受阻或死亡。
下游原因下游原因是指与下游的操作不当或失误等相关的原因,它们可以通过下游的规范操作和优化条件来避免。
下游原因包括以下几种:•重组菌甘油管保存时间过长,导致质粒丢失或突变。
•诱导剂加错或用量不当,导致重组蛋白表达水平低或无法诱导。
•表达条件选择不合适,导致重组蛋白表达效率低或形成包涵体。
•蛋白纯化步骤操作不规范,导致重组蛋白损失或污染。
•SDS-PAGE或WB检测操作不当或试剂失效,导致重组蛋白检测失败或假阴性。
外源蛋白表达失败或不表达的解决方法外源蛋白表达失败或不表达的解决方法需要根据具体的原因和情况进行选择和调整。
一般来说,可以从以下几个方面进行优化:•优化外源基因的设计,使其与宿主细胞的密码子用法、信号序列、内含子、修饰位点等相匹配或适应,或者使用人工合成的优化基因。
重组蛋白表达量低的原因

重组蛋白表达量低的原因重组蛋白是一种通过基因工程技术获得的蛋白质,其广泛应用于医药、农业和工业等领域。
然而,有时候在重组蛋白的表达过程中会出现表达量低的情况。
本文将探讨一些可能导致重组蛋白表达量低的原因,并提出相应的解决方法。
重组蛋白表达量低可能与宿主菌的选择有关。
不同的宿主菌具有不同的表达能力和代谢途径,因此选择合适的宿主菌对于提高重组蛋白表达量至关重要。
一些常用的宿主菌包括大肠杆菌(E. coli)、酵母菌(Saccharomyces cerevisiae)和哺乳动物细胞等。
在选择宿主菌时,需要考虑到其表达系统的稳定性、抗蛋白质降解能力以及合成成本等因素。
重组蛋白表达量低还可能与表达载体的设计有关。
表达载体是将目标基因插入宿主菌中进行表达的工具,其设计合理与否直接影响重组蛋白的表达效果。
在设计表达载体时,可以考虑使用强劲的启动子和转录终止子来提高基因的表达水平。
此外,还可以在表达载体中加入调控元件,如增加转录因子结合位点或操纵启动子的序列,以提高转录水平。
此外,还可以选择适当的信号肽序列来促进蛋白质的合成和分泌。
重组蛋白表达量低还可能与培养条件有关。
培养条件的优化可以显著提高重组蛋白的表达量。
首先,合理调节培养基的成分,如氮源、碳源和矿物质等,以满足菌体生长和蛋白质合成的需求。
其次,控制培养的温度、pH值和氧气供应等因素,以提供一个适宜的环境来促进蛋白质的表达。
此外,还可以加入一些诱导物质,如异丙基硫代半乳糖苷(IPTG)和甲醇等,来诱导目标基因的表达。
重组蛋白表达量低还可能与目标基因本身的特性有关。
一些基因可能具有高度的GC含量、结构复杂或毒性较强,这些特性都会影响基因的表达。
在此情况下,可以通过优化基因序列的设计来提高重组蛋白的表达量。
例如,可以通过基因合成或点突变来优化目标基因的序列,以解决结构复杂或毒性较强的问题。
除了上述因素外,重组蛋白表达量低还可能与转录和翻译后修饰等过程有关。
转录和翻译后修饰是蛋白质表达的重要环节,对于保证蛋白质的稳定性和功能性至关重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白不表达:常见原因及分析
根据自己体会和蛋白版的既往精华帖子,总结了没有发现蛋白质表达的原因,或者蛋白质不表达的原因,欢迎大家拍砖。
1.载体构建错误。
这个屡见不鲜,很多克隆新人经常弄错读码框。
比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。
2.宿主菌选择不当。
不同的宿主菌其基因型是不一样的。
有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。
因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。
见下图
3.密码子的使用频率低。
有些基因其本身含有许多稀有密码子,尤其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。
优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。
曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。
一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。
但是有一点我可以有很大把握的说:对于真核表达,密码子优化只能起锦上添花的作用(确认有表达,以此来提高表达量),而不能雪中送炭(没有表达出来,通过密码子优化极有可能不奏效)。
4、质粒不稳定或者质粒丢失。
pET系统通常比较稳定。
但是你选用带氨苄青霉素抗性的载体时,也许有可能产生
β-lactamase降解了抗生素,使质粒丢失。
还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。
这种情况多见于真核表达系统。
5、蛋白酶将蛋白降解了。
这种情况常由重组蛋白本身的N-或C-端序列引起的。
当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或Tyr这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。
N-端是Met时,大肠杆菌可以悄悄地把这个Met偷走,特别是Met 后紧跟着一个带小侧链的氨基酸时。
C-末端存在非极性氨基酸时,
也容易导致蛋白被降解。
C末端最后5个氨基酸是极性的或者带电荷的,则不易被降解。
6、二级翻译起始位点。
这种情况见于你的序列里正好含有和核糖体结合位点完全一致的序列。
那就怪不得人家了,核糖体会很高兴地找到这个位点,然后开始翻译,致使你的蛋白被截短,在电泳时看不到预期大小的片段。
7、SD序列。
这个不陌生吧?考研时老师喜欢出名词解释,也难怪人家老是拿这个出题----SD序列和起始密码子序列(80%是AUG,也有GUG的)之间的距离,对蛋白表达的效率也有着非常重要的影响。
SD序列本身的组成对翻译效率也有影响。
有时为了减少包涵体的产生,还特别对SD序列进行修饰呢!
8、mRNA的二级结构。
在克隆之前,你得看看你的序列里是否有和核糖体结合位点和/或翻译起始位点互补的序列。
如然,你最好进行同义密码子替换。
否则由此形成的mRNA二级结构,会让翻译嘎然而止的。
9、意外终止。
这种情况见于PCR扩增序列时,会和你开个不大不小的玩笑。
比如它会将序列中间TAC突变为TAA,让
你的蛋白翻译刹车。
所以在进行表达之前,一定要进行测序,避免这种情况的发生。
10、转录终止子。
转录终止子的存在可以促进蛋白表达;但是缺少时就会造成“通读”,没完没了地读下去。
这在pET系统里不成问题,因为它在靶基因的相反方向有个选择性的标记基因。
如果你的靶基因正好和这个标记基因方向一致,那么你得看看你的靶基因后是否有个转录终止子。
如果没有的话,它们会竞争得天昏地暗,抢着生成mRNA和蛋白质。
11、mRNA的不稳定性。
靶基因的mRNA常聚集于细胞内。
但是大肠菌的mRNA及其不稳定。
如果在mRNA的5'-非翻译区和3‘-rho非依赖性终止子处插入稳定结构序列,可以促进mRNA的稳定性。
尤其是5'末端要是有个不带突出的发夹结构,能让mRNA在胞浆内无生命之虞。
12、检测方法的可行性。
有时候,蛋白的确表达了,只是表达量特别低,或者和杂带靠得特别近,致使你错误地以为蛋白没有表达。
这时候,你可千万别忘记了生物学实验的两大黄金准则:对照和重复。
说到对照,有很多层意思。
最基本的意思是,要设立空载体对照。
在真核系统表达的蛋白,常常量特别低。
因此你不要老是想着WB和SDS-PAGE去检测。
这时候,你必须多看文献,
另辟蹊径,从文献中找找看这个蛋白有米有很特别的性质----比如说如果它具有酶活性,那简直就是便宜你了。
还比如说,某些蛋白具有异样性质,比如说流感病毒的HA,你拿表达的不同梯度稀释的蛋白做个血凝。
如果发生血凝,并且呈现一定的梯度关系,那简直就是板上钉钉的事情了。
总结起来,套用一句很经典的电影台词:能表达出来的蛋白,其原因都是一致的;表达不出来的蛋白,各有各的原因。
我这个小帖子,就是给你一点启示:从哪里找原因。
希望能抛砖引玉,得到更多有价值的建议。
