rTEV蛋白酶使用说明
tev protease序列

一、tev蛋白酶的简介tev蛋白酶是一种用于原核生物和真核生物中表达的重要酶。
它可以识别并切割蛋白质中的特定的肽键,因此在生物学和生物技术领域中有着广泛的应用。
tev蛋白酶最初是从土壤杆菌中分离出来的,后来被发现在其他细菌、酵母及植物中也存在相似的酶,因此被广泛应用于不同生物系统的蛋白表达和研究中。
二、tev蛋白酶的序列特点tev蛋白酶的序列长度较短,一般为了250-300个氨基酸。
其氨基酸序列中含有一个特定的切割位点,通常为Glu-Asn-Leu-Tyr-Phe-Gln-Gly。
tev蛋白酶的体系结构和机理已经在许多研究中得到了详细的解析,其活性部位和底物结合方式也被广泛研究和应用。
三、tev蛋白酶在蛋白工程中的应用由于其特异性和高效性,tev蛋白酶在蛋白工程中得到了广泛的应用。
研究人员可以利用tev蛋白酶来切割和纯化重组蛋白,其切割位点的特异性意味着可以在融合蛋白中特异性地切割并释放目标蛋白。
tev蛋白酶也可以被用于蛋白结晶和其他生物技术领域。
四、tev蛋白酶在基因编辑和细胞工程中的应用tev蛋白酶也被广泛应用于基因编辑和细胞工程领域。
在CRISPR/Cas9系统中,tev蛋白酶常被用于切割Cas9蛋白和它的融合蛋白,并在基因编辑过程中发挥重要作用。
在细胞工程领域,tev蛋白酶也可以用于蛋白标记和追踪等研究中。
五、tev蛋白酶的研究进展和展望随着生物技术领域的发展,tev蛋白酶的研究也在不断深入。
研究人员不断寻求提高tev蛋白酶的特异性和活性,以满足不断增长的生物技术需求。
tev蛋白酶的结构和机理解析也将为其在生物医学和药物研发中的应用提供更多可能性。
六、结论tev蛋白酶作为一种重要的蛋白酶,在生物技术和生物医学领域有着广泛的应用前景。
研究人员将继续努力深入 tev蛋白酶的研究,不断推动其在蛋白工程、基因编辑和细胞工程中的应用,为生物技术和生物医学领域的发展贡献更多力量。
七、tev蛋白酶在药物研发中的应用除了在蛋白工程和基因编辑领域的应用外,tev蛋白酶还在药物研发中发挥着重要的作用。
rTEV蛋白酶使用说明书
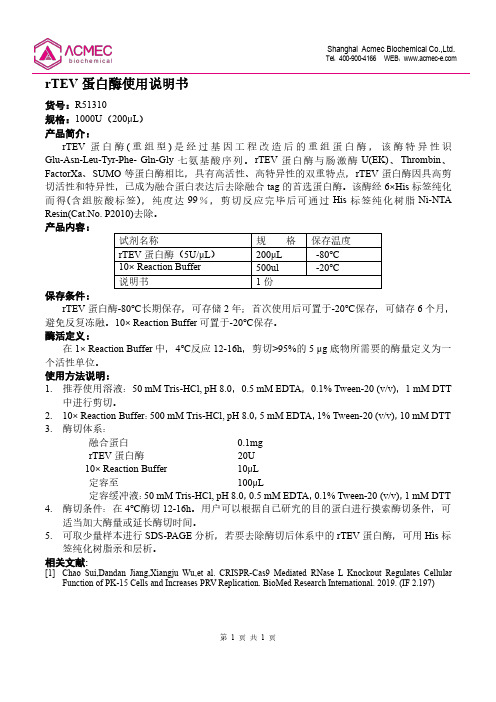
第1页共1页rTEV 蛋白酶使用说明书货号:R51310规格:1000U (200μL )产品简介:rTEV 蛋白酶(重组型)是经过基因工程改造后的重组蛋白酶,该酶特异性识Glu-Asn-Leu-Tyr-Phe-Gln-Gly 七氨基酸序列。
rTEV 蛋白酶与肠激酶U(EK)、Thrombin 、FactorXa 、SUMO 等蛋白酶相比,具有高活性、高特异性的双重特点,rTEV 蛋白酶因具高剪切活性和特异性,已成为融合蛋白表达后去除融合tag 的首选蛋白酶。
该酶经6×His 标签纯化而得(含组胺酸标签),纯度达99%,剪切反应完毕后可通过His 标签纯化树脂Ni-NTA Resin(Cat.No.P2010)去除。
产品内容:试剂名称规格保存温度rTEV 蛋白酶(5U/μL )200μL -80℃10×Reaction Buffer 500ul -20℃说明书1份保存条件:rTEV 蛋白酶-80℃长期保存,可存储2年;首次使用后可置于-20℃保存,可储存6个月,避免反复冻融。
10×Reaction Buffer 可置于-20℃保存。
酶活定义:在1×Reaction Buffer 中,4℃反应12-16h ,剪切>95%的5μg 底物所需要的酶量定义为一个活性单位。
使用方法说明:1.推荐使用溶液:50mM Tris-HCl,pH 8.0,0.5mM EDTA ,0.1%Tween-20(v/v),1mM DTT中进行剪切。
2.10×Reaction Buffer :500mM Tris-HCl,pH 8.0,5mM EDTA ,1%Tween-20(v/v),10mM DTT3.酶切体系:融合蛋白0.1mgrTEV 蛋白酶20U 10×Reaction Buffer 10μL定容至100μL定容缓冲液:50mM Tris-HCl,pH 8.0,0.5mM EDTA ,0.1%Tween-20(v/v),1mM DTT 4.酶切条件:在4℃酶切12-16h 。
tev蛋白酶切位点的dna序列

tev蛋白酶切位点的dna序列
Tev蛋白酶切位点的DNA序列是指Tev蛋白酶可以识别并切割的DNA序列,也被称为Tev切割位点。
Tev蛋白酶是一种常用的内切酶,具有高度特异性和高效性。
Tev蛋白酶的切割位点为5'-G|TATAC-3',其中“|”所示的位置为切割位点。
因此,Tev蛋白酶切割位点的DNA序列为5'-GTTAAC-3'。
Tev蛋白酶的切割位点的序列具有较高的特异性和保守性,因此在进行基因克隆和重组DNA技术时,Tev蛋白酶切割位点的选择非常重要。
在进行DNA片段连接时,通过在DNA的末端引入Tev蛋白酶切割位点,可以使用Tev蛋白酶将DNA 片段剪切开,并通过该切口将不同的DNA片段连接起来。
需要注意的是,Tev蛋白酶切割位点的DNA序列只是其中一种常用的切割位点序列,不同种类的内切酶所识别的切割位点序列也是不同的。
因此,在进行基因克隆和重组DNA技术时,需要选择适合特定目的的内切酶切割位点序列。
分子伴侣表达载体构建及TEV蛋白酶突变体的功能分析的开题报告

分子伴侣表达载体构建及TEV蛋白酶突变体的功能分析的开题报告1. 研究背景分子伴侣是指在细胞内负责帮助蛋白质正确折叠的一类蛋白质。
在生物体内,蛋白质折叠过程中常常会出现一些问题,如果不及时解决,就会导致蛋白质无法正常工作,造成一些严重的疾病。
因此,对分子伴侣的研究具有非常重要的意义。
TEV蛋白酶是一种广泛应用于蛋白质表达和纯化的酶。
通过将TEV蛋白酶识别的酶切位点插入到目标蛋白质的表达载体中,可以用TEV蛋白酶特异性地切割并分离目标蛋白质,提高目标蛋白质的纯度和产量。
因此,对TEV蛋白酶的研究也具有很大的实际意义。
2. 研究目的本项目旨在构建分子伴侣表达载体及TEV蛋白酶突变体,通过功能分析研究两者在蛋白质折叠和分离纯化过程中的作用和机制,为深入研究分子伴侣和TEV蛋白酶的生物学功能提供理论基础和技术手段。
3. 研究内容和方法3.1 分子伴侣表达载体构建本项目将选用pET-28a等广泛应用的质粒作为载体,构建分子伴侣表达载体。
首先,从Escherichia coli MG1655中扩增出chaperonin GroEL和GroES的基因片段,然后将其与载体的多克隆克隆位点连接,形成重组蛋白表达载体。
利用蛋白质表达、纯化和Western blot等技术检测载体构建的成功程度。
3.2 TEV蛋白酶突变体构建和功能分析本项目将构建TEV蛋白酶的突变体,以其对不同的酶切位点的识别和选择性切割能力进行分析。
首先,从原核细胞中扩增出TEV蛋白酶基因片段,并进行突变,形成若干个不同的TEV蛋白酶突变体。
然后,将突变后的TEV蛋白酶与表达载体进行连接,通过蛋白质表达、纯化和Western blot等技术对突变体的识别和选择性切割能力进行分析。
4. 研究意义本项目的研究将对分子伴侣和TEV蛋白酶的生物学功能进行深入研究,为更好地理解细胞内蛋白质折叠和纯化机制提供理论基础和技术手段。
此外,通过构建分子伴侣表达载体和TEV蛋白酶突变体,并对其功能进行分析,可以为生物医药工业领域的蛋白质表达和纯化等方面提供有效手段和技术支持。
rTEV蛋白酶使用说明书
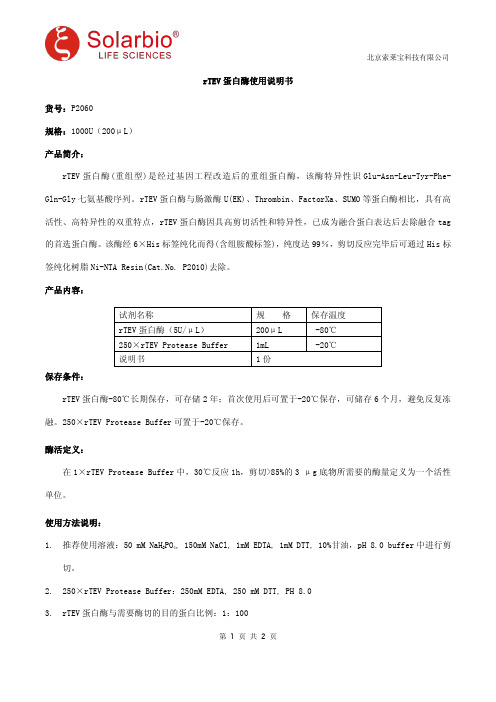
rTEV 蛋白酶使用说明书货号:P2060规格:1000U(200μL)产品简介:rTEV 蛋白酶(重组型)是经过基因工程改造后的重组蛋白酶,该酶特异性识Glu-Asn-Leu-Tyr-Phe-Gln-Gly 七氨基酸序列。
rTEV 蛋白酶与肠激酶U(EK)、Thrombin、FactorXa、SUMO 等蛋白酶相比,具有高活性、高特异性的双重特点,rTEV 蛋白酶因具高剪切活性和特异性,已成为融合蛋白表达后去除融合tag 的首选蛋白酶。
该酶经6×His 标签纯化而得(含组胺酸标签),纯度达99%,剪切反应完毕后可通过His 标签纯化树脂Ni-NTA Resin(Cat.No.P2010)去除。
产品内容:试剂名称规格保存温度rTEV 蛋白酶(5U/μL)200μL -80℃250×rTEV Protease Buffer1mL -20℃说明书1份保存条件:rTEV 蛋白酶-80℃长期保存,可存储2年;首次使用后可置于-20℃保存,可储存6个月,避免反复冻融。
250×rTEV Protease Buffer 可置于-20℃保存。
酶活定义:在1×rTEV Protease Buffer 中,30℃反应1h,剪切>85%的3μg 底物所需要的酶量定义为一个活性单位。
使用方法说明:1.推荐使用溶液:50mM NaH 2PO 4,150mM NaCl,1mM EDTA,1mM DTT,10%甘油,pH 8.0buffer 中进行剪切。
2.250×rTEV Protease Buffer:250mM EDTA,250mM DTT,PH 8.03.rTEV 蛋白酶与需要酶切的目的蛋白比例:1:1004.酶切体系:融合蛋白1000μg 250×rTEV Protease Buffer4μL rTEV 蛋白酶2μL 定容至1000μL定容缓冲液:50mM NaH 2PO 4,150mM NaCl5.酶切条件:在16℃酶切6hr。
烟草蚀纹病毒蛋白酶说明书

TEV Protease产品概述TEV Protease (烟草蚀纹病毒蛋白酶;Tobacco etch virus protease) 是来源于烟草蚀纹病毒(TEV) Nla的重组蛋白酶,此蛋白酶被用来切除纯化后融合蛋白的亲和标签。
TEV蛋白酶具有很强的位点特异性,能够识别EXXYXQ(G/S)的七氨基酸序列(Glu-Asn-Leu- Tyr-Phe- Gln-Gly),最普通的是ENLYFQG,其切割位点在谷氨酰胺和甘氨酸或丝氨酸之间。
该酶在PH 5.5-8.5和4-30℃的广泛范围内皆有活性,使得反应条件的选择可根据目的蛋白的情况而修改。
该酶带有His-sumo Tag经6×His标签纯化,剪切反应完毕后可通过Ni-NTA (产品货号:PAN001)去除。
本蛋白酶来源于大肠杆菌重组表达。
酶活性单位定义在1X TEV Buffer (50 mM Tris-HCl, pH8.0, 0.5 mMEDTA, 1mM DTT) 中,30℃条件下反应 1 小时,能够切割3 µg 的反应底物达 85%以上所需的酶量定义为一个活性单位。
产品溶液组分推荐反应体系不同温度下的参考反应时间:1.4℃反应 16 小时2.20℃反应 6 小时3.30℃反应 2 小时活性测试待测融合蛋白100µg,加入TEV protease 2µl,4℃反应 16 小时,取酶切前后样品SDS-PAGE检测,如右图所示 >90% 融合蛋白被切割。
储存条件长期储存于-80℃,可保存 2 年;或小量分装后保存于-20℃,可保存6 个月,避免反复冻融。
10X TEV Buffer 置于-20℃保存。
包装规格货号规格RPP002-100 100 URPP002-500 500 URPP002-2000 2000 U。
Bactobac表达系统中文版说明书

Bac-to-Bac杆状病毒表达系统试剂盒内容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方式产生重组杆状病毒。
此方式基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统要紧包括:*pFastBac捐献质粒的选择,它要能够产生包括目的位点的表达结构,那个目的基因的产生被杆状病毒特意位点启动子操纵。
*一个Ecoli宿主,DH10Bac,包括杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后能够产生重组杆粒。
*一个操纵表达的质粒,包括Gus和/或CAT基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优势:利用那个系统产生重组杆状病毒较传统的同源重组有以下优势:*与利用同源重组产生重组杆状病毒所需的4-6周相较,分辨纯化重组病毒少于两周*减少了从斑点挑选重组病毒DNA所包括亲缘和非重组病毒的概率*能够快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):大量的pFastBac菌体都适于进行Bac-to-Bac表达系统。
选择关于你的需要最适合的菌体。
指南用途:指南提供了一个关于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,利用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮忙你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他能够帮忙你很容易的产生杆状病毒表达你的重组蛋白,可是利用这系统更偏向于有杆状病毒生物学和昆虫表达背景的利用者。
tev蛋白酶的优化表达及功能分析

AbstractTobacco etch virus protease (TEVp) is widely utilized for cleavage the fusion tags owing to its stringent sequence specificity. Previously, we constructed the TEVp5M codon variant with increased yield but decreased specific activity. To further improve protein folding and increase the protein expression level of the TEVp,we combined different approaches to obtain new TEV protease with high yield and activity. Cleavage of different fusions absorbed with the corresponding resin using the constructed fusion protein.The results are as follows:1.Three variants were constructed. Based on the TEVp5M codon variant, we created three variants with mutations of K45F, E106G and K45F/E106G.2.Expression level and activity of TEVp variants were investigated. Qualitative analysis of TEVp variants in soluble were determined by SDS-PAGE and quantitative analysis of TEVp variants in soluble showed that as comparison to the TEVp5M codon variant, soluble yield of E106G variant in E. coli BL21(DE3) was increased by 28% , contrary to that of other two variants K45F and K45F/E106G by GFP fluorescence intensities.Qualitative and quantitative analysis of the purified fusion protein H6GST-tevS-eDAL as a TEVp substrate showed that activity of E106G variant on cleaving the designed protein substrate was raised by 32%. Other two variants including K45F and K45F/E106G were less active than the TEVp5M codon variant.3.Five TEVpE105G fusion proteins were constructed. We chose four protein tags including GroEL, GroES, DnaK and MBP to fuse with the E106G variant at N-terminus respectively. The TEVp recognition sequences is placed at the fusion junction of the fused tag and target protein. InfB(1–21) sequence is directly attached to the TEVp5M E106G variant.4.Expression level and activity of TEVp mutant in fusion protein were assessed. DnaK and MBP effectively enhanced soluble production of the TEVp construct and InfB (1–21) sequence decreased solubility of the protein than the His6-tag in E. Coli BL21(DE3) but GroEL and MBP significantly increased the activity of TEVp mutant.5.Supplying rare tRNAs on function of the fusion tag was examined.In E. coli strain Rosetta TM(DE3), InfB(1–21) sequence and MBP effectively enhanced soluble production of the TEVp. InfB(1–21) sequence and GroEL increased highest cleavage activity of TEVp mutant.6. Effect of the TEVp recognition sequences on fusion protein was analyzed.The tevS in the fusion protein MBP-tevS-TEVp-H6 was deleted to generate the fusion MBP-TEVp-H6.We found that deletion of the tevS did not affect soluble expression levels in two in E. coli strains correspondingly but significantly enhanced the activity in the Rosetta TM(DE3).7.Mutant protein with different fusion tag were purified respectively. We analyzed purification and specific activity of different TEVp constructs and determined efficiency of on-resin cleavage of the five fusion proteins.In conclusion, we confirmed that further amino acid mutations in improving protease soluble were influenced by other mutations. Certain fusion tags on improving protein production and quality is dependent with rare tRNAs abundance. In E. coli strain Rosetta TM(DE3),We first identified that GroES faintly increased protein solubility of the TEVp.The current research shows that the strain selection is important for optimization of the fusion tags. Even with assistance of the fusion tag, desirable production and quality of TEVp construct are not combined in the purified TEVp constructs.The constructed fusion protein of TEVp mutant for on-resin cleavage of partial fusion proteins made certain target proteins purified in single step.Key words:Tobacco etch virus protease,mutation,fusion tags,activity,Escherichia coli目录摘要 ................................................................................................................................ I Abstract ........................................................................................................................ III 目录 .............................................................................................................................. V 1 文献综述 . (1)1.1 蛋白重组及融合标签的应用 (1)1.2 TEV蛋白酶及其突变体研究 (2)1.3 大肠杆菌中tRNA丰度对表达外源蛋白影响的研究 (3)1.4 融合蛋白的亲和柱上酶切研究 (4)2 引言 (5)2.1 研究目的和意义 (5)2.2 研究内容 (5)3 材料与方法 (6)3.1 材料 (6)3.1.1 菌株和质粒 (6)3.1.2 试剂 (6)3.1.3 仪器和设备 (6)3.1.4 部分缓冲液的配制 (6)3.1.5 本研究中所需要的引物 (7)3.2 方法 (8)3.2.1 载体构建的相关反应体系 (8)3.2.2 构建烟草蚀斑病毒蛋白酶突变体K45F、E106G和K45F/E106G .. 93.2.3 构建带不同标签的E106G融合表达载体 (9)3.2.4 用于柱上酶切5种融合蛋白底物表达载体的构建 (11)3.2.5 不同TEVp突变体的表达分析 (11)3.2.6 GFP荧光强度检测不同TEVp突变体水溶性表达 (12)3.2.7 不同TEVp突变体的活性分析 (12)3.2.8 带不同标签的E106G融合蛋白的表达及活性分析 (13)3.2.9 融合蛋白的诱导表达纯化及产量测定 (13)3.2.10 纯化的TEVp活性分析 (14)3.2.11 MBP-E106G-H6用于融合蛋白的亲和柱上酶切效率分析 (14)4 结果与分析 (15)4.1 载体构建 (15)4.2 定性定量分析不同TEVp突变体的表达 (16)4.3 定性定量分析不同TEVp突变体的活性 (17)4.4 分析不同标签对E106G蛋白酶表达及活性影响 (17)4.5 分析提高胞内稀有tRNA水平对标签效应的影响 (18)4.6 分析融合蛋白中TEVp识别序列的作用 (19)4.7 带不同标签的E106G产量和活性的分析 (20)4.8 MBP-E106G-H6作为工具酶用于融合蛋白的亲和柱上酶切效率分析 (21)4.8.1 H6GST-tevS-mPrx融合蛋白的亲和柱上酶切 (22)4.8.2 H6GST-tevS-sDAL融合蛋白的亲和柱上酶切 (22)4.8.3 MBP-tevS-eDAL融合蛋白的亲和柱上酶切 (23)4.8.4 H6GST-tevS-mSrx融合蛋白的亲和柱上酶切 (24)4.8.5 GST-tevS-mSR融合蛋白的亲和柱上酶切 (25)5 讨论 (27)5.1 不同TEVp突变体水溶性及活性研究 (27)5.2 不同标签对TEVp表达及活性影响研究 (27)5.3 TEV蛋白酶作为工具酶用于融合蛋白亲和柱上酶切研究 (28)结论 (30)参考文献 (31)致谢 (39)个人简介 (40)1文献综述1.1 蛋白重组及融合标签的应用目前,蛋白重组技术是蛋白质结构和功能研究的重要方法,将目的基因克隆到表达载体并在宿主细胞中生产重组蛋白质[1-7]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FactorXa、SUMO 等蛋白酶相比,具有高活性、高特异性的双重特点,rTEV 蛋白酶因具高剪
切活性和特异性,已成为融合蛋白表达后去除融合 tag 的首选蛋白酶。该酶经 6×His 标签
纯化而得(含组胺酸标签),纯度达 99%,剪切反应完毕后可通过 His 标签纯化树脂 Ni-NTA
Resin(Cat.No. P2010)去除。
产品内容:
试剂名称
规格
保存温度
rTEV 蛋白酶(5U/μL)
200μL
-80℃
250×rTEV Protease Buffer
1mL
-20℃
说明书
1份
保存条件:
rTEV 蛋白酶-80℃长期保存,可存储 2 年;首次使用后可置于-20℃保存,可储存 6 个
月,避免反复冻融。250×rTEV Protease Buffer 可置于-20℃保存。
酶活定义:
在 1×rTEV Protease Buffer 中,30℃反应 1h,剪切>85%的 3 μg 底物所需要的酶量
定义为一个活性单位。
使用方法说明:
1. 推荐使用溶液:50 mM NaH2PO4, 150mM NaCl, 1mM EDTA, 1mM DTT, 10%甘油,pH 8.0 buffer 中进行剪切。
定容缓冲液:50 mM NaH2PO4, 150mM NaCl 5. 酶切条件:在 16℃酶切 6hr。用户可以根据自己研究的目的蛋白进行摸索酶切条
件,可适当加大酶量或延长酶切时间。
可取少量样本进行 SDS-PAGE 分析,若要去除酶切后体系中的 rTEV 蛋白酶,可用 His
标签纯化树脂亲和层析。
rTEV 蛋白酶使用说明
货号:P2060
规格:1000U(200μL)
产品简介:
rTEV 蛋 白 酶 ( 重 组 型 ) 是 经 过 基 因 工 程 改 造 后 的 重 组 蛋 白 酶 , 该 酶 特 异 性 识
Glu-Asn-Leu-Tyr-Phe- Gln-Gly 七氨基酸序列。rTEV 蛋白酶与肠激酶 U(EK)、Thrombin、
2. 250×rTEV Protease Buffer:250mM EDTA, 250 mM DTT, PH 8.0
3. rTEV 蛋白酶与需要酶切的目的蛋白比例:1:100
4. 酶切体系:
融合蛋白
1000 μg
250×rTEV Protease Buffer
4μL
rTEV 蛋白酶
2μL
定容至
1000μL
