湖南大学【无机化学】无机s区元素
无机化学S区元素概述单质及其物理化学性质

无机化学S区元素概述单质及其物理化学性质S区元素是指周期表中第三周期的元素,包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu和Zn。
这些元素的单质是指它们在自然界中以纯态存在的形态。
下面将对这些S区元素的单质及其物理化学性质进行概述。
Scandium(Sc)是一种银白色金属,熔点1541℃,沸点2836℃。
它的密度为2.989 g/cm³,熔化热为15.8 kJ/mol。
Scandium的化学性质活泼,可以与氢气、氧气和氮气反应。
它可以形成多种化合物,如ScCl3、Sc2O3等。
Titanium(Ti)是一种银灰色金属,熔点1668℃,沸点3260℃。
它的密度为4.506 g/cm³,熔化热为13.8 kJ/mol。
Titanium具有低密度、高强度和良好的耐腐蚀性。
它与氧、氮、氢等非金属元素反应生成化合物,如TiO2、TiN等。
Vanadium(V)是一种银白色金属,熔点1890℃,沸点3380℃。
它的密度为6.0 g/cm³,熔化热为21.5 kJ/mol。
Vanadium的化学性质活泼,可以与氧气、氮气和氟气反应。
它可以形成多种氧化态,如V2O5、VO2等。
Chromium(Cr)是一种银灰色金属,熔点1907℃,沸点2672℃。
它的密度为7.18 g/cm³,熔化热为20.5 kJ/mol。
Chromium的外层电子构型为3d54s1,具有良好的抗腐蚀性。
它可以形成多种化合物,如Cr2O3、CrCl3等。
Manganese(Mn)是一种银灰色金属,熔点1244℃,沸点1962℃。
它的密度为7.21 g/cm³,熔化热为13.2 kJ/mol。
Manganese与氧气反应生成二氧化锰(MnO2),具有一定的催化性能。
它还可以形成多种化合物,如MnCl2、MnSO4等。
Iron(Fe)是一种银灰色金属,熔点1538℃,沸点2861℃。
它的密度为7.874 g/cm³,熔化热为13.8 kJ/mol。
无机化学第七章S区元素

无机化学第七章S区元素第七章主要介绍了S区元素的性质和应用。
S区元素是指周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素具有一些共同的性质和特点,包括氧化态的规律和趋势、同族元素的化学性质等。
S区元素的氧化态规律和趋势是其重要的特点之一、氧化态是指元素在化合物中的电荷数。
在S区元素中,氧通常呈-2的氧化态,露卜那呈-1的氧化态,硫、硒和碲的氧化态则比较复杂,可以是正或负的多个值。
这种规律是由于这些元素的外层电子结构决定的。
氧的外层有6个电子,可以通过接受2个电子来填满外层,从而达到稳定的8个电子的结构。
而露卜那的外层只有一个电子,可以通过捐赠一个电子来达到稳定的结构。
而硫、硒和碲的外层电子结构类似,有6个电子,可以通过得失2个电子来达到稳定的8个电子的结构。
在S区元素中,氧是一个非金属元素,而硫、硒和碲则是亚稳金属。
氧具有较高的电负性,能够与其他元素形成较强的电负性键。
它在自然界中广泛存在,包括空气中的氧气、水中的水分子等。
由于氧的高电负性,它可以与其他元素形成氧化物,包括过氧化物、酸性氧化物和碱性氧化物等。
氧化物有着重要的应用,例如过氧化氢可用作漂白剂和消毒剂。
硫、硒和碲是黄顺子亚稳金属,它们具有较高的化学活性。
它们主要存在于矿石中,包括铁矿石中的硫化铁矿石。
硫还广泛存在于化学品中,包括硫酸、硫酸铜等。
硫还可以形成众多的无机化合物,例如硫化物和亚硫酸盐。
硫化物在冶金工业中有重要应用,例如焦炭的熔融炉和脱硫设备。
在亚稳金属中,硒是比较特殊的元素。
它可以形成六亚硒酸盐,具有良好的光敏性。
六亚硒酸盐可以用于摄影中的胶片和相纸的显影剂,以及红外线辐射计的探测剂。
此外,硒还可以形成硒化物,具有一定的半导体性能。
碲也是一种亚稳金属,具有类似硒的性质。
它可以形成一种黑色固体的碲化铋,具有比较好的半导体性能。
碲化铋被广泛应用于红外线成像和热电传感器等领域。
除了硫、硒和碲,S区元素中还有钋,它是一种放射性元素。
无机化学教学课件 12章 s区元素

Li+/Li
-3.04
Be2+/Be
-1.97
Na+/Na
-2.71
Mg2+/Mg
-2.36
K+/K
-2.93
Ca2+/Ca
-2.84
Rb+/Rb
-2.92
Sr2+/Sr
-2.89
Cs+/Cs
-2.92
Ba2+/Ba
-2.92
锂电对的数值乍看起来似乎反常,这个原子半径最小、电离
能最高的元素倒成了最强的还原剂.显然与其溶剂化程度(水合
M( N s 3H ()l)M (am )e(am )
碱金属在液氨中的溶解度 (-35℃)
碱金属元素 M
Li Na K Rb Cs
溶解度/ (mol ·L-1)
15.7 10.8 11.8 12.5 13.0
有趣的是,不论溶解的是何种金属,稀溶液都具有同一吸收波 长的蓝光.这暗示各种金属的溶液中存在着某一共同具有的物种.后 来实验这个物种是氨合电子,电子处于4~6个 NH3 的 “空穴” 中.
大气圈:O2、N2、CO2、稀有气体
地 壳
水圈:O、H、Cl、Na、Mg
岩石圈:Si、O、H、金属
元 素 单
气态:AHr2、、KN2r、、OX2e、(C11l2种、)F2、He、Ne、
质 (
液态:Hg、Br2(2种)
常 温
固态:剩余大多数 a
3
)
a
4
a
5
人体中的元素
必 需 元
宏量元素:11种,占99.95%,其中主要为 O、C、H、N,占96%
第三,由于钾变成蒸气,可设法使其不断离开反应体系,让 体系中其分压始终保持在较小的数值.不难预料随Pk变小, D r Gm 向负值的方向变动,有利于反应向右进行.
无机s区元素
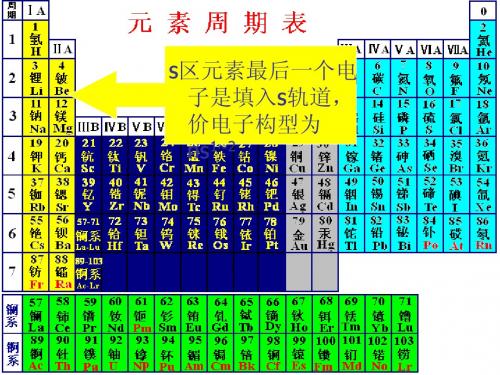
3、超氧化物:除Li、Be、Mg外,s 区元素与O2反 应生成超氧化物: K+O2=KO2 2KO2+2H2O=H2O2+O2↑+KOH 4KO2+2CO2=3O2↑+2K2CO3 O22- [(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2 (π2p)4(π2p*)4] O2- [(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)3] 4、对角相似规则:周期表中某元素的性质与它左 上方或右下方的另一元素的性质相似 原因:离子极化能力相近,离子极化能力大小 取决于离子原子半径、电荷数、电子层构型
(二)氢氧化物
酸式离解
碱式离解
R离子的离子势φ=Z/r, 氢 氧 7< φ1/2 <10 φ 1/2 <7 化 物 碱
φ1/2 >10 酸
1、在同一周期,最高氧化态的阳离子Rn+, 从左到右,电荷数依次增大,半径依次减 小,氢氧化物酸性增强。
Na+
半径 95 /pm φ1/2 3.2
Mg2+ Al3+ 65 5.5 50 7.7
3、形成结晶水合物及热稳定性特征: 水合离子:离子所带电荷越多,半径越小, 水合作用越强。水合离子半径 Na+>K+ 热稳定性:MX和M2SO4稳定,M2CO3只有 Li2CO3不稳定,MNO3不稳定。 4、几种重要的盐: NaCl、KCl 、CaCl2 ·6H2O 、BaCl2 ·2H2O 泻盐 MgSO4 重晶石 BaSO4 CaSO4 ·2H2O 烧石膏 CaSO4 ·1/2H2O 无水 CaCl2 石膏
+
+
Li的电极电势最低,但是Li与水反应不如 Na反应激烈,为什么? 单质Li熔点高,与水反应放热不足以使其 液化,分散性差,反应活性降低。LiOH 溶解度小,覆盖于金属表面,阻碍反应 进行。后者是Li与水反应不如Na剧烈的主 要原因
无机化学试题及答案s区元素

无机化学试题及答案s区元素一、选择题(每题2分,共20分)1. 以下哪种元素属于s区元素?A. 锂(Li)B. 钠(Na)C. 铝(Al)D. 氯(Cl)答案:B2. s区元素通常具有哪些价电子?A. 1个B. 2个C. 3个D. 4个答案:B3. 钠的电子排布式是什么?A. 1s²2s²2p⁶3s¹B. 1s²2s²2p⁶3s²C. 1s²2s²2p⁶3s²3p⁶D. 1s²2s²2p⁶3s²3p⁴答案:B4. s区元素的原子半径随着原子序数的增加而如何变化?A. 减小B. 增加C. 保持不变D. 先增加后减小5. 以下哪种化合物是由s区元素组成的?A. NaClB. MgOC. SO₃D. CO₂答案:A6. s区元素的金属性如何随原子序数增加而变化?A. 增强B. 减弱C. 先增强后减弱D. 先减弱后增强答案:A7. 锂的原子序数是多少?A. 2B. 3C. 4D. 5答案:B8. 钾的电子排布式是什么?A. 1s²2s²2p⁶3s²3p⁶4s¹B. 1s²2s²2p⁶3s²3p⁶4s²C. 1s²2s²2p⁶3s²3p⁶4s¹4p⁶D. 1s²2s²2p⁶3s²3p⁶4s²4p⁶答案:B9. s区元素的离子通常具有什么电荷?B. +2C. -1D. -2答案:A10. 钠的熔点是多少摄氏度?A. 98B. 300C. 600D. 900答案:A二、填空题(每题2分,共20分)1. s区元素包括碱金属元素和____元素。
答案:碱土2. 锂的原子序数为3,其电子排布式为______。
答案:1s²2s¹3. 碱金属元素的价电子数为______。
无机化学教学课件 12章 s区元素

钾比钠活泼,为什么可以通过如下 反应制备金属钾?
KCl + Na 熔融 NaCl + K
首先,钾的第一电离能 (418.9 kJ·mol-1 ) 比钠的第一电离能
(495.8 kJ·mol-1 )小的缘故.
其次,通过计算可知固相反应的D r Hm是个不大的正值,但钾 的沸点(766 ºC)比钠的沸点(890 ºC )低,当反应体系的温度控 制在两沸点之间,使金属钾变成气态,而金属钠和KCl 、NaCl 仍 保持在液态,钾由液态变成气态, 熵值大为增加,即反应的T D r Sm 项变大,有利于D r Gm变成负值,反应向右进行.
Li
Na K
Rb Cs
Be Mg
Ca Sr
Ba
12-1-2 化学性质
(1) 与氧、硫、氮、卤素反应,形成相应的化合物 单质在空气中燃烧,形成相应的氧化物:
Li2O BeO
Na2O2 MgO
KO2 CaO
RbO2 SrO
CsO2 Ba2O2
你能发现这些氧化物的形式有 什么不同?
Li2O Gc2-706-18.12
Na2O2
镁 带 的 燃 烧
KO2
Question 1
为什么在空气中燃烧碱金属 所得的产物不同?
该问题可以从以下几个方面讨论:
1. 燃烧产物可从燃烧反应的能量变化中推测. 哪一个燃烧反应的 DG负值最大,产物就 是哪一个. 例如,Na 生成Na2O、Na2O2 和 NaO2的DG 分别是 -376 kJ·mol-1, -430 kJ·mol-1和 –389.2 kJ·mol-1, 因此燃烧产物就是 Na2O2 .
1.了解 s 区元素的物理性质和化学性质,能够解释 Li 的 标准电极电势为什么最低 ,能解释碱金属与水、醇和液 氨反应的不同;
无机化学 S区元素概述单质及其物理化学性质

2
CsO2 BaO2
镁 带 的 燃 烧
Li, Ca等同时生成氮化物
2O2 Na2ONa 2
Li3N
Ca3N2
Ba3N2 KOKO 2 2
2、与水作用:
2M + 2H2O → 2MOH + H2(g)
Li
Na
K
Ca
锂 (不熔化); 钠 (熔化);钾(燃烧) ; 铷 , 铯(爆炸)
3、与液氨的作用 +
IA
电 离 势 、 电 负 性 减 小 金 属 性 、 还 原 性 增 强
IIA Be Mg Ca
原 子 半 径 增 大
Li Na K
Rb
Cs
原子半径减小、
Sr
Ba
金属性、还原性减弱 电离势、电负性增大
同周期IA和IIA比较
ⅠA 主要氧化态 原子半径 电负性 +1 最大 最小 > < ⅡA +2 较大 较小
2M(s) + 2NH 3 (l) → 2M + 2NH + H 2 (g)
2
M(s) M (am)+ e (am)
液氨溶剂 -
+
4、其离子的焰色反应
Li+
K+
红
紫
Na+
黄
Rb+ 紫红 Ca2+ 橙红 Ba2+ 黄绿
Cs+ 紫红 Sr2+ 红
通性:
1. 易与H2直接化合成MH、MH2离子型化合物; 2. 与O2形成正常氧化物、过氧化物、 超氧化物; 3. 与其他非金属作用形成相应的化合物;
1、与氧、硫、氮、卤素反应,形成相应化合物
无机化学-s区元素ppt课件

定性鉴定金属离子能否存在
各种离子的焰色反响
Li+ 红 K+ 紫 红 Cs+ 紫红 红 Sr2+ 红 黄绿
Na+ 黄 Rb+ 紫
Ca2+ 橙
Ba2+
2.晶体类型:
绝大多数是离子晶体,但碱土金属卤化 物有一定的共价性。 例如:Be2+极化力强, BeCl2已过渡为共价
化合物。 BeCl2 MgCl2 CaCl2 SrCl2
中强
强
强
强
(箭头指向) 碱性加强,溶解度增大
NaOH >Mg(OH)2
3.化 学 性 质
〔1〕与酸性氧化物反响 2NaOH + SiO2 = Na2SiO3 + H2O Ca(OH)2+CO2=CaCO3↓+H2O
〔2〕与两性金属反响 Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑
〔3〕与非金属反响 4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3 Si + 2NaOH + H2O = Na2SiO3 + 2H2
Li
Na
K
Ca
锂 (不熔化); 钠 (熔化);钾(熄灭) ; 铷 , 铯(爆炸)
◆ 与液氨作用
● 碱金属溶于纯液氨,随金属溶解量添加,
蓝色
深蓝色
青铜色
M ( s ) + ( x + y ) N H 3 ( l ) [ M ( N H 3 ) x ] + + [ e ( N H 3 ) y ] 氨合阳离子 氨合电子
〔3〕强氧化性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11.1 氢
11.1.1 引言 11.1.2 氢的成键特征 11.1.3 氢化物 11.1.4 氢反应 11.1.5 氢能源
11.1.1 引言
H
氢是周期表中唯一尚未找到确切位
置的元素.······
氢的存在状态
氢的状态 金属氢(s) 液态氢(l) 固态氢(s)
密度/g·cm-3 0.562
0.071
(2~3) × 105Pa
LaNi5 + 3 H2 微热
LaNi5H6, 含H2量大于同体积液氢
钯的这一性质被用 于制备超纯氢:基于微 热时,PdH2 分解,由于 压差和 H原子在金属Pd 中的流动性,氢以原子 形式迅速扩散穿过 Pd– Ag 合金而杂质气体则 不能.
11.1.4 反应综述
氢的大部分性质以在前面各有关章节讲过,这里不再赘述.
水蒸气 转化法
CH4(g) + H2O(g) 1273k 3 H2(g) + CO(g) 其中产物氢的三分之一来自水.
水煤气反应
C (s) + H2O(g) 1273k H2(g) + CO(g) 其中产物氢的百分之百来自水.
H2(g) + CO(g) 就是水煤气,可做工业燃料,使用时不必分离. 但若为了制氢,必须分离出CO.
11.1.4.1 H2 反应热力学
合成二元氢化物的三种常用方法是:
(1) 元素直接化合
2E + H2(g)
2 EH
例如,2Li(l) + H2(g)
2LiH(s)
(2) BrØnsted 碱的加合质子
E- + H2O(ag)
EH + OH-
例如,Li3N(s) + 3 H2O(l)
3Li(OH) (ag) + NH3(g)
HI (g) +1.7
CsH(s) BaH2(s) –32.0 –140.0
(2) 分子型氢化合物由上而下稳定性降低的趋势与其平均键焓 (kJ · mol-1)有关. 较重元素形成较弱的键,这一事实通常归因于相对 密实的 H1s 轨道与较松散的重元素 s 和 p 轨道重叠能力比较差.
11.1.4.2 H2反应机理
美国
可
Michiga 见
n州立大 光
学H. Ti
Tien教
授的装置
Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液
硒镍 化 镉 半 导 体箔
H2(g)
海水
海水制氢的装置示意图
我国已建成大型制氢设备
大容量电解槽体
H2
大型制氢站
氢气纯化装置
氢气储罐群
氢的用途
燃料
氢 气(H2) 戊硼烷(B5H9) 戊 烷(C5H12)
5.了解主要元素的矿物资源及单质的制备方法 ,特别注意 钾和钠制备方法的不同;了解s区元素的氢化物、氧化物、氢
氧化物的性质,特别注意氢氧化物的碱性变化规律; 3. 6.了解 s 区元素的重要盐类化合物,特别注意盐类溶解性
的热力学解释;会用离子极化理论解释碳酸盐分解规律;
7.了解对角线规则和锂、铍的特殊性.
● H2 分子被 ZnO 固体表面吸附:
H– H+
H2
+
Zn—O—Zn —O ///////////////////////////
Zn—O—Zn —O ///////////////////////////
● CO 加氢制取甲醇:
CO(g) + 2 H2(g) Cu/Zn 催化 CH3OH(g)
● 铜的冶炼中 H2 被用做 Cu2+ 离子的还原剂:
2 H2O(g) + O2(g) = 2 H
b
压力增高方向
爆炸区
c
人们将这种复杂性归因于链反应机理: H2 hr2H • ,既涉
及简单键增殖 ·OH + H2
H2O + ·H , 也涉及分支键增殖 ·H + O2
·OH + ·O ·和 ·O ·+ H2
·OH + ·H .
H2(g) + Cu 2 + (aq)
[CuH]+(aq) + H+(aq)
H2(g) Cu(s) + H+(aq)
(3) 外界条件引发产生 H 自由基
例如,H2 和 O2 生成水的反应: 爆鸣气在某种恒定温度下
的反应速率随压力增大发生不 规则变化的事实说明了反应过 程的复杂性.773 K 时的反应速 率随压力增大两次经过平缓反 应区和爆炸反应区:
H-存在的重要化学证据:电解其与碱金属的熔 融物,阳极放H2: 2 H- →H2 + 2e-
与水反应
H- +H2O → OH- + H2
此时 H- 表现出强还原性、不稳定性和强碱性
实验室用来除去有机溶剂或惰性气体(如N2,Ar)中微量水
11.1.3.3 金属型氢化物
第3至第5族所有d 区金属和 f 区金属都形成金属型氢化物
H 2SO 4
(g)
1073K
H2O(g)
SO2
(g)
1 2
O2
(g)
2HI(g) 873K H2 (g) I2 (g)
净反应
H
2O(g)
1300K
H2
(g)
1 2
O2
(g)
电解法
4OH- → O2+2H2O + 4e- (阳极) 2H2O +2e- → 2OH- + H2 (阴极)
加热(383—423K)加压(1013—3039kPa),效率可提高到 90% 以上.
制备方法 用单质直接化合,极纯的金属才可得到含氢最高的产物
特点: 有金属的电传导性和其他金属性质如磁性. 有明确的物相,有整比化合物和非整比化合物
成键理论:
● 氢以原子状态存在于金属晶格中. ● 氢以H+存在于氢化物中,氢将电子供入化合物的导带中. ● 氢以H-形式存在,每个氢原子从导带取得1个电子.
配合催 化太阳 能分解
hν
三(2,2’—联吡啶) 合钌(Ⅱ)(2a)
2a*(已活化)
光能
2(2a*)
H2O
H2
1 2
O2
2(2a)
2a 既是电子给予体,又是电子接受体,在光能的激发下,可以 向水分子转移电子,使 H+ 变为 H2 放出.
最近,日本有人把太阳能电池版与水电解槽连接在一 起,电解部分的材料在产生氢气一侧使用钼氧化钴,产 生氧气一侧则使用镍氧化钴. 使用1平方米太阳能电池版 和100毫升电解溶液,每小时可制作氢气 20 升,纯度为 99.9%.
氢的三种 同位素
1H:丰度最大,原子百分比为99.98% 2H or D:具有可变的天然丰度
稳定核
3H or T一种不稳定的反射性同位素
3H
3He + 0e
1
2
-1
氢的制备 (每年估计达500×109m3) 实验室制法
● Zn + H3O+ →Zn2+ + 2H2O + H2 ↑
制氢最经济的原料:煤和以甲烷为主要成分的天然气.
KH(s) –36.0
CaH2(s) GaH3
–147.2
>0
GeH4(g) +113.4
AsH3(g) +68.9
H2Se (g) +15.9
HBr (g) – 53.5
RbH(s) SrH2(s) –30.0 –141.0
SnH4(g) +188.3
SbH3(g) +147.8
H2Te (g) >0
富电子氢化物,如NH3,中 心原子成键后有剩余未成键 的孤电子对.
熔沸点低,通常条件下为气体
因共价键极性差别较大而化学行为复杂
B2H6 CH4
NH3
11.1.3.2 离子型氢化物 (似盐型氢化物)
s 区金属氢化物,非挥发性,不导电, NaCl晶形
H-的半径: 126pm (LiH) ~ 154pm(CsH) (原子核对核外电子的控制较松弛)
应用 催化作用
金属 Pt 具有催化作用,可以被解释为 表面 Pt 原子形成 Pt–H 键的 键 焓大得 足以使键断开,却不足以补偿 Pt –Pt 金属键断裂所需的能量.
储氢材料
1体积金属Pd可吸收 700 体积 H2,减压 或加热可使其分解
2
Pd
+
H2
常况 减压,327
2
K
PdH
523 K
U + 3/2 H2 573 K UH3
(3) 卤化物或拟卤化物与氢化物之间的复分解
E’H + EX 例如,LiAlH4 + SiCl4
E’X + EH LiAlCl4 + SiH4
工业上用第(1)种方法合成放能化合物,然而某些情况下需要 采取强化条件(高压、高温和催化剂)以克服不利的动力学因素.采取 第(2) 和(3)种方法,以避免强化条件带来的麻烦.后两类方法也可用 来制备吸能化合物.
氢分子与大多数元素和不少化合物之间的反应进行得很慢这是 因为它的高键焓使反应需要较高的活化能.
能得以进行反应的条件有:
(1) H2分子在金 属表面(多相 催化)或金属 配合物上(均 相催化)发生 均裂而得以
活化:
(a)
(b)
H2分子在金属表面(a)和配合物中(b)发生的均裂活化
(2) H2分子在固体表面(多相催化)或金属离子(均相催化)发生异裂而 得以活化:
共价型氢化物
结构类型并非非此即彼,而是表现出某种连续性. 例如,很难严格 地铍和铝的氢化物归入“似盐型”或“分子型”的任一类.
