分子对接简要介绍
分子对接的原理方法及应用

分子对接的原理方法及应用分子对接是一种计算机辅助药物设计的方法,旨在研究分子之间的相互作用,并预测化合物与靶点的结合能力。
本文将介绍分子对接的原理、方法和应用。
一、原理分子对接依赖于分子间的相互作用力,主要包括静电相互作用、疏水效应、范德华力、氢键等。
靶点通常是蛋白质,在药物设计中通常是疾病相关的蛋白质。
药物分子通过与靶点之间的相互作用,改变蛋白质的构象,从而调控其生物活性。
二、方法1.受体基因构建与表达:受体基因通过克隆技术构建并表达到适当的宿主细胞中,通常是大肠杆菌等。
2.配体库构建:配体库包括已知药物、天然产物等化合物。
配体库可通过多种方法构建,包括化学合成、天然产物提取等。
3.分子对接算法:常用的分子对接算法包括基于力场的对接、基于构象的对接和基于机器学习方法的对接。
其中,基于力场的对接方法基于分子力学力场和基本的物理原理进行模拟;基于构象的对接方法通过配体与受体结合的最佳构象;基于机器学习方法则通过对已知的配体-受体结合数据进行学习,同时预测新的配体-受体结合能力。
4.结果评估和优化:对于预测的配体-受体结合结果,可以通过计算结合自由能、氢键数目等来评估其可靠性。
同时,还可以通过化学修饰和结构优化等方法对候选物进行进一步优化。
三、应用1.药物研发:分子对接是药物设计的重要工具,通过预测化合物与靶点的结合能力,可以筛选出潜在的药物候选物。
其可以大幅度减少实验筛选的成本和时间。
2.靶标识别:分子对接可用于预测已知药物的作用靶点,为药物的多靶点设计提供参考。
3.蛋白质结构预测:利用分子对接方法,可以预测蛋白质的结构,尤其是在蛋白质晶体结构难以获取时,对药物设计和基因工程有重要意义。
4.农药和杀虫剂设计:分子对接可用于预测农药和杀虫剂与害虫体内受体结合的效果,从而设计出更高效的农药和杀虫剂。
5.仿生催化剂设计:分子对接可用于预测催化反应过程中底物与催化剂之间的相互作用,从而设计出更高效的仿生催化剂。
分子对接步骤范文

分子对接步骤范文
一、分子对接介绍
分子对接是一种计算生物学的研究方法,它模拟并计算了分子相互间的结合作用,从而帮助科学家了解分子的结构及其相互作用过程。
为了确定分子间的结合作用,分子对接技术利用了物理化学理论,建立了计算模型,以计算不同的分子在不同环境下的相互作用能量。
由于不同分子间的作用力的复杂性,分子对接技术必须采用机器学习技术来提高计算效率。
通过对接和分析,可以发现可能的分子和结合体,并研究其结构和性质。
二、步骤
(1)首先选取分子对接技术以及对接用的分子,选定对接参数,形成分子对接设置,如果分子对接技术支持,还要给出其他对接参数,其它可配置参数以及用户定义参数;
(2)建立空间,为了确保结果准确有效,先要对分子结构,以及分子的相互作用能量进行;
(3)选择策略,有多种策略可以选择,根据任务,选择其中一种最适合的策略进行;
(4)进行实际的对接计算,此步骤可以根据用户的要求和性能等参数可以进行设置,以保证计算速度和准确率;
(5)计算完成之后,分析对接数据,根据对接数据。
简述分子对接的原理和应用

简述分子对接的原理和应用1. 概述分子对接是一种计算化学方法,用于模拟和预测分子之间的相互作用以及它们在生物体内的相互作用。
分子对接在药物设计、蛋白质研究等领域中有广泛的应用。
2. 分子对接的原理分子对接的原理基于分子之间的相互吸引力和排斥力。
分子对接通过将配体(小分子)与靶标位点(蛋白质)进行模拟,预测它们之间的最佳结合模式。
3. 分子对接的步骤分子对接通常包括以下步骤:(1) 数据准备在分子对接之前,需要准备配体和靶标的三维结构信息,通常是通过实验测定或计算方法得到的。
(2) 靶标位点的预测如果靶标的结构未知,可以通过蛋白质比对、结构预测等方法获取其三维结构。
(3) 配体库的筛选根据疾病相关的生物通路和目标蛋白的特异性,从配体库中选出潜在的配体候选物。
(4) 对接模拟通过使用分子对接软件,将配体与靶标进行模拟,预测它们之间的最佳结合模式。
这通常涉及到搜索和评分两个主要的步骤。
(5) 结果分析根据对接模拟的结果,评估配体与靶标之间的相互作用力,并从中选择具有潜在生物活性的化合物。
4. 分子对接的应用分子对接在药物设计、蛋白质研究等领域中具有广泛的应用。
(1) 药物设计分子对接可以帮助药物设计师预测和优化化合物与靶标的结合模式,从而提高药物的活性和选择性,并减少不必要的实验。
这有助于加速药物研发的过程。
(2) 蛋白质研究分子对接可以用于研究蛋白质和其他生物大分子之间的相互作用,从而揭示其功能和机制。
这对于理解生物过程以及疾病的发生和发展非常重要。
(3) 农药设计分子对接可以应用于农药设计,通过预测农药与害虫靶标之间的结合模式,设计新的、高效的农药,以提高农作物的产量和质量。
(4) 材料科学分子对接还可以用于材料科学领域,通过预测分子在材料表面的结合模式,优化材料的性能,如吸附性、催化活性等。
5. 结论分子对接作为一种重要的计算化学方法,在药物设计、蛋白质研究等领域中有广泛的应用。
它通过模拟分子之间的相互作用,帮助研究者预测和优化化合物与靶标之间的结合模式,并加速药物研发和生物研究的过程。
分子对接的原理及应用

分子对接的原理及应用1. 原理分子对接是一种计算方法,用于研究分子之间的相互作用。
它可以预测两个分子结合的方式和结合能,从而为药物设计和生物化学研究提供重要信息。
分子对接的原理基于两个基本假设: 1. 分子之间的相互作用主要由非共价相互作用决定,包括范德华力、静电力和氢键等; 2. 分子可以在三维空间中灵活地运动,通过优化分子的构象来优化其相互作用能。
基于以上假设,分子对接通过以下步骤来模拟、预测两个分子的结合方式和结合能: 1. 确定基于分子结构的候选配体和靶标蛋白; 2. 预处理分子结构,包括对其进行能量最小化和构象搜索等; 3. 定义搜索空间,即确定配体在靶标蛋白中的结合位置和方向; 4. 利用评分函数对配体和靶标蛋白的相互作用进行评价; 5. 通过搜索算法搜索最佳的结合模式,即找到能够最大化相互作用能的配体结合方式;6. 评估和筛选结合模式,选择能够最有可能实际发生结合的结构。
2. 应用2.1 药物设计分子对接在药物设计中发挥重要作用。
通过预测药物候选分子与靶标蛋白的结合方式和结合能,可以筛选出具有较好活性和选择性的药物分子。
分子对接还可以辅助药物优化,即在已有的药物分子基础上进行结构修饰,以改善其结合能和药物性质。
2.2 酶底物和酶抑制剂研究分子对接在酶底物和酶抑制剂研究中也具有广泛应用。
通过预测底物与酶的结合方式,可以揭示底物转化的机制和参数。
同时,分子对接还可以帮助研究开发酶抑制剂,通过模拟药物小分子与酶的相互作用,设计出具有较高抑制活性和选择性的分子。
2.3 蛋白质-蛋白质相互作用研究除了药物设计和酶底物研究,分子对接还被广泛应用于研究蛋白质-蛋白质相互作用。
蛋白质-蛋白质相互作用是生物学中的重要研究课题,分子对接可以帮助预测蛋白质复合物的结构和稳定性,从而揭示其功能和调控机制。
2.4 杂质分子和代谢物筛选分子对接还可以用于杂质分子和代谢物的筛选。
在药物研发中,杂质和代谢物的筛选对于药物的合成和生物利用度评估至关重要。
分子对接——精选推荐

分⼦对接AutoDock和AutoDock Tools 使⽤教程⼀、分⼦对接简介及软件介绍1.分⼦对接理论基础所谓分⼦对接就是两个或多个分⼦之间通过⼏何匹配和能量匹配⽽相互识别的过程。
分⼦对接在酶学研究以及药物设计中具有⼗分重要的意义。
在酶激活剂、酶抑制剂与酶相互作⽤以及药物分⼦产⽣药理反应的过程中,⼩分⼦(通常意义上的Ligand)与靶酶(通常意义上的Receptor)相互互结合,⾸先就需要两个分⼦充分接近,采取合适的取向,使两者在必要的部位相互契合,发⽣相互作⽤,继⽽通过适当的构象调整,得到⼀个稳定的复合物构象。
通过分⼦对接确定复合物中两个分⼦正确的相对位置和取向,研究两个分⼦的构象,特别是底物构象在形成复合物过程中的变化,是确定酶激活剂、抑制剂作⽤机制以及药物作⽤机制,设计新药的基础。
分⼦对接计算是把配体分⼦放在受体活性位点的位置,然后按照⼏何互补、能量互补化学环境互补的原则来实时评价配体与受体相互作⽤的好坏,并找到两个分⼦之间最佳的结合模式。
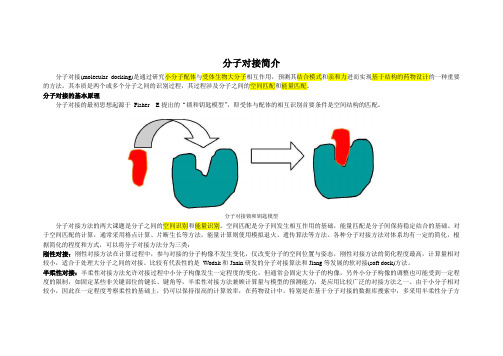
分⼦对接最初思想起源于Fisher E.的“锁和钥匙模型”(图),认为“锁”和“钥匙”的相识别的⾸要条件是他们在空间形状上要互相匹配。
然⽽,配体和受体分⼦之间的识别要⽐“锁和钥匙”模型复杂的多。
⾸先,配体和受体分⼦的构象是变化的,⽽不是刚性的,配体和受体在对接过程中互相适应对⽅,从⽽达到更完美的匹配。
其次,分⼦对接不但要满⾜空间形状的匹配,还要满⾜能量的匹配。
配体和受体之间的通过底物分⼦与靶酶分⼦能否结合以及结合的强度最终是由形成此复合物过程的结合⾃由能变化ΔG bind所决定的。
互补性(complementarity)和预组坦织(pre-organization)是决定分⼦对接过程的两个重要原则,前者决定识别过程的选择性,⽽后者决定识别过理的结合能⼒。
互补性包括空间结构的互补性和电学性质的互补性。
1958年Koshland提出了分⼦识别过程中的诱导契合(induced fit)概念,指出配体与受体相互结合时,受体将采取⼀个能同底物达到最佳结合的构象(图1)。
分子对接简要介绍
分子对接简介分子对接(molecular docking)是通过研究小分子配体与受体生物大分子相互作用,预测其结合模式和亲和力进而实现基于结构的药物设计的一种重要的方法。
其本质是两个或多个分子之间的识别过程,其过程涉及分子之间的空间匹配和能量匹配。
分子对接的基本原理分子对接的最初思想起源于Fisher E提出的“锁和钥匙模型”,即受体与配体的相互识别首要条件是空间结构的匹配。
分子对接锁和钥匙模型分子对接方法的两大课题是分子之间的空间识别和能量识别。
空间匹配是分子间发生相互作用的基础,能量匹配是分子间保持稳定结合的基础。
对于空间匹配的计算,通常采用格点计算、片断生长等方法,能量计算则使用模拟退火、遗传算法等方法。
各种分子对接方法对体系均有一定的简化,根据简化的程度和方式,可以将分子对接方法分为三类:刚性对接:刚性对接方法在计算过程中,参与对接的分子构像不发生变化,仅改变分子的空间位置与姿态,刚性对接方法的简化程度最高,计算量相对较小,适合于处理大分子之间的对接。
比较有代表性的是Wodak和Janin研发的分子对接算法和Jiang等发展的软对接(soft dock)方法。
半柔性对接:半柔性对接方法允许对接过程中小分子构像发生一定程度的变化,但通常会固定大分子的构像,另外小分子构像的调整也可能受到一定程度的限制,如固定某些非关键部位的键长、键角等,半柔性对接方法兼顾计算量与模型的预测能力,是应用比较广泛的对接方法之一。
由于小分子相对较小,因此在一定程度考察柔性的基础上,仍可以保持很高的计算效率,在药物设计中,特别是在基于分子对接的数据库搜索中,多采用半柔性分子方法。
其代表性软件是DOCK和AutoDock。
柔性对接:柔性对接方法在对接过程中允许研究体系的构像发生自由变化,由于变量随着体系的原子数呈几何级数增长,因此柔性对接方法的计算量非常大,消耗计算机时很多,适合精确考察分子间识别情况。
其中比较有代表性的方法有Accelrys 公司发展的基于分子力学和分子动力学的分子对接方法及Affinity 软件。
分子对接 分子动力学模拟

分子对接分子动力学模拟分子对接是一种研究分子间相互作用的方法,它可以帮助科学家了解分子之间的结合机制、预测分子的活性以及设计新的药物分子。
分子对接通常与分子动力学模拟相结合,以模拟和预测分子在生物体内的运动和相互作用。
分子对接是一种计算方法,它通过计算分子间的相互作用能量来预测分子结合的可能性。
在分子对接过程中,首先需要确定配体和靶标蛋白的结构。
配体是指要与靶标蛋白结合的小分子,而靶标蛋白则是要研究的蛋白质分子。
然后,使用分子对接软件将配体与靶标蛋白进行对接,模拟它们之间的相互作用。
分子对接的过程可以分为几个步骤。
首先,需要准备配体和靶标蛋白的结构文件。
这些结构文件可以通过实验方法(例如X射线晶体学)或计算方法(例如分子模拟)获得。
然后,使用分子对接软件将配体和靶标蛋白进行对接。
在对接过程中,软件会尝试不同的配位构象,并计算每个构象的相互作用能量。
最后,根据相互作用能量,可以评估每个构象的结合能力,并选择最有可能与靶标蛋白结合的构象。
分子对接的结果可以帮助科学家了解分子之间的相互作用机制。
例如,可以通过分析配体与靶标蛋白结合的构象,揭示它们之间的结合模式和关键残基。
这些信息对于设计新的药物分子非常重要。
另外,分子对接还可以预测分子的活性。
通过计算配体与靶标蛋白结合的自由能,可以评估配体的亲和力和选择性,从而预测其在生物体内的活性。
这对于药物设计和优化非常有价值。
分子动力学模拟是一种模拟和预测分子在时间尺度上的运动和相互作用的方法。
分子动力学模拟基于牛顿运动定律,通过数值积分求解分子的运动方程,模拟分子在一定时间内的运动轨迹。
在分子动力学模拟中,分子被看作是由原子组成的粒子系统,每个原子都受到其他原子的引力和排斥力的作用。
分子动力学模拟可以用于研究分子在溶液中的扩散、蛋白质的折叠、酶催化反应等过程。
通过模拟分子的运动,可以揭示分子的结构、动力学和功能。
例如,可以通过分子动力学模拟研究蛋白质的构象变化,了解其在不同条件下的稳定性和活性。
分子对接的作用

分子对接的作用分子对接是一种分子间相互作用的过程,可以发生在蛋白质与蛋白质、蛋白质与小分子药物之间。
在药物研发领域,分子对接技术被广泛应用于发现新药物、设计新药物、优化药物活性等方面。
本文将从分子对接的定义、原理、应用以及未来发展方向等方面进行探讨。
分子对接是指两个分子之间通过非共价相互作用形成稳定的复合物结构的过程。
在生物领域中,分子对接主要用于研究蛋白质与蛋白质、蛋白质与小分子药物之间的相互作用。
通过模拟计算,可以预测分子之间的相互作用方式,从而为药物设计和疾病治疗提供重要参考。
分子对接的原理是基于分子之间相互作用的物理化学性质。
通常包括静电作用、范德华力、氢键、疏水作用等多种相互作用力。
在进行分子对接计算时,需要考虑这些相互作用力的贡献,并通过计算得出最合适的分子结合方式。
在药物研发中,分子对接技术被广泛应用于药物筛选、药效优化、靶点预测等方面。
通过对药物分子与靶点蛋白质的对接模拟,可以快速筛选出具有潜在生物活性的化合物,从而加快新药物的发现过程。
同时,对药物分子与蛋白质结合位点的研究,可以指导药物结构的优化,提高药物的生物活性和选择性。
未来,随着计算机技术的不断发展和计算能力的提高,分子对接技术将更加广泛地应用于药物设计和生物研究领域。
同时,结合人工智能和大数据技术,可以更精确地预测分子之间的相互作用,为新药物的研发提供更有力的支持。
总的来说,分子对接作为一种重要的计算化学方法,对药物研发和生物研究具有重要意义。
通过模拟分子之间的相互作用,可以加快药物研发过程,提高新药物的研发成功率。
随着技术的不断进步,分子对接技术将在未来发挥更加重要的作用,为人类健康和生命科学研究带来更多的机遇和挑战。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子对接简介
分子对接(molecular docking)是通过研究小分子配体与受体生物大分子相互作用,预测其结合模式和亲和力进而实现基于结构的药物设计的一种重要的方法。
其本质是两个或多个分子之间的识别过程,其过程涉及分子之间的空间匹配和能量匹配。
分子对接的基本原理
分子对接的最初思想起源于Fisher E提出的“锁和钥匙模型”,即受体与配体的相互识别首要条件是空间结构的匹配。
分子对接锁和钥匙模型
分子对接方法的两大课题是分子之间的空间识别和能量识别。
空间匹配是分子间发生相互作用的基础,能量匹配是分子间保持稳定结合的基础。
对于空间匹配的计算,通常采用格点计算、片断生长等方法,能量计算则使用模拟退火、遗传算法等方法。
各种分子对接方法对体系均有一定的简化,根据简化的程度和方式,可以将分子对接方法分为三类:
刚性对接:刚性对接方法在计算过程中,参与对接的分子构像不发生变化,仅改变分子的空间位置与姿态,刚性对接方法的简化程度最高,计算量相对较小,适合于处理大分子之间的对接。
比较有代表性的是Wodak和Janin研发的分子对接算法和Jiang等发展的软对接(soft dock)方法。
半柔性对接:半柔性对接方法允许对接过程中小分子构像发生一定程度的变化,但通常会固定大分子的构像,另外小分子构像的调整也可能受到一定程度的限制,如固定某些非关键部位的键长、键角等,半柔性对接方法兼顾计算量与模型的预测能力,是应用比较广泛的对接方法之一。
由于小分子相对较小,因此在一定程度考察柔性的基础上,仍可以保持很高的计算效率,在药物设计中,特别是在基于分子对接的数据库搜索中,多采用半柔性分子方
法。
其代表性软件是DOCK和AutoDock。
柔性对接:柔性对接方法在对接过程中允许研究体系的构像发生自由变化,由于变量随着体系的原子数呈几何级数增长,因此柔性对接方法的计算量非常大,消耗计算机时很多,适合精确考察分子间识别情况。
其中比较有代表性的方法有Accelrys 公司发展的基于分子力学和分子动力学的分子对接方法及Affinity 软件。
打分函数:
现有打分函数有要有三种:
基于分子力场的打分函数:该方法只考虑只考虑热焓对能量的贡献,不考虑熵的影响,一般情况下,采用标准力场的非键作用能如真空静电和范德华作用能用作打分函数。
基于经验的回归参数的打分函数:用多元回归的方法拟合各种物理参数对结合自由能的贡献。
如FlexX 程序中采用这种函数,所采用的方程包括配体旋转键的个数!氢键、离子键、疏水和芳香环的堆积作用,以及亲水作用"这种方法能快速直接地估算结合自由能。
基于知识的打分函数:最初应用于蛋白质结构预测,打分函数用统计力学的方法来自蛋白质-配体的复合物结构,结合自由能用函数为分子间距离的平均能的加和来计算"基于知识的打分函数是一种比较有前途的方法。
各种常用分子对接软件对比
名称优化方法评价函数速度准确度优点缺点使用方式
AutoDock Lamarckian genetic algorithm
Monte Carlo simulated annealing
Traditional genetic algorithm 半经验自由能评价函数一般good accuracy -- -- 免费获取
license
GOLD genetic search algorithm 半经验自由能评价函数快good accuracy -- -- 2个月试
用
FlexX fragment-based 半经验自由能评价函数快-- 比AutoDock 、
GOLD快不适用于
柔性配基
6周的试
用版
ICM global minimum of the energy 半经验自由能评价函数快This program provided the
highest accuracy in ligand
docking against AutoDock,
DOCK, FlexX, and GOLD
in a study involving 37 虚拟筛选能力比DOCK、FlexX 优越
receptors.
DOCK 片断生长分子力场、表面匹配得分、
化学环境匹配得分快低shown to handle
well small
binding
sites, opened
cavities and
small
hydrophobic
ligands
不适用于
柔性配
基、极性
配基
Glide 系统搜寻半经验自由能评价函数快高-- -- --。
