高中化学常用干燥剂的性能和用途
高中化学干燥剂总结

高中化学干燥剂总结化学干燥剂是一种可以吸收周围环境中水分的物质,常用于实验室中保持实验器皿和试剂的干燥状态。
在化学实验中,干燥剂的选择和正确使用对实验结果具有重要影响。
本文将对高中化学中常用的干燥剂进行总结,以便同学们在实验中正确选择和使用干燥剂。
首先,我们来谈谈最常见的干燥剂——硅胶。
硅胶是一种无机干燥剂,具有较强的吸湿能力。
它的外表呈现出颗粒状,通常是白色或者呈透明状态。
硅胶可以通过吸附水分来保持实验器皿和试剂的干燥状态,常用于保存化学试剂和实验器皿。
在实验室中,同学们可以使用硅胶干燥瓶来保持实验器皿的干燥状态,以确保实验结果的准确性。
除了硅胶,还有一种常用的干燥剂是无水氯化钙。
无水氯化钙是一种无机盐,具有很强的吸湿能力。
它常常以粉末的形式存在,可以迅速吸收周围环境中的水分。
在化学实验中,我们可以将试剂或者实验器皿放入装有无水氯化钙的干燥瓶中,以保持其干燥状态。
需要注意的是,无水氯化钙在吸湿后会生成氢氧化钙,因此在使用过程中要小心避免接触皮肤和呼吸其粉尘。
此外,还有一种常用的干燥剂是磷酸钙。
磷酸钙是一种无机盐,具有一定的吸湿能力。
它常用于实验室中吸附试剂中的水分,以保持试剂的干燥状态。
在使用磷酸钙时,同学们需要注意避免与酸类试剂混合,以免发生化学反应。
除了上述几种常见的干燥剂外,还有一些其他的干燥剂,如氧化钙、氧化铜等,它们在化学实验中也有着吸湿干燥的作用。
在选择和使用干燥剂时,同学们需要根据实际情况和实验要求来进行选择,并严格按照操作规程来正确使用干燥剂,以确保实验的顺利进行。
总的来说,化学干燥剂在化学实验中起着重要的作用,正确选择和使用干燥剂对实验结果具有重要影响。
同学们在实验中要根据实际情况选择合适的干燥剂,并严格按照操作规程来正确使用干燥剂,以确保实验结果的准确性和可靠性。
希望本文对同学们在化学实验中的干燥剂选择和使用提供一些帮助。
高中常用干燥剂及其适用范围

高中常用干燥剂及其适用范围高中常用干燥剂及其适用范围干燥剂是一种能够吸收空气中的水分的物质,常用于保护物品免受潮湿和腐蚀。
在高中化学实验中,干燥剂也是必不可少的实验用品。
下面介绍几种常用的干燥剂及其适用范围。
1. 硅胶干燥剂硅胶干燥剂是一种无毒、无味、无污染的干燥剂,具有良好的吸湿性能。
它通常呈现为白色或淡黄色的颗粒状物质,可以在空气中吸收水分,使其变成透明或淡蓝色。
硅胶干燥剂适用于各种物品的干燥,如衣物、鞋子、书籍、电子产品等。
2. 氯化钙干燥剂氯化钙干燥剂是一种常用的干燥剂,具有很强的吸湿性能。
它通常呈现为白色或淡黄色的颗粒状物质,可以在空气中吸收水分,使其变成水。
氯化钙干燥剂适用于各种物品的干燥,如衣物、鞋子、书籍、电子产品等。
3. 活性炭干燥剂活性炭干燥剂是一种具有良好吸附性能的干燥剂,可以吸附空气中的水分和有害气体。
它通常呈现为黑色或深灰色的颗粒状物质,可以在空气中吸收水分和有害气体,使其变得更加清新。
活性炭干燥剂适用于各种物品的干燥和除臭,如衣物、鞋子、书籍、电子产品等。
4. 碳酸钙干燥剂碳酸钙干燥剂是一种无毒、无味、无污染的干燥剂,具有良好的吸湿性能。
它通常呈现为白色或淡黄色的颗粒状物质,可以在空气中吸收水分,使其变成透明或淡蓝色。
碳酸钙干燥剂适用于各种物品的干燥,如衣物、鞋子、书籍、电子产品等。
总之,干燥剂是一种非常实用的物品,可以保护物品免受潮湿和腐蚀。
在高中化学实验中,干燥剂也是必不可少的实验用品。
以上介绍的几种干燥剂都具有良好的吸湿性能,适用于各种物品的干燥和除臭。
在使用干燥剂时,需要注意选择适合的干燥剂,并按照说明书的要求使用,以达到最佳的干燥效果。
高中化学常见无机干燥剂

高中化学常见无机干燥剂为了保持药品的干燥或对制得的气体进行干燥,必须使用干燥剂。
常用的干燥剂有三类:一类为酸性干燥剂,有浓硫酸、五氧化二磷、硅胶等;第二类为碱性干燥剂,有固体烧碱、石灰和碱石灰(类似于氢氧化钠和氧化钙的混合物)等;第三类是中性干燥剂,如无水氯化钙、无水硫酸镁等。
常用干燥剂的性能和用途如下:1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
常用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、O2、N2等6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。
O2。
CO2。
CO、N2。
Cl2、HCl、H2S、NH3、CH4等。
人教版高一年级化学必修1干燥剂归纳整理

高中化学常见干燥剂归纳整理1.高中化学常见的干燥剂有哪些浓硫酸、五氧化二磷石灰和碱石灰(氢氧化钠和氧化钙的混合物)、无水氯化钙、无水硫酸铜、也具有一定的干燥性,并且吸水后变成蓝色的五水硫酸铜(CuSO4〃5H2O),但一般不用来做干燥剂。
2.分类及使用常用的干燥剂有三类第一类为酸性干燥剂。
有浓硫酸、五氧化二磷、等;第二类为碱性干燥剂,石灰和碱石灰(氢氧化钠和氧化钙的混合物)等;第三类是中性干燥剂,如无水氯化钙等。
常用干燥剂的性能和用途如下:1.浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2.无水氯化钙:一般用以填充干燥器和干燥塔4.碱石灰:常用来干燥氢气、氧气和甲烷等气体。
3.干燥剂的选择序号(No.)气体名称适用干燥剂1 H2P2O5,CaCl2,H2SO4(浓)2 O2H2SO4(浓),P2O5CaCl23 N2P2O5,CaCl2,H2SO4(浓)4 O3P2O5,CaCl25 Cl2CaCl2,H2SO4(浓)6 CO P2O5,CaCl2,H2SO4(浓)7 CO2P2O5,CaCl2,H2SO4(浓)8 SO2浓H2SO4、CaCl2,P2O59 CH4P2O5,CaCl2,H2SO4(浓10 NH3碱石灰,11 HCl CaCl2,H2SO4(浓) 、P2O512 HBr CaBr2、ZnBr213 HI CaI214 H2S CaCl215 C2H4P2O516 C2H2P2O5,NaOHPS:碱石灰为CaO、NaOH、H2O。
一般的说,酸性干燥剂不能干燥碱性气体,可以干燥酸性气体及中性气体;碱性干燥剂不能干燥酸性气体,可以干燥碱性气体及中性气体;中性干燥剂可以干燥各种气体。
如气体与干燥剂之间若发生了氧化还原反应,或生成络合物,加合物等,就不能用这种干燥剂来干燥该气体了。
各种常用干燥剂的性能和用途介绍.doc

各种常用干燥剂的性能和用途介绍1、浓H2SO4具有强烈的吸水性,常用来除去不与H2S0衣应的气体中的水分。
例如常作为H2、02 CO S02 N2、HCI、CH4 C02 CI2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2Q吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
党用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3 02、N2等6活性氧化铝(AI203):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30C以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。
02。
C02。
C0、N2。
CI2、HCI、H2S NH3、CH4等由上述可知、对一些气体的干燥剂可作如下选择。
气体名称常用干燥剂气体名称常用干燥剂CO 浓H2SO4 CaCI2、P2O5 H2S CaCI2C02 CaCI2、浓H2SO4 P2O5 N2 浓H2SO4 C aCI2、P2O5CI2 CaCI2、浓H2SO4 NH3 CaO KOH或碱石灰H2 CaCI2、P2O5 NO Ca(NO3)2HBr CaBr2、ZnBr2、03 CaCI2HCI CaCI2、浓H2SO4 S02浓H2SO4 CaCI2、P2O5Cal2HI液体适用干燥剂Applicable Con diti on of Drying Age nts常用干燥剂注:使用高氯酸盐时务必小心,碳、硫、磷及一切有机物都不能与之接触,否则会发生猛烈爆炸,造成危险。
高中化学常见干燥剂归纳整理39563知识分享

高中化学常见干燥剂归纳整理1.高中化学常见的干燥剂有哪些浓硫酸、五氧化二磷固体烧碱、石灰和碱石灰(氢氧化钠和氧化钙的混合物)无水氯化钙、无水硫酸镁无水硫酸铜2.分类及使用常用的干燥剂有三类第一类为酸性干燥剂。
有浓硫酸、五氧化二磷、硅胶等;第二类为碱性干燥剂,有固体烧碱、石灰和碱石灰(氢氧化钠和氧化钙的混合物)等;第三类是中性干燥剂,如无水氯化钙、无水硫酸镁等。
常用干燥剂的性能和用途如下:1.浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2.无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3.无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4·7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4.固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
常用来干燥氢气、氧气和甲烷等气体。
5.变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、O2、N2等。
6.活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7.无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8.硫酸钙:可以干燥H2、O2、CO2、CO 、N2、Cl2、HCl 、H2S、NH3、CH4等。
注:无水硫酸铜(CuSO4)(无水硫酸铜成白色)也具有一定的干燥性,并且吸水后变成蓝色的五水硫酸铜(CuSO4·5H2O),但一般不用来做干燥剂。
3.干燥剂的选择由上述可知、对一些气体的干燥剂可作如下选择。
一般的说,酸性干燥剂不能干燥碱性气体,可以干燥酸性气体及中性气体;碱性干燥剂不能干燥酸性气体,可以干燥碱性气体及中性气体;中性干燥剂可以干燥各种气体。
高中化学干燥剂总结资料

高中化学干燥剂总结资料
干燥剂的作用
干燥剂是有机物质或无机物质的一种物质,它可以使大气中的水分消失或减少,这样
就能够避免由于水分的存在而造成的反应产物的破坏,从而促使试剂反应成功。
分类
1、有机干燥剂:主要有有机醇、有机酸、硫酸盐、卤系物等。
特性
1、分解温度:一般无机干燥剂的分解温度要比有机干燥剂高。
2、质量改变:无机干燥剂在温度变化时质量会变化,而有机干燥剂不会变化。
3、危害:无机干燥剂耐热性和形成的气体有害,但其毒性不大;有机干燥剂不可应
用在高温的情况下,并可能产生有毒的气体。
4、滞销:无机干燥剂的滞销期较短,主要是由于它在空气中被水蒸气吸收;有机干
燥剂的滞销期比较长,不受水的影响。
5、选择:想要除去空气中的水分时应选择无机干燥剂,而有机干燥剂适用于有机溶
液中除去水分。
应用
1、精细有机化工:有机干燥剂常用于有机溶液中,以避免因水变异造成的反应产物
的破坏。
2、化学试验室:有机干燥剂常用于无机反应中,以避免反应因气体的污染而失败等。
3、实验室分析:无机干燥剂常用于实验室分析,既可以用来蒸馏,又可以用来纯化
溶液。
选用
1、应充分考虑干燥剂的分解温度、滞销期和水分。
2、必要时应选择分子量较小的有机干燥剂,以免反应物不被覆盖而发生反应。
3、当试剂中有以水解形成酸类或碱类的有机物质时,应选用无机干燥剂。
4、一般实验室中有机物质的干燥应选用苯酚或乙醇酸,无机物质的干燥应采用硝酸盐、硫酸盐等。
5、如果需要大量的反应产物,应选用无机干燥剂,因为它适用于高温反应,而有机干燥剂对温度要求比较严格。
常用干燥剂的性能及应用范围
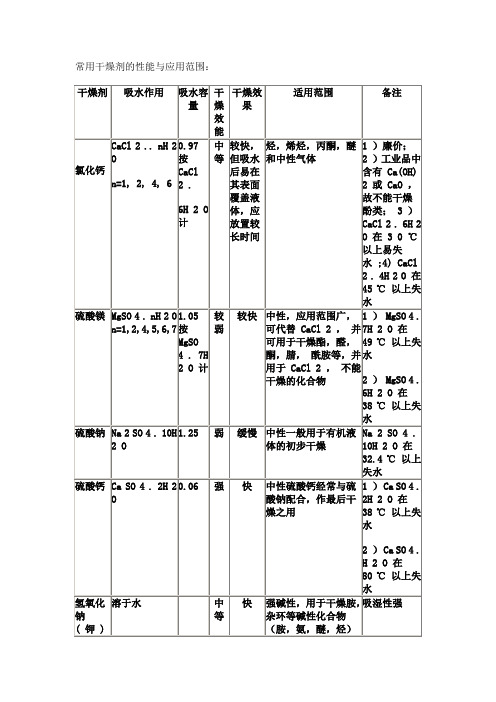
MgSO 4 . nH 2 O n=1,2,4,5,6,7
1.05按MgSO 4 . 7H 2 O计
较弱
较快
中性,应用范围广,可代替CaCl 2,并可用于干燥酯,醛,酮,腈,酰胺等,并用于CaCl 2,不能干燥的化合物
1)MgSO 4 . 7H 2 O在49℃以上失水
2)MgSO 4 . 6H 2 O在38℃以上失水
2较弱慢弱碱性用于干燥醇酮酯胺杂环等碱性化合物可代替koh干燥胺类可用于酸酚快限于干燥醚烃叔胺中痕量水分有吸湿性金属钠nah2o12h2naohcaoh2o强忌水氧化钙碱石灰bao类caoh2强较快中性及碱性气体胺醇乙醚对热很稳定不挥发干燥后可直接蒸馏吸湿性很强用于干燥气体时需与载体相混五氧化二磷p2o53h2o2h3po4强快但吸水后表面被粘浆覆盖操作不便适于干燥烃卤代烃腈等中的痕量水分
硫酸钠
Na 2 SO 4 . 10H 2 O
1.25
弱
缓慢
中性一般用于有机液体的初步干燥
Na 2 SO 4 . 10H 2 O在32.4℃以上失水
硫酸钙
Ca SO 4 . 2H 2 O
0.06
强
快
中性硫酸钙经常与硫酸钠配合,作最后干燥之用
1)Ca SO 4 . 2H 2 O在38℃以上失水
2)Ca SO 4 . H 2 O在80℃以上失水
氢氧化钠(钾)
溶于水
中等
快
强碱性,用于干燥胺,杂环等碱性化合物(胺,氨,醚,烃)
吸湿性强
碳酸钾
K 2 CO 3 . 1/2 H 2 O
0.2
较弱
慢
弱碱性,用于干燥醇,酮,酯,胺,杂环等碱性化合物,可代替KOH干燥胺类,可用于酸,酚
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学常用干燥剂的性能和用途:
1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H
2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:干燥能力强,干燥速度快,能再生,脱水温度200度。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能干燥酸性物质。
常用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、O2、N2等
6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K 烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。
O2。
CO2。
CO 、N2。
Cl2、HCl 、H2S、 NH3、CH4等。
