国家药品标准与《中国药典》2010版
2010版中国药典知识
2010版中国药典学习资料1.2010年版中国药典概况•凡例、正文、附录、标准物质(对照品、对照药材、对照提取物、标准品)组成完整的药品标准。
•了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对照品;对照药材、对照品提取物、标准品;计量;精密度;试药、试剂、指示剂;动物实验;说明书、包装、标签等。
一、二、三部内容略有不同。
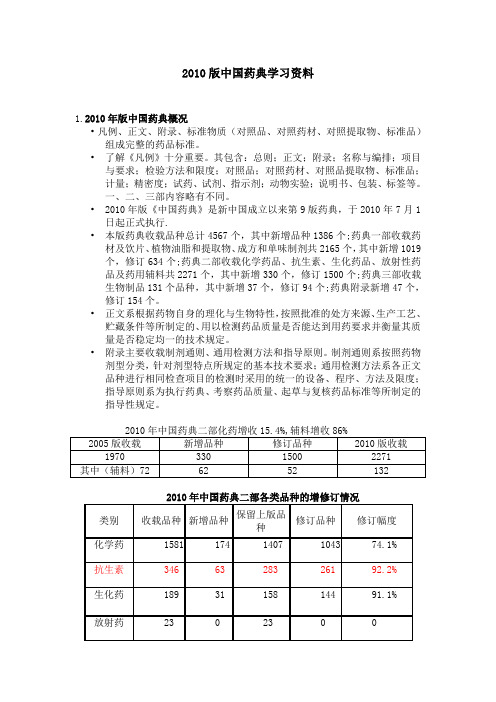
•2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.•本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
•正文系根据药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳定均一的技术规定。
•附录主要收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采用的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情况•新版药典凡例进行了重大修订:•1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,并且做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也基本一致。
•2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品管理法》组织制定和颁布实施”。
中国药典部分

2010版中国药典2010版中国药典二部word版电子书凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》二部。
二、国家药品标准由凡例与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
2010版中国药典word版pdf版exe版五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。
正文八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。
关于实施《中国药典》2010年版有关事宜的公告

国家食品药品监督管理局公告2010年第43号关于实施《中国药典》2010年版有关事宜的公告《中华人民共和国药典》2010年版(以下简称中国药典)已由卫生部2010年第5号公告颁布,自2010年10月1日起执行。
现就实施中国药典的有关事宜公告如下:一、中国药典包括凡例、正文及附录,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
所有国家药品标准应当符合中国药典凡例及附录的相关要求。
二、凡中国药典收载的品种,自执行之日起,原收载于历版药典、卫生部颁布药品标准、国家食品药品监督管理局颁布新药转正标准和地方标准上升国家标准的同品种药品标准同时废止。
药品注册标准不符合中国药典有关要求的,药品生产企业应按《药品注册管理办法》的有关规定提出补充申请。
对于药品注册标准中收载的检验项目多于中国药典规定的或质量指标高于中国药典要求的,在执行中国药典的基础上,应同时执行原标准的相应项目和指标。
中国药典品种项下未收载的制剂规格,其质量标准按中国药典同品种相关要求执行,规格项按原批准证明文件执行。
三、药品生产企业应根据中国药典的增修订内容,按照我局相关规定及程序变更药品说明书和标签。
2010年10月1日起生产的药品必须使用变更后的说明书和标签。
对于通用名称已作修订的药品,其原名称可作为曾用名过渡使用。
四、中国药典所收载的相同品种,如含有中国药典规定以外的杂质,应当增加杂质控制项目。
五、中国药典关于眼用制剂无菌要求的具体执行时间将根据《药品生产质量管理规范》实施的要求另行规定。
六、药品生产企业应积极做好执行中国药典有关准备工作,对在中国药典执行中发现的问题应及时报所在地省级食品药品监督管理局。
同时应不断加强质量标准研究,提高药品质量控制水平。
七、各级地方食品药品监督管理部门应配合做好中国药典的宣贯工作,加强中国药典执行中的监督与指导,及时收集和反馈相关问题和意见。
八、国家药典委员会负责中国药典执行中的具体指导等有关工作。
中国药典及国家药品标准

• 第十一条 生产药品所需的原料、
辅料,必须符合药用要求(注 意原料与原料药的区别;药用 要求的重要指标之一即国家药 品标准)
Drug Administrative Law in China 《药品管理法》的有关条款
• Article 31 Production of a new drug or generics shall be subject to approval (by SFDA), and a drug approval number shall be issued for it (SFDA issue a approval number to drug substances). • Article 32 Drugs shall meet the National Drug Standards(ChP,MOH&SFDA Sta) • 第三十一条 生产新药或者已有 国家标准的药品的,须经国务 院药品监督管理部门批准并发 给药品批准文号(我国对原料 药实行批准文号管理) • 第三十二条 药品必须符合国家 药品标准(药典,部/局颁)
Chairman of ChP Commission
Shao Mingli Director General of SFDA
Vice Chairman Ma Xiaowei Wu Zhen Yu Wenming Chen Xinnian Vice Minister of Ministry of Health Deputy Director General of SFDA Deputy Director General of STCMA Vice Minister of Ministry of PLA
1950s2002?中国药典委员会成立于1950年?先后出版195319631977198519901995200020052010?中国药典以外尚有国家标准约7000个品种部局颁标准?19502002期间还曾存在省标technicalguidelinesforchinesepharmacopoeia中国药典标准技术指南?nomenclatureprinciple?guidelinesforanalyticalmethodapplication?detailedrulesfordraftingdrugstandards?药品命名原则?药品分析方法应用原则?药品标准编写细则seriesworktochinesepharmacopoeia中国药典系列丛书?chineseapproveddrugnamestheatlasofirspectraclinicalguidetothechpthecoloratlasoftraditionalchinesecrudedrugtheatlasoftlcidentificationfortcmmanualofdrugstandardizationdrugstandardsofchinajournalchp2010englishedition????????中国药品通用名称?药品红外光谱集?临床用药须知?药材彩色图集?中药薄层色谱图集?药品标准工作手册?中国药品标准杂志?中国药典英文版chinesepharmacopoeia2010nationalstandards中国药典2010及国家药品标准?一2010版品种monographs?二2010版附录generalchaptersmethods?三2010版辅料excipients?四2010版凡例generalnoticechinesepharmacopoeia2010monographs中国药典2010版品种?chinesepharmacopoeia2010compile4567monographsdivided3volumes
中国药典2010年版中药

原子 TLC-S 滴定 吸收
38 33 1 2 38 53
2010年版 1265
(三)增订剂型品种
新增 露剂品种:金银花露 涂膜剂品种:疏痛安涂膜剂
增修订内容与特点
(一)收载品种数量大幅度增加
2005版收载中成药564种 2010版收载中成药1063种
(一)收载品种数量大幅度增加
2010版药典标准起草技术要求及编写细则 《中国药典》中药质量标准研究技术要求 《中国药典》中药质量标准复核技术要求 《中国药典》中药质量标准起草说明编写 细则 《中国药典》中药质量标准起草与复核工 作规范 《中国药典》中药质量标准正文各论编写 细则
药典编排格式
凡例 正文 附录
2010版药典标准正文内容—药材和饮片
(一)增修订品种
中药材及饮片
种类
药材 饮片
2005版 530 746
2010版 592 809
增幅(%) 12 8
收载标准数量
2005版 530 70 2010版 592 809
种类
药材
增幅(%) 12 1056
饮片
中成药增修订品种
2010年版收载总数: 1063
2010年版新增品种数:499
(三)专项研究课题 (1)含朱砂、雄黄中成药中游离砷、 汞检测方法研究; (2)农药多残留检测方法研究; (3)黄曲霉毒素检测研究; (4)重金属及有害元素研究; (5)生物活性测定法研究。
2010年版药典一部立项情况
不上的原则: (1)品种增加的越多越好,但不降低要求、不破 规矩,质量标准达不到要求的品种不上; (2)含保护动、植物的不上; (3)含龙骨的不上; (4)含人中白、紫河车、五灵脂的不上; (5)含鲜活动物的不上。 (6)处方药材基源不清楚或基础工作薄弱的品种 原则上不收载。
2010版中国药典

1019
634
2165
1146
《中国药典》发展与展望
2010版药药典二部化药增收15.4%,辅料增收86%
2005版收载 1970
新增品种 修订品种 2010版收载
330
1500
2271
其中(辅料) 72
62
52
132
《中国药典》发展与展望
2010版药药典三部(生物制品)增收29.7%
类别
收载总数
140
新增 14 15 18
修订
2010版 收载
47
112
69
152
39
149
《中国药典》发展与展望
中国药典2010版概况
管理创新 强化系统性、规范性、基础性工作
标准验证和复核;一般检查项目的增补和完善;中药材拉丁名词序 变更;规范功能与主治等。
注重体现中药 特色,表达中药特点
重视中药材与中药材饮片标准,注重质量控制的专属性,一测多 评技术,多指标成分定量;特征和指纹图谱技术的应用。
2010版中国药典概述来自010版中国药典一、 《中国药典》发展与展望 二、 《中国药典》2010年版通用检测方法和指导原则 三、 2010年版中国药典凡例附录简介 四、 《中国药典》 2010年版一部增修订情况简介 五、 《中国药典》2010年版药用辅料概述 六、 《中国药典》2010年版无菌检查和微生物限度检查部分增修订内容
新增品种
修订品种
未收载 2010版收载
3217
1386(43%) 2237(70%) 36
4567
《中国药典》发展与展望
2010版药药典品种收载情况
内容
新增
修订 2010年版 2005年版
中国药典2010版第一部
中国药典2010版第一部
摘要:
1.介绍《中国药典2010 版第一部》
2.该版本的主要内容和更新
3.《中国药典》的历史和作用
4.《中国药典》对中医药发展的影响
正文:
《中国药典2010 版第一部》是我国国家级的药品标准规范,对药品的研发、生产、质量控制以及药品的流通和使用等方面具有重要的指导意义。
《中国药典》是我国药品标准的核心,它的每一次更新都受到广泛的关注。
2010 版第一部的《中国药典》是对前一版的修订和完善,主要包括了中药、化学药品、生物制品等各类药品的标准。
此次修订,对药品的收载数量、质量标准、检验方法等方面都进行了大幅度的提升和改进,以适应我国药品研发和生产的新需求。
《中国药典》的历史可以追溯到1953 年,其初衷是为了规范药品的生产和使用,保障人民的用药安全。
从那时起,《中国药典》已经经历了多次修订,每一次修订都反映出我国药品标准的进步,以及药品研发和生产技术的提升。
《中国药典》对我国中医药的发展起到了重要的推动作用。
一方面,它规范了中医药的生产和使用,保障了人民的用药安全。
另一方面,它推动了中医药的现代化进程,促进了中医药与国际接轨。
中国药典2010版[1]
计量---计量单位
长度:米,分米,厘米,毫米,微米,纳米
体积:升,毫升,微升 质量:千克,克,毫克,微克,纳克 压力:兆帕,千帕,帕 密度:千克每立方米,克每立方厘米
波数:负一次方厘米
动力粘度:帕秒
试药、试液、指示剂
试药:除另有规定外,选用不同等级并符合 国家有关行政主管部门规定的试剂标准
编排
乙酰唑胺
Acetazolamide
《中国药品通用名称》
按WHO编订的国际非专利 药品名称命名
C4H6N4O3S2,222.25
N-[5-(氨磺酰基)-1,3,4噻二唑-2-基]乙酰胺。 中国化学会《有机化学命名
原则》IUPAC
项目与要求
溶解度
极易溶解 :系指溶质1g(ml)能在溶剂不到1ml 易溶:系指溶质1g(ml)能在溶剂1~不到10ml 溶解:系指溶质1g(ml)能在溶剂10~不到30ml 略溶:系指溶质1g(ml)能在溶剂30~不到100ml 微溶:系指溶质 1g(ml) 能在溶剂 100 ~ 不到 1000ml 中溶 解; 极 微 溶 解 : 系 指 溶 质 1g(ml) 能 在 溶 剂 1000~ 不 到 10000ml 几乎不溶或不溶:系指溶质1g(ml)在溶剂10000ml中不能 完全溶解
主要国外药典标准
(四)《日本药局方》(日本薬局方)
Japanese Pharmacopoeia(简称JP)。
1、目前为第16版。
2、由一部和二部组成,共一册。第一部主要收载原 料药及其基础制剂。第二部主要收集生药、家庭药制 剂和制剂原料。
3、日本厚生省专门出版一本关于抗生素质量标准的 法典《日本抗生物质基准解说》, 简称“日抗基”。
《中华人民共和国药典》2010版简介
《中华人民共和国药典》2010年版简介《中华人民共和国药典》(简称《中国药典》)2010年版,按照第九届药典委员会成立大会暨全体委员大会审议通过的《中国药典》2010年版编制大纲所确立的指导思想、基本原则、任务目标及具体要求,在全体委员和常设机构工作人员的不懈努力及有关部门和参与单位的大力支持下编制完成。
经第九届药典委员会执行委员会审议通过,为中华人民共和国第九版药典。
本版药典分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
本版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
本版药典的变化主要体现在:收载品种有较大幅度的增加。
本版药典积极扩大了收载品种范围,基本覆盖了国家基本药物目录品种范围。
此次收载品种的新增幅度和修订幅度均为历版最高。
对于部分标准不完善、多年无生产、临床不良反应多的药品,也加大调整力度,2005年版收载而本版药典未收载的品种共计36种。
现代分析技术得到进一步扩大应用。
除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用。
如附录中新增离子色谱法、核磁共振波谱法、拉曼光谱法指导原则等。
中药品种中采用了液相色谱质谱联用、DNA分子鉴定、薄层生物自显影技术等方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。
化药品种中采用了分离效能更高的离子色谱法和毛细管电泳法;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中。
国家药品标准及《中国药典》2010
(三)2010版辅料
3——严格辅料标准要求 (1)尽可能收载【来源与制法】项 针对产品的来源和生产工艺,有针对性地对产品质量进行控 制。凡能明确工艺,针对工艺可能引入的杂质进行分析,必 要时增加检查项目,对有毒有害杂质严格规定限度。 (2)更加关注安全性指标 羟丙基β环糊精——该辅料对多种难溶性药物都有较好的增 溶作用, 现存问题:1)文献报道该辅料有一定的溶血性、肾毒性和 致癌性。 2)标准中重金属EP(USP)为2ppm,ChP为10ppm? 3)超范围使用严重——严格按照注射的要求
一、工作目标与工作原则
工作原则 制修订药典标准所必须坚持的六项基本原则(药典引领作用 -品种与附录) 第一、必须坚持保障药品质量、维护人民健康的原则-良好 质量是防病治病、医药产业又快又好发展的最重要前提,药 品质量标准的建军立应该遵循 第二、必须坚持继承、发展、创新的原则-加强对中医药精 华完整准确的继承与发展,注重中药的整体作用、多组分多 靶点的协同作用,避免简单地以某一组分代替多组份进而在 标准制定中片面追求一种成分含量测定的作法。应注重建立 并创新中药质量标准体系。促进科学研究与标准化的有效结 合。(据粗略统计,医药科技成果转化率仅为17%)
19典外其他药品国家标准具同等法定约束力v声明药品生产必须符合gmp违反者即使按中国药典检验合格亦不能认为符合药典规定v首次明确药品标准正文的定义与内涵系根据自身的理化与生物学特性根据处方来源生产工艺贮藏运输等各环节所制定的用以检测药品质量是否达到药用要求并衡量其质量是否稳定均一的技术规定v对附录制剂通则指导原则均予定义202131030四2010版凡例v生产工艺应经验证并经国务院药品监管部门批准生产过程均应符合gmpv动物组织来源的药品动物种属要明确所用脏器均应检疫健康无疯牛病人尿来源亦此
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、《中国药典》2010版
《中国药典》2010版
一、工作目标与工作原则 二、2010版基本情况 三、2010版主要特点
一、工作目标与工作原则
2008年底胡总书记在中内经济工作会仪指 出——要实行最严格的质量安全标准
2009年3月温家宝总理在全国人大十一届二 次会议《政府工作报告》——开展食品药品 质量安全年活动。深入开展食品药品质量安 全专项整治。健全并严格执行产品质量安全 标准,实行严格的市场准入和产品质量追溯 制、召回制度。要让人民买的放心,吃得安 心、用的舒心。
(二)2010版附录(对所有药品标准
具有法定约束力——同品种同时废止)
中药 新增14个附录(如:黄曲霉素测定法、异常毒性、 ICP-MS/微量多元素同时分析等),修订47个
化学 新增15个附录(如:溶血与凝聚、注射剂安全性检查 指导原则、离子色谱、电导率、NMR、拉曼光谱等); 修 订69个(如:渗透压/明确正常血液渗透压285310mOsmol/Kg,静脉注射液、滴眼液必检;可见异物/深于 7号比色液宜选用色差计测定,明显异物/2mm以上/不得检 出,细微异物复试;过敏反应/竖毛、发抖、干呕、连喷3声 现象之二、或二便失禁、步态不稳或倒地、抽搐、休克、死 亡之一则不合规定)
(三)2010版辅料
注射剂相应增加如下要求: (1)注射剂所用的原辅料应从来源及工艺等
生产环节进行严格控制并应符合注射用的质 量标准。 (2)供注射用的非水性溶剂,应严格限制其 用量,并应在品种项下进行相应的检查。 (3)注射剂所用辅料,在标签或说明书中应 标明其名称。
(三)2010版辅料
国家药品标准及《中国药典》2010版
一、国家药品标准
国家药品标准
标准 化目的——最佳秩序、最佳效益 标准化基础——科学进步、实践经验 标准化对象——重复性事物(重复生产、检验,减少不必要
劳动经验积累,新经验取代旧经验之最佳方案) 标准化本质——统一(统一规定范围,避免不必要混乱,各
中国药典与国家药品标准总数示意图
12000 10000
8000 6000 4000 2000
0 药典品种占全部标准比例
05版 10版 国标现存总数
国家药品标准
6、ICH关于“标准”的解释 1)A specification-is defined as a list of tests,references to analytical
一、工作目标与工作原则
第三、必须坚持科学、实用、规范的原则-药 品质量标准的建立应以实现科学有效的质量 控制为基本原则,在确保能准确控制质量的 前提下,应倡导简单实用,应结合中国国情, 不肓目追求高成本与高消耗的技术,避免资 源浪费与环境污染。
一、工作目标与工作原则
第四、必须坚持质量可控性原则——有重点的解决质量标准 老化、标准对产品质量不可控的问题,要按照国务院专项整 治要求和国家局的统一部署,对高风险品种要增加检测项目、 提高检测方法、严格标准限度,努力保证药品质量与安全。
方遵守公认准则) 标准化实例——秦始皇统一度量衡,统一货币,统一文字
(9种马字-小篆)维护了当时社会最佳秩序促进了贸易最佳 效益奠定了中华文化基础 铁路轨距——华北中东铁路1524mm、滇越1000mm
国家药品标准
2.技术标准的定义——对标准化领域需要协调统一的技术事项所制ቤተ መጻሕፍቲ ባይዱ的 标准。
一、工作目标与工作原则
第四,做好药典增补本的编制工作。主要发达国家的药典修 订周期已由过去的5年缩短至1年,标准的更新速度不断加快。 为此,我们也应加快我国药品标准首先是药典标准的修订速 度,及时出版药典增补本
第五,实现《中国药典》一、二、三部的统一规范,避免出 现对中药、化学药、生物制品技术要求的不一致
新增——1386种, 中药(新增1019种,即药材种、饮片439种、植物油与提取
物种、中成药种)特别是饮片标准的大幅增加,主要解决饮 片标准较少、各地炮制规范不统一等问题。对于提高中药饮 片质量,保证中医临床用药的安全有效,推动中药饮片产业 健康发展,将起到积极作用。
化药新增330种、生物制品新增37种,均为临床常用、标准 完善、成熟稳定的品种;
种对于促进我国新型的研究开发十分必需)。
(三)2010版辅料
3——严格辅料标准要求 (1)尽可能收载【来源与制法】项 针对产品的来源和生产工艺,有针对性地对产品质量进行控
制。凡能明确工艺,针对工艺可能引入的杂质进行分析,必 要时增加检查项目,对有毒有害杂质严格规定限度。 (2)更加关注安全性指标 羟丙基β 环糊精——该辅料对多种难溶性药物都有较好的增 溶作用, 现存问题:1)文献报道该辅料有一定的溶血性、肾毒性和 致癌性。 2)标准中重金属EP(USP)为2ppm,ChP为10ppm? 3)超范围使用严重——严格按照注射的要求
procedures,and appropriate acceptance criteria,……acceptable for its intended use. 2)Specifications-are one part of a total comtrol strategy designed to ensure product quality and consistency.Other parts of this strategy include thorough product characterization during development,and adherence to Good Manufacturing Practices;e.g.suitable facilities,a validated manufacturing process,validated test procedure,raw material testing,in-process testing,stability testing,etc. 3)Specifications-are chosen to confirm the quality of the drug substance and drug product rather than to estabish full characterization
一、工作目标与工作原则
第二 进一步提高对 高风险品种 的标准要求。 重点加强中药、生化药品注射剂等高风险品 种的标准提高工作,促进人民用药安全
一、工作目标与工作原则
第三、扩大收载常用辅料。针对目前上游工 产品市场的混乱,特别是药用辅料欠缺、质 量差异严重等问题,下大力气建立药用辅料 标准,解决药用辅料标准少、质量差等突出 问题
(三)2010版辅料
明胶空心胶囊(新增) 2005版未收载,2000版二部(名称为:空心胶囊) 1)、严格亚硫酸盐:会引起红细胞减少、肠胃肝损害等,
生物制品 新增18个附录(如:残留溶剂、牛血清白蛋白残 留量测定),修订39个
(三)2010版辅料
1——新增“药用辅料”通则; 2——扩大辅料收载品种 3——严格辅料标准要求
(三)2010版辅料
1——新增“药用辅料”通则; (1)生产药品所用的药用辅料必须符合药用要求;注射剂
一、工作目标与工作原则
第六、必须坚持标准发展的国际化原则—— 注重新技术和新方法的应用,积极采用国外 药品标准的先进方法,积极开展药品标准的 国际交流与协调工作,促进我国药品标准 (全球基金合作项目三大领域、辅料标准协 调)特别是中药标准的国际化(残留溶剂、 与USP在抗生素、中药材及生物制品标准协 调,出口企业未融入是主要问题)
(一)2010版品种
修订——2228种,中药修订634种、化药修 订1500种(重点为注射剂,将为最广泛使用 的化学药品提供有力的质量保障)、生物制 品修订94种(修订比例约70%)。
删除——对标准不完善、多年不生产、不良 反应多的36种药品(化学药29种+生物制品7 种)从药典撤下,纳入评价是否决定淘汰
二、2010版基本情况
(一)2010版品种(monographs) (二)2010版附录(general chapters,
methods) (三)2010版辅料(excipients) (四)2010版凡例(general notice)
(一)2010版品种
2010年版《中国药典》收载品种4567种 (2165+2271+131),基本覆盖基本药物目录(307种—— 补遗是下一步重点)。
2——扩大辅料收载品种 (1)安排辅料标准起草205种,其中修订原2005版72种,
收载132种 (2)品种遴选原则: 1)国内已生产的常用品种。 2)国内已进口,且国内制药企业已广泛应用的国外辅料品
种。 3)已有食品、化工国家标准、且国内药企应用较多的品种
原则上应确实成熟的标准才可收入药典。 4)开发新剂型所需的重要辅料(用量不大但处于前沿的品
第九届药典委员会主任委员 邵明立
副主任委员 马晓伟 卫生部副部长 吴 浈 国家食品药品监管局副局长 于文明 国家中医药管理局副局长 陈新年 总后卫生部副部长
执行委员会
25个专业委员
一、工作目标
目标之一是要按期高水平完成《中国药典》 2010年版编制工作
第一、对于《中国药典》收载的品种,采取 更新与淘汰并举的措施收载范围应覆盖国家 基本药物品种,保障人民基本用药的质量
用药用辅料应符合注射用质量标准要求。 (2)药用辅料应经安全性评估对人体无毒害作用;化学性
质稳定等 (3)药用辅料的质量标准应建立在经相关部门确认的生产
条件、生产工艺以及原材料的平源等基础上,上述影响因素 任何之一发生变化,均应重新确认药用辅料质量标准的适用 性 (4)包装上应注明为“药用辅料”,且药用辅料的适用范 围(给药途径)、包装规格及贮藏要求
