(完整版)化学速率平衡图像专题练习题
(完整word版)化学平衡图像专项练习题

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。
化学反应速率和化学平衡--图像专题

2.浓度(C)-时间(t)图
想一想: 由下图可以得到什么信息?
C4
3 2 1 0
A
B
C
图像含义: (1)确定反应物和生成物。 (2)确定反应方程式各物质化学计量数。
化学计量数之比=物质的量的变化量之比 =物质的量浓度的变化量之比 =反应速率之比
t
由图可知: ①反应为可逆反应 ②方程式为: A + 3C
化学反应速率和化学平衡—图像专题
1.速率-时间图
例1、在一密闭体系中发生:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ· -1右图是某一时间段中反应速率与反应进 mol 程的曲线关系图,回答下列问题: (1)处于平衡状态的时间段 ν t0~t1,t2~t4,t5~t6 是_________________。 ν逆 ν逆 (2)t1、t3、t4时刻体系中分 ν正 ν正 别是什么条件发生了变化? t1:升温; t3:加催化剂; t0 t1 t2 t3 t4 t5 t 6 t t4:减压 (3)下列各时间段时,氨的 体积分数最高的是( A ) 解题注意: 外界条件对速 率及平衡移动的影响。 A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
2B
解题注意: 曲线的起点、终点及变化趋势。
3.含量-时间t-压强P(或温度T)图
例如:对反应aA(g)
的 浓 度
bB(g)
读图判断该图中P1与P2及;b
解题原则一:先拐先平数值大
t
t1 t2
小结: (1)判断非平衡态(斜线)和平衡态(水平线),且遵循 “先拐先平,数值大”的原则. (2)判断反应特征,如压强大小,反应前后体积变化等。
③看线:即线的走向和变化趋势
第二章 化学反应速率和化学平衡图像题专练

化学反应速率和化学平衡图像题专练题组一速率—时间图像1. 在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然改变的条件可能是( )A.催化剂失效B.减小生成物的浓度C.降低体系温度D.增大容器的体积答案 C解析从图像可以看出:改变条件后,反应速率与原平衡速率出现断点且低于原平衡反应速率,说明改变的条件可能是降低温度或减压。
从改变条件后的v′正与v′逆的大小关系,可得出化学平衡正向移动。
降低温度,该平衡正向移动,必有v′正>v′逆,故选C。
2.向一容积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)2HI(g)ΔH<0,当达平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使平衡移动(如图所示),下列说法正确的是( )A.容器内气体颜色变深,平均相对分子质量不变B.平衡不移动,混合气体密度增大C.H2转化率增大,HI平衡浓度减小D.t0时改变的条件为减小体积或升高体系温度答案 A解析条件改变后,正、逆反应速率均增大,但是逆反应速率大于正反应速率,平衡逆向移动,改变的条件应为升高温度,A项正确。
题组二时间—浓度(物质的量)图像3.已知X(g)和Y(g)可以相互转化:2X(g)Y(g) ΔH<0。
现将一定量X(g)和Y(g)的混合气体通入一体积为1L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。
则下列说法不正确的是( )A.若混合气体的压强不变,则说明反应已达化学平衡状态B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点C.25~30min内用X表示的平均化学反应速率是0.08mol·L-1·min-1D.反应进行至25min时,曲线发生变化的原因是增加Y的浓度答案 D解析正反应是气体分子数减小的反应,所以当压强不再发生变化时,可以说明反应已经达到平衡状态,A项正确;根据图像可知,只有b 点表示的反应体系中,各物质的浓度不再发生变化,所以只有b点表示反应处于平衡状态,B项正确;25~30min内X的浓度变化量是0.4mol·L-1,所以用X表示的平均化学反应速率是0.4mol·L-15min=0.08mol·L-1·min-1,C项正确;反应进行至25min时,X物质的浓度增大,D项不正确。
人教版高中化学选择性必修1第二章化学反应速率与化学平衡专题强化练2化学反应速率与化学平衡图像含答案

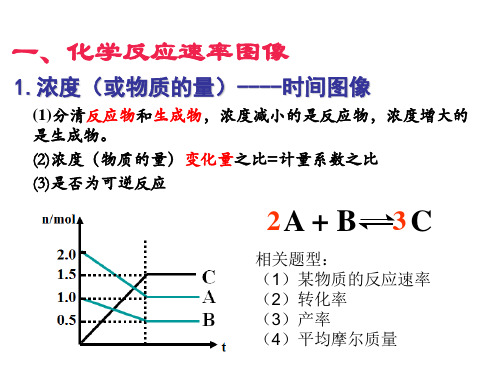
第二章化学反应速率与化学平衡专题强化练2化学反应速率与化学平衡图像1.(2024浙江台州路桥中学月考)已知:A(g)+2B(g) 3C(g)ΔH<0,向一恒温恒容的密闭容器中充入1 mol A和2 mol B发生反应,t1 min 时达到平衡状态Ⅰ,在t2 min时改变某一条件,t3 min时达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
下列说法正确的是()A.t2 min时改变的条件:向容器中加入AB.平衡时B的体积分数φ:φ(Ⅱ)=φ(Ⅰ)C.t2~t3 min时平衡正向移动D.平衡时A(g)的物质的量浓度c:c(Ⅰ)>c(Ⅱ)2.(2023黑龙江哈尔滨九中月考)将一定量硫化氢气体加入密闭容器中,发生反应:2H2S(g) S2(g)+2H2(g),该反应的平衡常数的负对数(-lg K)随温度(T)的变化曲线如图所示。
下列说法错误的是()A.该反应的ΔH>0B.C点对应状态的平衡常数K=10-3.638 0C.反应速率:v A>v CD.30 ℃时,B点对应状态的v正>v逆3.(2024安徽合肥168中学月考)CO2合成乙烯的反应原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH,往恒压密闭容器中按n(CO2)∶n(H2)=1∶3充入气体,在常压和催化剂作用下进行反应,测得温度对CO2平衡转化率和催化剂催化效率影响情况如图所示。
下列说法不正确的是()A.该反应ΔH<0,平衡常数:K M>K NB.反应速率有可能是v(M)>v(N)C.其他条件相同,温度越低,反应一定时间后CO2的转化率越高D.若投料比改为n(CO2)∶n(H2)=1∶4,可提高CO2的平衡转化率4.(2024河北承德月考)已知反应:2H2(g)+CO(g) CH3OH(g)。
一定条件下,在容积恒定的密闭容器中充入1 mol CO和2 mol H2,在催化剂作用下发生上述反应,CO的平衡转化率与温度、压强的关系如图所示。
第27讲 化学反应速率、平衡图像(练习)(原卷版)

第27讲 化学反应速率、平衡图像(模拟精练+真题演练)完卷时间:50分钟可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl35.5 Cu 64 Ba137 一、选择题(每小题只有一个正确选项,共12×5分)1.(2023·江苏南通·海门中学校考模拟预测)飞机在平流层飞行时,尾气中的NO 会破坏臭氧层。
如何有效消除NO 成为环保领域的重要课题。
某研究小组用新型催化剂对CO 、NO 催化转化进行研究,测得一段时间内NO 的转化率、CO 剩余的百分率随温度变化情况如图所示。
已知NO 可发生下列反应: 反应I :()()()()222CO g 2NO g 2CO g N g ++1ΔH反应Ⅱ:()()()222NO g N g O g +2ΔH下列叙述不.正确的是A .10∆<H ,2H 0∆<B .温度大于775K 时,催化剂活性降低C .()()NO 1CO n n =时,控制温度875K 已可较好的去除NOD .775K ,()()NO 1CO n n =时,不考虑其他反应,该时刻()()22CO :N 3:2n n ≈2.(2023·江苏盐城·盐城市伍佑中学校考模拟预测)利用2H 和CO 反应生成4CH 的过程中主要涉及的反应如下:反应Ⅱ ()()()()242CO g 3H g CH g H O g +=+ 1Δ206.2H =- kJ ⋅mol -1 反应Ⅱ ()()()()222CO g H O g CO g H g +=+ 2Δ41.2H =- kJ ⋅mol -1[4CH 的产率()()4CH 100%CO n n ⨯,4CH 的选择性()()()424%n +CH 100CO C n H n ⨯生成生成生成]。
保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时4CH 和2CO 的产率及CO 和2H 的转化率随()()2n H n CO 的变化情况如图所示。
化学反应速率与化学平衡——图像专题(共52张PPT)
v
v正 v逆 t
v
t1
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
2.速率----时间图像
原因分类: (1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1 t2
t
v逆 v正
t1 t2
t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g) pC(g)+qD(g),条件改变时有 右图变化,改变的条件可能 加正催化剂 ; 为:a.____________ 加压 ,m+n___p+q b.________ ;平 = 正 反应方向移动。 衡向____
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
T2C T1C
答 问 案 题
1、T1>T 与T 2 2的高低 2、是放热反应 ΔH<0 、放热反应还是吸热反应
看图技巧:
0
t1
t2
时间
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
二、化学平衡图像
1.含量——时间图像
看图技巧:
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
课堂练习
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
化学速率与平衡图像专题训练

30化学速率与平衡图像专项练习一、选择题1、如图是温度和压强对X+Y2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z 的体积分数.下列叙述正确的是( )A .上述可逆反应的正反应为放热反应B .X、Y 、Z 均为气态 C .X 和Y 中只有一种为气态,Z 为气态D .上述反应的逆反应的△H>0 2、一定温度下,在2 L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间 变化的曲线如图所示.下列描述正确的是( )A .反应从开始到10 s 时,用Z 表示的反应速率为0.158 mol·L -1·s -1B .反应从开始到10 s 时,X 的物质的量浓度减少了0.79 mol ·L -1C .反应从开始到10 s 时,Y 的转化率为79%D .反应的化学方程式为:X(g)+Y(g) Z(g)3、[双选题] 对于一个气态反应体系,如图所示,表示的是反应速率和时间的关系,其中t 1达到平衡,t 2~t 3是改变条件后出现的情况,则该条件可能是( ) A .加压 B .增大反应物浓度C .减压 D .加入催化剂4、工业合成氨的正反应是放热反应,下列关于N 2(g)+3H 2(g) 2NH 3(g)反应的图象中,错误的是( )5、下列各图中能表示A(g)+B(g) 2C(g)(正反应为放热反应)这个可逆反应的图像为( )二、非选择题:6、科学家一直致力于“人工固氮”的新方法研究。
目前合成氨技术原理为:N 2(g)+3H 2(g) 2NH 3(g) △H=-92.2 kJ ·mol -1。
(1)673 K ,30 MPa 下,上述合成氨反应中n(NH 3)和n(H 2)随时间变化的关系如图所示.下列叙述正确的是 。
A .点a 的正反应速率比点b 的大 B .点c 处反应达到平衡 C .点d 和点e 处的n(N 2)相同D .773 K ,30 MPa 下,t 2时刻也是该反应的平衡点,则n(NH 3)比图中e 点的值大(2)在容积为2.0 L 恒容的密闭容器中充人0.80 mol N 2(g)和1.60 mol H 2(g),反应在673 K 、30 MPa 下进行,达到平衡时,NH3的体积分数为20%。
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应速率、化学平衡图像
一、ν-t图像或c-t图像
1. ν-t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移
动的影响。
【练习1】对于反应2SO 2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。
t1时,,
平衡向移动。
t2时,,
平衡向移动。
t3时,,
平衡向移动。
t4时,,
平衡向移动。
小结:改变条件,图像一点保持连续;改变,两点突变,_____________使正逆反应速率同等程度的增大而平衡不移动。
【练习2】对达到平衡状态的可逆反应X+Y Z+W,在其他
条件不变的情况下,增大压强,反应速率变化如右图所示,
则图像中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
【练习3】在密闭容器,一定条件下进行反应,
mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,
重新达到平衡,变化过程均如右图所示,则对该反应叙述正确
的是( )
A.正反应是吸热反应B.逆反应是吸热反应
C.m+n>p+q D.m+n<p+q
【练习4】应N2(g)+3H2(g) 2NH3(g) △H<0 在某
一时间段中反应速率与反应过程的曲线关系如图,则
图中氨的百分含量最低的时间段是( ) ,氨的百
分含量最高的时间段是( )
A.t0-t1
B.t2-t3
C.t3-t4
D. t5-t6
2. c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗
浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程
式中各物质的化学计量数之比。
【练习5】今有X(g)+Y(g) 2Z(g) △H<0。
从反应
开始经过t1后达到平衡状态,t2时由于条件改变,平衡
受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的
原因是( )
A.增大X或Y的浓度B.增大压强
C.增大Z的浓度D.升高温度
【练习6】右图表示800℃时A、B、C三种气体物质的浓度随时间的
变化情况,t1是到达平衡状态的时间。
试回答:
(1)该反应的反应物是______;
(2)反应物的转化率是______;
(3)该反应的化学方程式为___________________________。
二、平衡图像
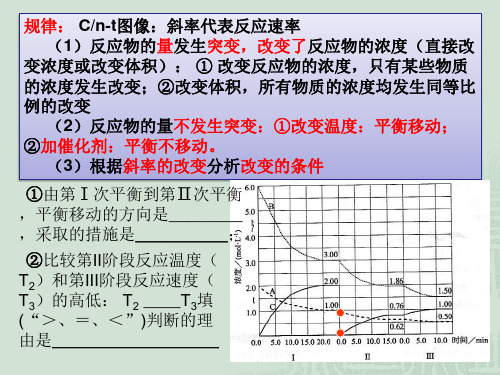
1.出现拐点的图像:分析依据“先拐先平”。
在转化率-时间图像或物质的百分含量-时间
图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
【练习7】已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 3C(g)+D(s) △H<0,图中曲线b代表一定条件
下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
A.增大A的浓度B.缩小容器的容积
C.加入催化剂D.升高温度
【练习8】现有可逆反应A(g)+2B(g) nC(g) △H<0,在相同
温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,
其中结论正确的是( )
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
【练习9】对于可逆反应A(g)+B(g)C(g) △H<0,下列图像正确的是()
【练习10】可逆反应:aA(g)+ bB(g)cC(g)+ dD(g)
根据图回答:
①压强P1比P2(填大或小);
②(a +b)比(c +d)(填大或小);
③温度t1℃比t2℃(填高或低);
④正反应热(填吸或放)。
【练习11】在密闭容器中进行下列反应:
M(g) + N(g) R(g) + 2L,此反应符合右图,下列叙
述正确的是( )
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
【练习12】等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气的总体积(V)与时间的关系正确的是( )
2.受两个变量(P、T)影响的图像:分析依据“定一议二”。
转化率或百分含量等因素受到
压强、温度两个变量的影响,先确定一个变量,分析另外两个量的关系。
如
确定温度分析转化率受压强的影响。
【练习13】可逆反应2A+B2C(g) △H<0,随温度变化气体平
均相对分子质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B可能都是气体
【练习14】反应L(s)+aG(g) bR(g)达到平衡时,温度和压
强对该反应的影响如图所示。
图中,压强p1>p2,x轴表示
温度,y轴表示平衡混合气中G的体积分数。
据此可判断( )
A.上述反应是放热反应
B.上述反应是吸热反应
C. a>b D. a<b
【练习15】某可逆反应L(s) + G(g) 3R(g) ΔH>0,右图表
示外界条件温度压强的变化对上述反应的影响。
试判断图中
Y轴可以表示( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
【练习16】反应mA(s) + nB(g) eC(g) + fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是()
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e +f
D.达到平衡后,增加A的量有利于平衡右移
【练习17】如图所示,可逆反应:2A(g)+B(g) 2C(g) △H<0
的图像正确的是()
【练习18】对于可逆反应,A2(g)+3B2(g) 2AB3(g)△H<0,下列图像不正确的是()
【练习19】在其它条件一定时,图中曲线表示反应
2NO(g)+ O2(g) 2NO2(g) △H>0达平衡时NO的转化率
与温度的关系,图上标有A、B、C、D、E点,其中表示未达
平衡状态且V正>V逆的点是( )
A.A或E B.B点
C.C点D.D点
【练习20】反应A2+B22AB在不同条件下,产物AB百分含
量随时间变化关系如图所示,a为500℃,b为300℃时情
况,c为300℃时从时间t3开始向容器中加压的情况,则下
列叙述正确的是( )
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
【练习21】两种气态单质按下列反应
X2(g) + Y2(g) 2XY(g),X2与Y2按一定比例混合,在不同温
度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确
定该反应是吸热反应还是放热反应
化学反应速率、化学平衡图像参考答案
练习题
1.增大反应物的浓度;正向;降低温度;正向;增大压强;正向;使用催化剂
小结:浓度;温度或压强;使用催化剂
2.A
3.BD
4.D;A
5.D
6.(1)A(2)40%(3)2A B+3C
7.BC 8.B 9.B 10.小、小、高、吸
11.C 12.A 13.CD 14.BD 15.C 16.BC 17.A 18.AC 19.C 20.B 21.放热反应。
