化学反应条件的优化——工业合成氨 ppt课件
合集下载
2.4化学反应条件的优化工业合成氨课件高二上学期化学选择性必修1

2.合成氨时采用700 K左右的温度进行,主要是因为在该温度时( C )
A.合成氨的化学反应速率最大
B.N2的转化率最高 C.催化剂的活性最大
D.NH3在平衡混合气体中的体积分数最大 3.在合成氨时,既要使氨的产率增大,又要使化学反应速率增大,可以采取的
措施有( C )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温
2.利用化学平衡移动的知识分析什么条件有利于氨的合成。
工业合成氨的反应为:N2(g)+3H2(g)
2NH3(g) ΔH=-92.2 kJ·mol-1
目标:合成氨的平衡转化率越大越好
反应条件: 达到化学平衡的时间延长
低温、 高压、 高要求设备
增加反应物浓度、分离氨、氮气与氢气的体积比为1:3
二、合成氨反应的速率 交交流流··研研讨讨
一、合成氨反应的限度
交交流流··研研讨讨
工业合成氨的反应为:N2(g)+3H2(g)
2NH3(g)
298 K ΔH=-92.2 kJ·mol-1 ΔS=-198.2 J·K-1·mol-1
1.根据反应的焓变和熵变分析在298 K时合成氨反应能否正向自发进行。
合成氨反应是在298 K时能正向自发进行的放热反应,同时也是熵减反应。
研究方向:
仿生固氮酶催化剂
根瘤菌固氮
合成氨的生产流程
合成氨的整个工业生产包括造气、净化、合成氨三大部分。 造气 原料气中的氮气来自空气,而氢气来自天然气、煤和炼油产品。
以天然气为原料时,反应可简单表示为:
CH4 + H2O
高温 催化剂
CO + 3H2
CO + H2O
高温 催化剂
CO2 + H2
【化学课件】化学反应条件的优化——工业合成氨ppt课件

N2(g)+3H2(g)
2NH3(g) ΔH =-92.4 kJ·mol-1
根据外界条件对反应速率和反应限度的影响,
请为工业合成氨选择合适的条件: 使生产氨气快 (速率分析) 压强 温度 催化剂 高压 高温 使用 使生成氨气多 (平衡分析) 高压 低温 不影响
让我好好想想?
N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1 考虑催化剂的活性
思考:温度是否越高越好?
压强是否越大越好?
考虑设备的耐压能力
外部条件 压强
温度 催化剂 浓度
工业合成氨的适宜条件
2×107~5×107 Pa 适宜温度(500℃左右) 催化剂活性大 使用铁触媒作催化剂 N2和H2的物质的量比为1:2.8的投料比, 氨
及时从混合气中分离出去
工业上利用某可逆反应生产产品有哪些注意事项? 1.一般要使用催化剂:
加快化学反应速率,提高生产效率,提高经济效益; 2.选择合适的温度:
该温度是催化剂活性最大的温度; 3.选择合适的压强:
既要考虑化学反应速率和化学平衡,还要综合考虑设备
等。
例.(双选)在合成氨工业中,为增加NH3的日产量,下列
变化过程不能使平衡向右移动的是( BC )
A.不断将NH3分离出来 B.使用催化剂 C.采用700 K左右的高温 D.采用2×107~5×107 Pa的压强
合成氨工业简述:
1.主要流程:
原料气制取→净化 →压缩 →合成→分离→液氨 (造气) (净化) 2.原料气制取: 制氮气: 常用压缩液态空气 制氢气: 水蒸气
N2(g)+3H2(g)
2NH3(g) Δ H =-92.4 kJ/mol
2.4化学反应条件的优化工业合成氨课件上学期高二化学选择性必修1

既要注意外界条件对反应速率和平衡影响的一 致性,又要注意外界条件对二者影响的矛盾性
从原料的利用率分析
增加易得廉价原料,提高难得高价原料的利用率, 从而降低生产成本
从实际生产能力分析
如设备承受高温、高压能力等
从催化剂的使用活性分析
注意温度对催化剂活性的影响
第1讲 描述运动的基本概念 第2章 化学反应的方向、限度与速率
工业生产中,主要从反应限度和反应速率两个角度选择适宜条件,既要考虑增大反应物的转 化率,充分利用原料,又要考虑增大反应速率,提高单位时间内的产量,同时还要考虑设备的 要求和技术条件。
第1讲 描述运动的基本概念 第2章 化学反应的方向、限度与速率
外部条件 温度 压强 浓度
催化剂
工业合成氨适宜条件的选择
第1讲 描述运动的基本概念 第2章 化学反应的方向、限度与速率
思路点拨 选取适宜的化工生产条件时,主要从反应速率和化学平衡移动两方面考虑,同时 考虑化工生产中的动力、材料、设备、催化剂等因素的影响。 解析 催化剂的活性与温度有关,与压强无关,A项错误;氨易液化,N2、H2在实际生产中可 循环使用,总体来说合成氨的产率较高,B项正确;合成氨工业选择700 K左右的反应温度,主 要从反应速率和催化剂活性两方面考虑,合成氨反应的正反应是放热反应,高温不利于氨气 的合成,该温度下催化剂的活性最大,C项错误;增大压强,合成氨反应的平衡正向移动,反应 速率增大,有利于合成氨,但压强太大,对设备、动力的要求更高,D项错误。
说法正确吗? ( ✕ )
提示 虽然从合成塔出来的混合气体中氨气只占13%~14%,但由于氮气、氢气是循环 使用的,总体来讲氨的产率比较高。
第1讲 描述运动的基本概念 第2章 化学反应的方向、限度与速率
化学反应条件的优化工业合成氨优秀课件

❖ A、0.2 mol.L-1.min-1
B 、 0.6 mol.L-1.min-1
❖ C、0.1 mol.L-1.min-1
D、 0.3 mol.L-1.min-1
二、合成氨工业简述:
1、主要流程:
原料气制取 净化 压缩
(造气)
(净化)
2、原料气制取:
制氮气:
合成 分离
(合成氨)
液氨
压缩 液态空气 蒸发 N2(先逸出) 物理方法 空气 碳 CO2(+N2) 分离出CO2 N2 化学方法
1× 105 Pa 15.3
3000C 4000C 5000C 6000C
2.2 0.4 0.1 0.05
1× 107 Pa 81.5
2× 107 Pa 86.4
3× 6× 1× 107 107 108 Pa Pa Pa
89.9 95.4 98.8
52.0 64.2 71.0 84.2 92.6 25.1 38.2 47.0 65.2 79.8 10.6 19.1 26.4 42.2 57.5 4.5 9.1 13.8 23.1 31.4
制氢气:
炽热碳
水蒸气 CO+H2
H2O(气)
分离出CO2
CO2+H2
H2
C(S)+H2O(g) CO(g)+H2(g) CO(g)+H2O(g) CO2(g)+H2(g)
我国合成氨工业的发展情况:
解放前我国只有两家规模不大的合成氨厂; 1949年全国氮肥产量仅0.6万吨; 1982年达到1021.9万吨,成为世界上产量最高 的国家之一。
化学反应条件的优化工业合成 氨优秀课件
利用氮、氢为原料合成氨的工业化生产曾是一 个较难的课题,从第一次实验室研制到工业化投 产,约经历了150年的时间。
反应条件的优化-工业合成氨 PPT 鲁科版

• 1.根据合成氨反应的特点,应分别采取什么措施提高反 应的平衡转化率和反应速率?请将你的建议填入下表。
提高反应的平衡转化率 反应特点 放热 分子数减少 反应可逆 措施 低温 加压 提高化学反应速率 反应特点 活化能高 低温速率低 措施 使用催化剂 加温
增加H2/N2的浓度 及时分离NH3
低温加压 原料气浓度增加能提高 反应速率 氨气浓度增加能降低反 应速率
2SO3 (g) △H
1.01×107 Pa 99.7% 98.3%
(1)从理论上分析,为了使二氧化硫尽可能转化为三氧化 硫, 可控制的条件是 。 (2)实际生产中,选定400℃~500℃作为操作温度其原因 是 。 (3)实际生产中,采用的压强为常压,其原因是: . (4)在生产中,通入过量空气的目是 。 (5)尾气中有SO2必须回收是为了 。
交流研讨
• 2.请尝试为合成氨选择适宜条件。 • 3.在确定合成氨的适宜条件的过程中 遇到了哪些问题?是怎样解决的?
温度、压强的选择采取了折中的方法,各方面考虑最佳条件。
• 4.为了提高合成氨生产能力,还可以 在哪些反面做进一步的改进?
采用了循环流程的工艺,不断地分离氨气,提高生产效率。
研讨的结果
第4 节
化学反应条件的优化 —工业合成氨
【问题】分析工业生产主要要考虑哪些 题?
• 经济效益和社会效益 :
单位时间内产率高
原料的利用率高
增大化学反应限度
增大化学反应速率
另外还要考虑生产中的消耗能源、原料来源、 设备条件、环境保护等因素。
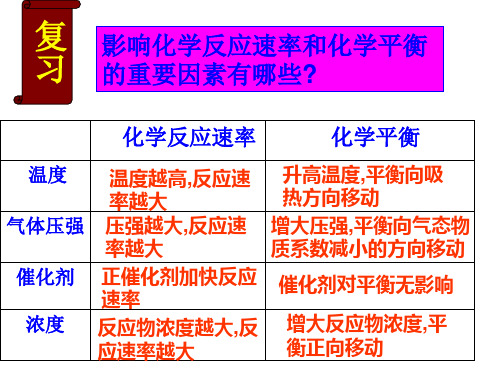
复 习
温度
影响化学反应速率和化学平衡 的重要因素有哪些?
化学反应速率 化学平衡
外部条件 压强 温度 催化剂 工业合成氨的适宜条件 高压 200~500大气压 适宜温度 700K左右 使用铁触媒作催化剂 液化氨并及时分离、使氮氢 原料气循环利用.
提高反应的平衡转化率 反应特点 放热 分子数减少 反应可逆 措施 低温 加压 提高化学反应速率 反应特点 活化能高 低温速率低 措施 使用催化剂 加温
增加H2/N2的浓度 及时分离NH3
低温加压 原料气浓度增加能提高 反应速率 氨气浓度增加能降低反 应速率
2SO3 (g) △H
1.01×107 Pa 99.7% 98.3%
(1)从理论上分析,为了使二氧化硫尽可能转化为三氧化 硫, 可控制的条件是 。 (2)实际生产中,选定400℃~500℃作为操作温度其原因 是 。 (3)实际生产中,采用的压强为常压,其原因是: . (4)在生产中,通入过量空气的目是 。 (5)尾气中有SO2必须回收是为了 。
交流研讨
• 2.请尝试为合成氨选择适宜条件。 • 3.在确定合成氨的适宜条件的过程中 遇到了哪些问题?是怎样解决的?
温度、压强的选择采取了折中的方法,各方面考虑最佳条件。
• 4.为了提高合成氨生产能力,还可以 在哪些反面做进一步的改进?
采用了循环流程的工艺,不断地分离氨气,提高生产效率。
研讨的结果
第4 节
化学反应条件的优化 —工业合成氨
【问题】分析工业生产主要要考虑哪些 题?
• 经济效益和社会效益 :
单位时间内产率高
原料的利用率高
增大化学反应限度
增大化学反应速率
另外还要考虑生产中的消耗能源、原料来源、 设备条件、环境保护等因素。
复 习
温度
影响化学反应速率和化学平衡 的重要因素有哪些?
化学反应速率 化学平衡
外部条件 压强 温度 催化剂 工业合成氨的适宜条件 高压 200~500大气压 适宜温度 700K左右 使用铁触媒作催化剂 液化氨并及时分离、使氮氢 原料气循环利用.
鲁教版九年级上册化学 第2章-第4节《化学反应条件的优化——工业合成氨》ppt课件(共38张ppt)

B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
解析:本题旨在考查影响化学平衡的外界因素的应用与
分析。题目要求增大合成氨反应中氢气的转化率,就是
在不增加氢气的情况下,改变合成氨反应的其他条件,
使更多的氢气转化为氨。从化学平衡分析也就是使平衡 栏
故B发生移动。在恒温、恒压时,加入He,使整个体
系做等压膨胀,体积变大,He虽然不参与化学反应,
但由于体积的膨胀,而使平衡混合物中的N2、H2、 栏
目
NH3的浓度都相应减小,结果,反应物浓度减小的程
链 接
度比生成物浓度减小的程度大,此时正反应速率小于
逆反应速率,平衡左移,故C发生移动。在恒温、恒
容时,向体系中加入He,使整个体系压强增大,但由
目 链
接
kc(N2)·c1.5(H2)·c-1(NH3)知,在一定的温度、压强下,
化学反应速率与反应物浓度c(N2)或c1.5(H2)成正比关系,
与生成物浓度c(NH3)成反比关系。因此可以采用增大
反应物浓度、减小生成物浓度来提高化学反应速率。
4.催化剂对化学反应速率的影响:加催化剂可以
使反应的活化能从335kJ·mol-1降低为167kJ·mol-1,
例2 对于合成氨的反应来说,使用催化剂和施加高压,
下列叙述中正确的是( )
A.都能提高反应速率,都对化学平衡状态无影响
栏
B.都对化学平衡状态有影响,都不影响达到平衡状态 目
链
所用的时间
接
C.都能缩短达到平衡状态所用的时间,只有压强对化
学平衡状态有影响
D.催化剂能缩短反应达到平衡状态所用的时间,而压
上课用《化学反应条件的优化---工业合成氨》(共48张PPT)
分析:
①因为正反应方向是放热的反应,所以降低温 度有利于平衡正向移动。
②可是温度越低,反应速率越小,达到平衡所需 要的时间越长,因此温度也不宜太低。 ③催化剂要在一定温度下催化活性最大。 综合以上因素:实际生产中温度一般选择在 700K左右(主要考虑催化剂的活性)。
4、浓度怎么定? N2 和H2的比例怎么定?
4.合成氨工业有下列流程:①
原料气制备;②氨的合成;③原 料气净化和压缩;④氨的分离。 其先后顺序为( )
A.①②③④ B.①③ ② ④
C.④③②①
D.②③④①
5、已知2SO2(g)+O2(g) 其实验数据见表
2SO3 (g) △H<0
450℃ 。 (1) 应选用的温度是______ 常压 ,理由是因为常压下 SO2 (2) 应采用的压强是______ ___________ 的转化率已经很高,若采用较大压强,SO2的转化率 __________________________________________ 提高很少,但需要的动力更大,对设备的要求更高。 _______________________________________。
----
50MPa ,是因该条
4.对于反应: 2SO2(g)+O2 (g) 下列判断正确的是( BC )
2SO3 (g)
A.2体积SO2和足量O2反应,必定生成2体积SO3 B.其他条件不变,增大压强,平衡向右移动
C.平衡时, SO2消耗速率必定等于O2的生成速率
的两倍
D.平衡时, SO2浓度必定等于O2浓度的两倍.
选择合适的压强:既要考虑化学反应速率和 化学平衡,还要考虑动力、材料、设备等。
第二课时
二、合成氨工业简述:
①因为正反应方向是放热的反应,所以降低温 度有利于平衡正向移动。
②可是温度越低,反应速率越小,达到平衡所需 要的时间越长,因此温度也不宜太低。 ③催化剂要在一定温度下催化活性最大。 综合以上因素:实际生产中温度一般选择在 700K左右(主要考虑催化剂的活性)。
4、浓度怎么定? N2 和H2的比例怎么定?
4.合成氨工业有下列流程:①
原料气制备;②氨的合成;③原 料气净化和压缩;④氨的分离。 其先后顺序为( )
A.①②③④ B.①③ ② ④
C.④③②①
D.②③④①
5、已知2SO2(g)+O2(g) 其实验数据见表
2SO3 (g) △H<0
450℃ 。 (1) 应选用的温度是______ 常压 ,理由是因为常压下 SO2 (2) 应采用的压强是______ ___________ 的转化率已经很高,若采用较大压强,SO2的转化率 __________________________________________ 提高很少,但需要的动力更大,对设备的要求更高。 _______________________________________。
----
50MPa ,是因该条
4.对于反应: 2SO2(g)+O2 (g) 下列判断正确的是( BC )
2SO3 (g)
A.2体积SO2和足量O2反应,必定生成2体积SO3 B.其他条件不变,增大压强,平衡向右移动
C.平衡时, SO2消耗速率必定等于O2的生成速率
的两倍
D.平衡时, SO2浓度必定等于O2浓度的两倍.
选择合适的压强:既要考虑化学反应速率和 化学平衡,还要考虑动力、材料、设备等。
第二课时
二、合成氨工业简述:
高三化学《化学反应条件的优化—工业合成氨》PPT

大水蒸气浓度
D、增大CO浓度
3、在合成氨反应中,入口气体体 积比 N2:H2:NH3 为6:18:1,出口 气体体积比为9:27:8,则H2的转 25% 。 化率为________
N2+3H2 2NH3 起始 6 18 1 变化 X 3X 2X 6-X : 1+2X=9:8 X=1.5 1.5×3 H2转化率= 18 ×100%=25%
化学反应 的方向
合成氨反 应能否自 发进行
怎样能促 使化学平 衡向合成 氨方向移 动 怎样能 提高合 成氨反 应速率
化学工艺学
化学反应 的限度
适 宜 的 合 成 氨 条 件
工 艺 流 程
化学反应 的速率
高压对设备材质、 加工制造的要求、温度 的催化剂活性的影响等
合成氨反应的特点:
N2(g)+3H2(g) (1体积) (3体积) 2NH3(g) ⊿H =-92.4kJ/mol (2体积)
D )
X2Y4 (g)
B.低温 低压 D.高压 低温
8.对于反应: 2SO2(g)+O2 (g) 下列判断正确的是( BC )
2SO3 (g)
A.2体积SO2和足量O2反应,必定生成2体积SO3 B.其他条件不变,增大压强,平衡向右移动
C.平衡时, SO2消耗速率必定等于O2的生成速率
的两倍
D.平衡时, SO2浓度必定等于O2浓度的两倍.
52.0 64.2 71.0 84.2 92.6 25.1 38.2 47.0 65.2 79.8 10.6 19.1 26.4 42.2 57.5
6000C
0.05
4.5
9.1
13.8 23.1 31.4
讨论与交流:能否用过量氮气提高氢气转
D、增大CO浓度
3、在合成氨反应中,入口气体体 积比 N2:H2:NH3 为6:18:1,出口 气体体积比为9:27:8,则H2的转 25% 。 化率为________
N2+3H2 2NH3 起始 6 18 1 变化 X 3X 2X 6-X : 1+2X=9:8 X=1.5 1.5×3 H2转化率= 18 ×100%=25%
化学反应 的方向
合成氨反 应能否自 发进行
怎样能促 使化学平 衡向合成 氨方向移 动 怎样能 提高合 成氨反 应速率
化学工艺学
化学反应 的限度
适 宜 的 合 成 氨 条 件
工 艺 流 程
化学反应 的速率
高压对设备材质、 加工制造的要求、温度 的催化剂活性的影响等
合成氨反应的特点:
N2(g)+3H2(g) (1体积) (3体积) 2NH3(g) ⊿H =-92.4kJ/mol (2体积)
D )
X2Y4 (g)
B.低温 低压 D.高压 低温
8.对于反应: 2SO2(g)+O2 (g) 下列判断正确的是( BC )
2SO3 (g)
A.2体积SO2和足量O2反应,必定生成2体积SO3 B.其他条件不变,增大压强,平衡向右移动
C.平衡时, SO2消耗速率必定等于O2的生成速率
的两倍
D.平衡时, SO2浓度必定等于O2浓度的两倍.
52.0 64.2 71.0 84.2 92.6 25.1 38.2 47.0 65.2 79.8 10.6 19.1 26.4 42.2 57.5
6000C
0.05
4.5
9.1
13.8 23.1 31.4
讨论与交流:能否用过量氮气提高氢气转
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ΔS = -198.2J·K-1·mol-1
ΔH-TΔS
= -92.2kJ·mol-1 - 298K × (-198.2J·mol-1·K-1)
= -33.1kJ·mol-1
ΔH-TΔS < 0
结论 常温时合成氨反应可以自发进行
探究
N2 +3H2
kf kf kr kr
2NH3
已知常温(298K)时: ΔH= -92.2 kJ·mol-1
当时最吸引人的设想有两种。比较两个反应,从工 业化生产的角度考虑,你认为哪一个更适合实现人工固 氮的工业化生产?
N2 + O2 N2 +3H2
=放=电== 2NO
kf kf kr kr
2NH3
K(298K)=3.84×10-31 K(298K)=4.1×106
要实现工业化生产应该满足那些条件?
原料价廉易得 生产效率高 能耗低 对环境友好
任务2 如何提高反应物的平衡转化率?
低温高压
400 ℃ ,500atm
氨 的 体 积 分 数 ( )
压强(atm)
温度(℃) N2与H2的投料比为1:3
%
任务3 如何加快合成氨的反应速率?
温度
压强
v
浓度
催化剂
任务3 如何加快合成氨的反应速率?
根据合成氨反应的特点,你认为应该选择怎样 的催化剂?
1. 反应物的转化率。当时硫酸生产中SO2氧化反应几乎 接近于100 %转化率,而哈伯法合成氨的产率只有8 %。
2. 反应速率。哈伯所找到的两种催化剂分别是锇和铀, 价格高昂,而近900K的高温,也大大增加了能耗成本。
任务2 如何提高反应物的平衡转化率?
反
①可逆反应
应 特
②气体体积减小的反应
点
③正反应是放热反应
反应的快慢
工业化生产应综合考虑反应物的转化率和反 应的速率,取得最佳效益。
推测影响合成氨反应速率的内因是什么?
氮气的稳定性,N≡N 很难断裂,反应所需 的活化能特别高。
研究化学反应的工业化应用,除了 方向和限度,还有什么因素必须考虑?
反应的快慢
可以采取什么措施破坏N≡N ,加快合成氨的 反应速率?
合成氨的工业生产,满足了20世 纪人口快速增长对粮食的需求,因此 人们赞扬哈伯是“用空气制造面包的 圣人”。
虽然哈伯取得了巨大的成功,但人们并不是从此就 高枕无忧了。哈伯法的不足影响着生产的经济效益,使 合成氨的大规模工业化生产仍面临困难。
如何优化合成氨 的反应条件?
哈伯的实验室装置
合成氨工厂模型
使用催化剂
能量
Ea N2、H2 Ea’
无催化剂
有催化剂 NH3 反应历程
[阅读资料]
哈伯在为了寻找高效稳定的催化剂,带领研究小组进 行了多达6500次试验,测试了2500种不同的配方,最后 选定了贵金属锇作为催化剂,使合成氨的设想在1913年 成为工业现实。鉴于合成氨梦想的实现,瑞典皇家科学院 于1918年向哈伯颁发了诺贝尔化学奖。
(鲁科版)选修4 化学反应原理
化学反应条件的优化 ——工业合成氨
[阅读资料]
2007年诺贝尔化学奖授予在表面化
学领域作出了开拓性贡献的德国化学家格
哈德·埃特尔,其主要成就之一是对一个
百年前便得以应用的反应的催化机理研究。
埃特尔也。
格哈德·埃特尔
影响反应物转化率的因素有哪些?
如何增大反应物的平衡转化率?
N2 +3H2
kf kf kr kr
2NH3
ΔH= -92.2 kJ·mol-1
降低温度 增大压强
任务2 如何提高反应物的平衡转化率?
观察下图,寻找合适的投料比。
NH3% 0.6
N2与H2的投料比为1:3
0.5
0.4
0.3
0.2
0.1
1:1 1:2 1:3 1:4 1:5 1:6 N2:H2
ΔS = -198.2 J·K-1·mol-1
ΔH-TΔS = -33.1 kJ·mol-1
K(298K) = 4.1×106
哈伯经过重新计算,纠正了能斯特的错
误,指出常温时合成氨反应可以自发进行, 而且平衡常数很大,可以认为进行完全。
究竟是什么原因阻碍了合成氨反应的应用呢?
研究化学反应的工业化应用,除了 方向和限度,还有什么因素必须考虑?
当时人们选择的人工固氮方法主要是电弧法合成
NO ,效率很低,不能产生较大的经济效益。
N2 + O2 =放=电== 2NO K(298K)=3.84×10-31
N2 +3H2
kf kf kr kr
2NH3
K(298K)=4.1×106
为什么不使用合成氨反应进行固氮?
任务1 探究合成氨反应的可能性
自18世纪以来,许多人致力于合成氨反应的研究,但都 无功而返。20世纪初,著名物理化学家能斯特经过计算得出 结论,认为合成氨的工业化难以实现,理由是合成氨反应很 难自发进行,反应体系中氨的含量很低。你认为呢?请像能 斯特一样,用计算结果说明自己的结论。
升高温度
哈伯进行的试验表明,合成氨的温度必须在1000 ℃以上, 才能达到工业生产所要求的反应速率。你认为这可行吗?
温度 25℃ 350℃ 400℃ 450℃ 600℃ 700℃
K 4×106 1.847 0.507 0.152 0.009 2.6×10-3
如何解决反应速率与转化率的 矛盾?降低反应活化能,提高反应速率还有其他 途径吗?
空气炼金术——合成氨
N2 +3H2
2NH3
百年前的哈伯合成氨实验装置
[阅读资料]
19世纪时,一些有远见的科学家就指出:考虑到将 来的粮食问题,为了使子孙后代免于饥饿,我们必须寄 希望于实现大气固氮。因此将空气中丰富的氮固定下来 并转化为可被利用的形式,成为一项受到众多科学家注 目和关切的重大课题。
N2 +3H2
kf kf kr kr
2NH3
已知常温(298K)时:
ΔH= -92.2kJ·mol-1 ΔS = -198.2J·K-1·mol-1
能斯特(Nernst), 德国物理化学家,获 1920年诺贝尔化学奖。
探究
N2 +3H2
kf kf kr kr
2NH3
已知常温(298K)时: ΔH= -92.2kJ·mol-1
低温高效的催化剂
德国化学工程专家博施,在哈伯成就的基础 上继续前进,找到了比锇更好的催化剂——铁 触媒,使得合成氨反应在700K左右便获得了较 高的反应速率。1913年,博施所在的巴登公司 在全世界第一个实现了合成氨的工业化生产。
博施也因此获得1931年诺贝尔化学奖。 博施(Carl lBosch)
