有机化学_高鸿宾_第四版_第9章_醇和酚
高鸿宾有机化学习题试卷2--17章

3、化合物A的分子式为C16H16,能使溴的四氯化碳溶液和稀的高锰酸钾溶液褪色,A能与等物质的量的H2加成,A用热的高锰酸钾溶液氧化生成二元羧酸C6H4(COOH)2,后者只能生成一种一溴代产物。试推测A所有可能的结构式。
10、BrCH2CH2CH==CHBr ()
11、ClCH2CH2CH2CH2I ()
12、(CH3)3CCH2Br+NaOH ()
13、(CH3)3CCl+NaC≡CH ()
三、理化性质比较题。
1、比较下列化合物熔点的高低:
2、将下列化合物按E1消除反应活性大小排序:
3、比较下列化合物熔点的高低:
6、将甲苯(A)、三苯甲烷(B)和二苯甲烷(C)按酸性大小排列成序。
7、将下列化合物按环上亲电取代速率大小排列成序:
四、基本概念题。
1、下列芳烃化学活性最大的是:
2、对芳香亲电取代反应的活性中间体贡献最大的共振结构式是:
3、下列化合物具有芳香性的是:
五、有机合成题。
1、以甲苯和乙炔为原料(无机试剂任选)合成:
2、以苯乙烯为原料(其它试剂任选)合成(Z)-1-苯基丙烯:
3、以甲苯为原料(其它试剂任选)合成:
4、以苯和乙醇为原料(无机试剂任选)合成:
六、推导结构题。
1、化合物A,分子式为C9H12,核磁共振谱数据为:δ=2.25单峰,δ=6.78单峰,相应的峰面积之比为3∶1。试推测A的构造式。
2、化合物D(C9H10)的核磁共振谱有三组峰:
第二章饱和烃
一、命名下列各物种或写出结构式。
1、(4-甲基环己基)甲基自由基
《有机化学》习题答案(高鸿宾第四版)解析

第一章 习 题2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20i) (一) 用简单的文字解释下列术语:(1)有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9) sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
ii) (二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1) C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) C HHH H H。
有机化学(第四版)习题解答

高鸿宾(主编)有机化学(第四版)习题解答化学科学学院罗尧晶编写高鸿宾主编《有机化学》(第四版)作业与练习第二章饱和烃:烷烃和环烷烃练习(P60—62):(一的1,3,5,7,9,11小题)、(五)、(六)、(十三)第三章不饱和烃:烯烃和炔烃作业:(P112—117):(二)、(四)、(七)、(十一)、(十五的2,3小题)、(十六的2~5小题)、(二十一)第四章二烯烃共轭体系练习:(P147—149):(三)、(十)、(十一)、(十三)第五章芳烃芳香性作业:(P198—202):(二)、(三)、(九)、(十)、(十六)、(十七)、(十八的2、5~10小题)、(二十四)第六章立体化学练习:(P229—230):(五)、(六)、(七)、(十二)第七章卤代烃作业:(P263);(P290-295):(P263):(习题7.17)、(习题7.18)、(习题7.19)。
(P290-295):(六)、(七)、(八)、(十的1、2、5小题)、(十三的1、2小题)、(十四的1、2小题)第九章醇和酚作业:(P360—362):(二)、(三的2、4小题)、(五)、(九的1、3小题)第十一章醛、酮和醌作业:(P419—421):(一)、(三)、(七题的1—9小题)、(十三)、(十四)第十二章羧酸练习:(P443—444):(一)、(三)、(五)、(七)第十三章羧酸衍生物练习:(P461—464):(一)、(四)、(六)、(七)(八题的1、3小题)、第十四章β-二羰基化合物作业:(P478—480):(一)、(五)、(七)第十五章有机含氮化合物作业:(P526—530):(三)、(四)、(八)、(十一)第二章 烷烃和环烷烃 习题解答(一)题答案:(1) 3-甲基-3-乙基庚烷 (2)2,3 -二甲基-3-乙基戊烷 (3)2,5-二甲基-3,4 -二乙基己烷 (4)1,1-二甲基-4-异丙基环癸烷 (5)乙基环丙烷 (6)2-环丙基丁烷 (7)1,5-二甲基-8-异丙基二环[4.4.0]癸烷(8)2-甲基螺[3.5]壬烷 (9)5-异丁基螺[2.4]庚烷 (10)新戊基 (11)2′-甲基环丙基 (12)1′-甲基正戊基(四)题答案:(1)的透视式: (2)的透视式: (3)的透视式:Cl HCH 3H 3C ClHCH 3CH 3ClHHCH 3Cl ClCH 3H H(4)的投影式: (5)的投影式:BrBr CH 3HH H 3CBrBr CH 3CH 3HH(五)题解答:都是CH 3-CFCl 2的三种不同构象式; 对应的投影式依次分别如下:ClClClClClClFFFHH H H H H H H ( )( )( )123验证如下:把投影式(1)的甲基固定原有构象位置不变,将C-C 键按顺时针方向分别旋转前面第一碳0°、60°、120°、180°、240°得相应投影式如下:ClCl ClClClClClCl ClFF FF F H HH H H HHH H H H H HH H ( )( )( )( )( )ab c de各投影式对应的能量曲线位置如下:由于(a )、(c )、(e )则为(1)、(2)、(3)的构象,而从能量曲线上,其对应能量位置是一样的,所以前面三个透视式只是CH 3-CFCl 2的三种不同构象式。
有机化学_高鸿宾_第四版_答案__第九章 醇和酚习题
NO2 )具有最小的 pKa 值。
(六) 完成下列反应式,并用 R,S-标记法命名所得产物。
(1) (R)-2-己醇
浓HX SN2
CH3
解:
H C OH CH3(CH2)3
(R)-2-己醇
浓HX SN2
CH3 C X H (CH2)3CH3
(S)-2-卤己烷
浓HX
(2) (R)-3-甲基-3-己醇
C2H5 H3C C OH 解: CH3(CH2)2
归属 O–H(酚)伸缩振动 苯环上对二取代
Cl Cl O O Cl Cl
2,3,7,8-TCDD 是二恶英类化合物中毒性最强的一种,其毒性比 NaCN 还大,且 具有强致癌性,以及生殖毒性、内分泌毒性和免疫毒性。由于其化学稳定性强, 同时具有高亲脂性和脂溶性,一旦通过食物链进入人和动物体内很难排出,是 一种持续性的污染物, 对人类危害极大。 因此, 有的国家已经控制使用 2,4,5-T。 试写出由 1,2,4,5- 四氯苯,氯乙酸及必要的原料反应,分别生成 2,4,5-T 和 2,3,7,8-TCDD 的反应式。
Cl OH + 2 Cl2
乙酸
OH Cl Cl Cl
Cl
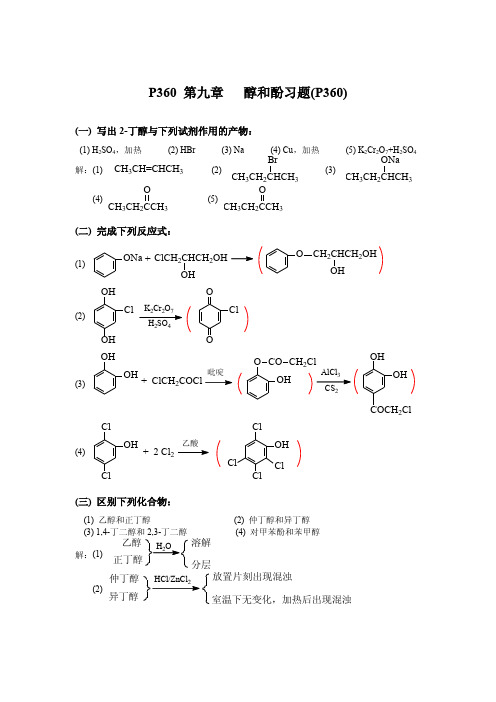
(三) 区别下列化合物:
(1) 乙醇和正丁醇 (3) 1,4-丁二醇和 2,3-丁二醇 (2) 仲丁醇和异丁醇 (4) 对甲苯酚和苯甲醇
乙醇
解:(1)
H2O
溶解 分层 放置片刻出现混浊 室温下无变化,加热后出现混浊
正丁醇 仲丁醇
HCl/ZnCl2
CH3CH2CHCH2CH3 OH
PBr3
CH3CH2CHCH2CH3 Br
CH3CH2CHCH2CH3 OH
TsCl 吡啶
高鸿宾《有机化学》(第四版)复习提纲-48...2021年有机化学

有机化学复习提纲教材:高鸿宾主编《有机化学》(第四版)化学与化工学院李秀华编稿第一章绪论1、有机化合物的定义。
2、碳原子的SP、SP2、SP3杂化轨道的杂化原理和共价键的构成方式。
3、诱导效应的概念。
4、酸碱的概念。
第二章饱和烃:烷烃和环烷烃1、烷烃、脂环烃的命名。
2、环烷烃的环结构与稳定性的关系。
3、烷烃的卤代反应历程(自由基型取代反应历程)。
4、烷烃的卤代反应取向与自由基的稳定性。
5、脂环烃的取代反应。
6、脂环烃的环的大小与开环加成活性关系。
7、取代环丙烷的开环加成规律。
第三章不饱和烃:烯烃和炔烃1、碳-碳双键、碳-碳三键的组成。
2、π键的特性。
3、烯烃、炔烃的命名;烯烃的Z,E-命名法,4、烯烃、炔烃的加氢催化原理及其烯烃、炔烃的加氢反应活性比较。
5、炔烃的部份加氢——注意区分顺位部分加氢和反位部分加氢的条件或试剂。
6、何谓亲电加成?(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高,亲电加成活性越大)7、烯烃、炔烃可以与哪些试剂进行亲电加成,这些加成有哪些应用。
8、亲电加成反应规律(MalKovniKov规律)。
9、烯烃、炔烃与HBr的过氧化物效应加成及其规律。
(惟一只有溴化氢才能与烯烃、炔烃存在过氧化物效应,其它卤化氢不存在过氧化物效应。
)10、烯烃亲电加成与炔烃亲电加成活性的比较。
11、不同结构的烯烃亲电加成活性的比较——不饱和碳上电子密度越高的烯烃或越容易生成稳定碳正离子的烯烃,亲电加成反应的活性越大。
12、碳正离子的结构和碳正离子的稳定性之间的关系——正电荷越分散,碳正离子就越稳定。
13、碳-碳双键的α-碳上有支链的烯烃与卤化氢加成时的重排反应。
(P88)14、烯烃与次卤酸加成及加成规律。
炔烃与水加成及重排产物。
15、烃炔与HCN的亲核加成规律及其应用。
16、烯烃的环氧化反应。
17、烯烃α-氢的氯代和溴代反应。
(烯烃α-氢的卤代与双键加成反应条件不同)18、金属炔化物的生成及其在增长碳链上的应用。
有机化学(高鸿宾 第四版)第九章__氨基化

NH3
ArCOONH2
H2O
ArCONH2 NaOH
H2 cat R1
NaBrO
ArNH2
(4)还原胺化法
R1 O R2(H)
+
NH2R R2(H)
NHR
9.1 概述
2.氨基化反应的目的
制备脂肪族伯、仲、叔胺及季铵盐
ClCH2CH2Cl +
N(C2H5)3 + ClCH2
H2O NH3 ~2MPa
(1)液氨 (1)液氨
氨的物性: ①常温常压下是气体 ②压力下可溶解许多液态有机化合物
适用范围: ①有机化合物在反应温度下是液态 ②氨解反应要求在无水有机溶液中进行 缺点: ①操作压力高, ②过量的液氨较难再以液态氨的形式回收。
Cl CN NH2 NH3(liquid) CN
液氨主要用于需要避免水 解副反应的氨基化过程。
•③减少对设备的腐蚀
HX + NH3
腐蚀
NH4X
3.温度
温度升高→反应速度加快 氧化副反应速度加快; NH3的溶解度降低,反应压力增加。 有时为了加快氨解速度或为了减少卤基水解副反应,需要使用 浓度更高的氨水。但使用浓度更高的氨水时,在相同的温度下, 压力要提高很多。如下表: 温度/oC 10 20 压力/Mpa
CH3 CH CH3
• •
间硝基甲苯的还原法的缺点:在甲苯的一硝化产物 中,间位体的含量只有4%左右, 间甲酚的氨解法:原料间甲酚是由间甲基异丙苯的 氧化酸解法制得。
二.萘酚衍生物的氨解
机理
1.Bucherer(布赫尔)反应
H H C=C加成 O H H H SO3NH4 酮式加成物 H H C=O加成 OH 2 NH SO3NH4 H H H SO3NH4 胺式加成物 -2NH4HSO3 H H OH SO3NH4 醇式加成物
《有机化学1A》和《有机化学1B》教学大纲
《有机化学1A》和《有机化学1B》教学大纲课程编号:2100300,2100301学时:96学时(讲课:96 学时,实验:0 学时)学分:6授课学院:天津大学理学院, 药学院,化工学院,材料学院,环境学院适用专业:化学、药学、应用化学、材料化学、环境科学教材:《有机化学》(第四版)主编:高鸿宾出版社:高等教育出版社出版时间:2005年5月主要参考资料:[1]Solomons T W G,Fryhle C B.Organic Chemistry[M].10th ed.Hoboken:John Wiley &Sons,Inc,2011.[2]Carey F A, Giuliano R M.Organic Chemistry[M].8th ed.New York:McGraw-HillCompanies,Inc,2010.[3]McMurry J.Organic Chemistry[M].7th ed.Belmont:Brooks/Cole Publishing Company,2008.[4]Peter K,V ollhardt C,Schore N E.Organic Chemistry: Structure and Function.4th ed.戴立信,席振峰,王梅祥,等译.有机化学:结构与功能[M].北京:化学工业出版社,2006.[5]邢其毅,裴伟伟,徐瑞秋,等.基础有机化学上下册[M].3版.北京:高等教育出版社,2005.[6] 张文勤, 郑艳, 马宁, 赵温涛. 《有机化学》(第五版).北京:高等教育出版社,2014.一.课程性质、目的和任务有机化学是化学、化工类及其相关专业本科生的必修基础课,主要讲授有机化合物的结构、性质及其相互转化的规律。
通过本门课程的学习,使学生掌握有机化学的基本概念、基本理论、基本有机反应及有机化合物结构与性能之间的关系,了解常见有机化合物在化工生产中以及人们日常生活中的地位和作用,提高学生的认知能力,培养学生的创新思维能力。
有机化学-第九章
有机化学 第九章 醇和酚
30
醇和酚的化学性质
1. 共性 (羟基官能团的作用)(9.6) 2. 醇的个性(9.7) 3. 酚的个性(9.8)
::
碱性
α
R
RCOH
H α H 的反应
酸性 羟基被取代
有机化学 第九章 醇和酚
O H
31
1. 共性
1) 弱酸性 2) 醚的生成 3) 酯的生成 4) 氧化反应 5) 酚类和烯醇化合物的显色反应
NH2
有机化学 第九章 醇和酚
17
3. 其他制备方法
(1) 卤代烷的水解 (9.3.3)
CH2Cl Na2CO3 , H2O
95℃
(2) 重氮盐的水解 (9.3.3)
CH2OH (74%)
原理见7.5, 7.12
NH2
NaNO2, H2SO4
NO2
0~5℃
N2+
H3+O,△
NO2
OH NO2
有机化学 第九章 醇和酚 原理见15.3
有机化学 第九章 醇和酚
32
1) 弱酸性 相对酸性:
表9.1 一些弱酸的pKa 值
酸
pKa
C6H5OH CH3OH
H2O CH3CH2OH (CH3)3COH
HC CH H2 NH3 CH3CH3
9.89
15.5 15.74 15.9 18.0 25 35 38 50
ArOH > ROH > RC CH > 有机化学 第九章 醇和酚
CH3
(4) 发酵法
乙醇的制备:
淀粉 淀粉酶 麦芽糖 麦芽糖酶 葡萄糖
酒化酶 酒精
有机化学 第九章 醇和酚
有机化学上第九章 醇和酚
OH OH OCH3 邻甲氧基苯酚 o-甲氧基苯酚
OH COOH 邻羟基苯甲酸
萘酚 萘酚
OH 对羟基苯甲醛
(二) 醇和酚的结构
醇分子中氧原子采取不等性sp3杂化,具有四面体结构:
2 O£2s 2p £ 4
Ó Ô º s p sp3
H
O R
由于氧的电负性大于碳,醇分子中的C-O键是极性 键,ROH是极性分子。
H2O/H+
OH R'-C R R" ££ OH R'-CH-R R-CH2-OH
££
´ £££££££ ´ £££££££
R-CH2-CH2-OH
例:
O CH3(CH2)3MgCl + CH3-C-CH3
(1) 干醚 (2) H2O/H+
OH CH3CH2CH2CH2-C-CH3 CH3
(4) 醛、酮、羧酸和羧酸酯的还 原
£ °££
NaBH4/H+
CH3CH£CHCH2OH £
£ °££
¥ Ý ³º õ È Ò ± Na+C2H5OHº Ô £ µ ® Ò ´ º » Ç £ ¸ « ª © º ³ß Ó â ¹ O Na+C2H5OH R£C£OR' £ £ R£CH2OH + R'OH £ £ ¨1 ££ £ O H2£Ni R£C£OR' £ £ R£CH2OH + R'OH £ ££ £ ¨1 ££ £
HO OH HO OH HO OH
苯酚(一元酚)
对苯二酚(二元酚) 均苯三酚(三元酚)
②醇还可按与-OH相连的碳原子的类型分:伯、仲、叔醇
CH3CH2CH2CH2OH ¬ » ® ´ OH CH3CH2CHCH3 Ù » Ö ´ CH3 CH3£C£OH £ CH3 å » Ê ´
9《有机化学》(第四版)高鸿宾_华南理工大学课件(共十四章)
(3) 羰基合成
钴催化剂 CH3CH CH2 + CO + H2 130~175℃ ~25 MPa
CH3CH2CH2CHO + CH3CHCHO
CH3
H2, Ni 或 Cu △,~5 MPa
CH3CH2CH2CH2OH + CH3CHCH2OH CH3
(4) 发酵法 乙醇的制备: 淀粉
淀粉酶
麦芽糖 麦芽糖酶 葡萄糖
OH OH HO OH OH
叔醇
酚:按分子中所含羟基的数目分类:
OH
一元酚
二元酚
三元酚
9.1.2 醇和酚的命名
(1) 醇的命名 (a) 普通命名法:——用于简单的醇。 烃基的名称 + ―醇”
CH3 CH3 CHCH2OH
CH2 CHCH2 OH
CH2OH
异丁醇
烯丙醇
苯甲醇 苄醇
CH2=CHCH2OH
R2SO4 + H2O 2 ROH + H2SO4 △ O O + H ROH + R-C-OH △ R-C-OR + H2O
ROH + CH3 ( TsCl)
δ+
SO2Cl
N
△
O RO-S CH3 + O ( ROTs)
N
. HCl
ROO2S
二甲亚砜
CH3 KCN RCN + CH3 SO3K ( TsK) NaBr RBr + TsONa
弱酸 H2CO3 PKa值 6. 38
9. 89 15.5
弱酸
PKa值
15 .74 15.9 18.0 25.0
OH CH3OH
H2O CH3CH2OH (CH3)3COH HC≡CH
醇和酚的相对酸性: 碳酸>苯酚>水>乙醇
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14
CH3
② 间接水合
CH3 CH3 C CH2 98%H2SO4 CH3 CH3 C CH3 OSO3H H2O CH3 CH3 C OH CH3
• 有重排产物
CH3 CH3 C CH3 H+ CH3 CH3 C CH3 CH
ONa H+ OH
SO3Na + NaOH
同上
ONa H+
OH
21
9.3.3 卤代烃或重氮盐的水解 • 相应的卤烃易得到时用此法
CH2 H2O CH2 CHCH2Cl NaOH
Na2CO3 H2O N2+ Br
NaNO2
CHCH2OH
CH2OH
CH2Cl
NH2 dil H2SO4
OH Br
H ,H2O
24
=>
(2) 二级醇的合成 • 羰基化合物是醛和甲酸酯
CH3 H3C C CH2 H H C H MgBr H3C C O H CH3 CH3 CH CH2 CH2 CH3 C O H MgBr
CH3 CH3 CH CH2 CH2
CH3 C O H H
HOH
CH3 CH2 4 CH2MgBr + CH3CH 纯醚 O
Cl2/H2O 70-80 。 C CH2 CH2
副产物多,环境污染重 Ca(OH)2 —HCl O2 Ag C 250-280。 CH2 O CH2 H2O CH2 OH 常用 CH2 OH
16
② 制丙三醇(甘油)
CH2=CHCH3 Cl2 。 500 C CH2=CHCH2Cl
CH2 Cl CH OH CH2 Cl CH2 OH CH Cl CH2 Cl
OH OH
5-甲基-2-异丙基苯酚
2-萘酚
OH CH=CH2
对乙烯基苯酚
间苯二酚
9
③ 服从多官能团化合物命名原则
CH2CH2OH NH2 CH3CHCOOH OH
2-氨基乙醇
OH
2-羟基丙酸
OH
OCH3
CHO
对甲氧基苯酚 对羟基苯甲醛
10
9.2 醇和酚的结构 9.2.1醇的结构
• C、O都是sp3杂化,键舒展,结构稳定 • 电负性O > C,OH为吸电子基
原
RCH2OH
+
CH3CH2OH
双 键
强
1. LiAlH4/乙醚 2. H2O
CH3CH2OH H C C H OH C
29
Ni(Pt,Pd) H2
H
30
9.6 醇和酚的化学性质-醇和酚的共性 O H 9.6.1 弱酸性 R
ph 类似于酸
(1) 醇与活泼金属的反应
ROH + Na K,Mg,Al 放热少于后者 销毁残余Na 引烷氧基试剂 活性(酸性):甲醇>伯醇>仲醇>叔醇 因为烷基的供电性使RO - 不稳定 烷基的诱导效应见P434
Cl2/H2O
Ca(OH)2 CH2 CH O CH2 Cl 10%Na2CO3 CH2 OH CH OH CH2 OH
17
(3) 羰基合成 • 又称烯烃的氢甲酰化 • 金属羰基化合物作催化剂,加热加压下,烯烃 与CO和H2作用,得到双键在链端,多一个碳 原子的醛,还原生成伯醇
八羰基二钴 [Co(CO)4]2 110~200 ° C 10 ~20Mpa 4 H2,Ni或Cu 130 160 。 C 3 5 MPa :
HOH
=>
26
9.3.5 由烯烃制备 • 硼氢化-氧化反应 • 顺式加成,反马氏规则,可制伯醇 • 无重排产物(不生成碳正离子)
(BH3)2 THF CH3
CH3 3
B
H2O2 _ OH
CH3 OH
27
9.3.6 羰基化合物的还原 • 醛、羧酸、酯还原成伯醇 • 酮还原成仲醇
28
CH3CH 巴豆醛 难 还 原 R
(3) 官能团异构
CH3CH2CH2CH2OH CH3CH2CH2
CH OH
O CH3
(4) 互变异构
CH3CH
CH3CH2CH O
5
9.1.3 醇和酚的命名 (1) 习惯(普通)命名法 • 按烃基的习惯名称,后面加一醇或酚字
CH3CHCH2CH3 OH CH3 异丁醇 间甲苯酚 OH
(2) 系统命名法
Cl
工业制苯酚 NO2
NO2 Cl NO2 NO2 Na2CO3,H2O,湿热 H2O/H
+
NO2 OH NO2 NO2
NO2
NO2 2,4,6-三硝基苯酚 苦味酸
20
(3) 碱熔法
SO3Na 亲核取代 300-320摄氏度 + NaOH 共熔 不含-X:被OH- 取代
SO3Na 磺化 萘 。 <80 C 磺化 。 165 C + NaOH 同上 ONa H+ OH
H2SO4
CH2ONO2 100 C
0
CHONO2 CH2ONO2
3H2O
甘油三硝酸酯(硝化甘油) • 炸药(硝化火棉):受热受震动后爆炸 • 心血管药:扩张小动脉和冠状动脉
38
③ 磷酸
3CH3CH2CH2CH2OH POCl3
吡啶
(CH3CH2CH2CH2O)3PO 3HCl
磷酸三丁酯 • 萃取剂 • 增塑剂: 可以在一定程度上与聚合物混溶的低 挥发性有机物。增加成型时的可塑性、流动性 和柔韧性
+
CH
CH2
稀H2SO4 H2O
CH3 CH3 C CH CH3 OH CH 3 H+
CH3 CH3 重排 CH3 C
+
.. H2O CH CH3 CH3 CH3
CH3 C + H2O CH CH3
15
CH3
(2) 烯烃环氧化-水解 ① 制乙二醇(甘醇)
CH2 Cl CH2 OH H2O/ NaHCO3 CH 2 C 105-110。 OH CH2 OH
• 酚的酸性较强,可在碱性溶液中直接反应
OH (CH3)2SO4 NaOH,H2O 70 - 80。 84% C OCH3
2-甲氧基萘 橙香香精
34
9.6.3 酯的生成 • 醇(酚)与酸作用生成酯和水的反应,称为酯化反应 (1) 醇酯 • 氢氧键断裂,分子间脱水,生成无机酸酯 ① 硫酸
O CH3OH H2SO4 CH3OSOH H2O O 硫酸氢甲酯(酸性 硫酸甲酯)
H2O,H+ ,84%
CH3(CH2)4CH2CHCH3
=>
OH
25
(3) 三级醇的合成 • 羰基化合物是酮和酯
CH3 H3C C CH2 H
H C H MgBr
H3C C O H3C CH3
CH3 CH CH2 CH2
CH3 C O CH3 MgBr
CH3 CH3 CH CH2 CH2
CH3 C O H CH3
• 羰基化合物必须是甲醛
RMgX + HCH O
H MgBr C O H CH3 CH3 CH CH2 CH2 H C O H MgBr
醚
H+/H2O RCH2OMgX RCH2OH + Mg
OH X
CH3 H3C C CH2 H
H C H
CH3 CH3 CH CH2 CH2
H C O H H
HOH
39
④ 有机酸及其衍生物
CH3OH CH3COOH H CH3COOCH3 乙酸甲酯
31
RONa + H2
HOH + Na 酸性比醇强
NaOH + H2
• 工业上生产醇钠,免用较贵的金属钠
RONa 强碱
HOH 强酸
ROH 弱酸
NaOH 弱碱
苯(74 .1%)-醇(18.5%)-水(7.4%) 三元共沸物 bp 64.9℃
32
(2) 酚的酸性
O
• P、π共轭,有利于H以质子形式离去 • 苯氧负离子上的负电荷分散到共轭体系,酸性 比醇强
减压蒸馏
O CH3OSOCH3 H2SO4 O 硫酸二甲酯
烷基化试剂
35Biblioteka CH3OSO2OHHOSO2OCH3
O CH3CH2 O H + HO S O
O CH3CH2 O S O CH3 => + HOH
CH3
O HO S OH O
O CH3CH2O H + HO S O OCH2CH3
+ H O CH2CH3
O2/air 110-120摄氏度 过氧化物或紫外线 (自由基反应)
OH + CH3CCH3 O 1 : 0.6 (重量比)
19
(2) 芳卤衍生物的水解
Cl 10%NaOH,Cu粉 370。,200MPa C ONa H2O/H+ OH NO2 Na2CO3,H2O,130。 H2O/H+ C Cl NO2 C Na2CO3,H2O,100。 H2O/H+ OH NO2 容 易 进 行 OH
CH3CH2CH2CH2OH CH3CHCH2CH3 OH CH3 CH3 C OH CH3
9.1.2 醇和酚的构造异构 (1) 碳链异构
CH3CH2CH2CH2OH CH3
CH3 C OH CH3
4
(2) 官能团位置异构
CH3CH2CH2CH2OH CH3CHCH2CH3 OH
HO OH OH OH
6
①醇 • 选择含羟基碳原子的最长碳链为主链,按碳原子 数称为某醇;不饱和醇应包含不饱和键 • 主链上的碳原子从靠近羟基的一端编号,羟基在 端位时,“1”字可省略 • 将支链的位次、名称及羟基的位次在名称前注明
