有机化学高鸿宾第四版答案
《有机化学》第四版(高鸿宾)课后习题答案 高等教育出版社
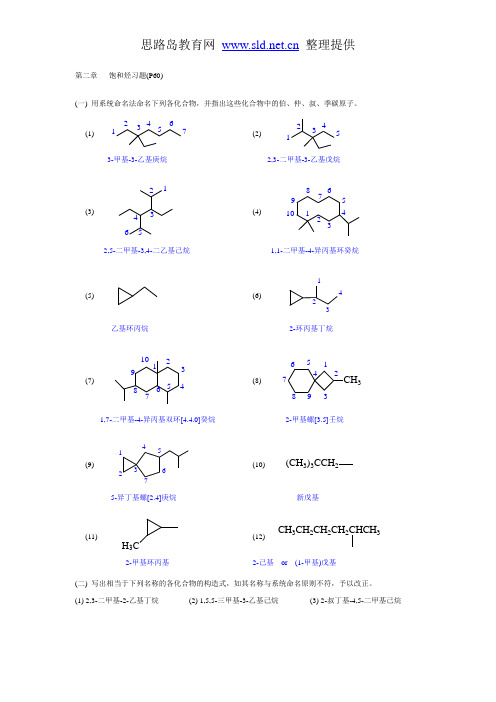
第二章饱和烃习题(P60)(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) 1234567(2)123453-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3)123456(4) 101234567892,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5) (6)1234乙基环丙烷2-环丙基丁烷(7)12345678910(8)123456789CH3 1,7-二甲基-4-异丙基双环[4.4.0]癸烷2-甲基螺[3.5]壬烷(9)1234567(10) (CH3)3CCH25-异丁基螺[2.4]庚烷新戊基(11)H3C (12)CH3CH2CH2CH2CHCH32-甲基环丙基2-己基or (1-甲基)戊基(二) 写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。
(1) 2,3-二甲基-2-乙基丁烷(2) 1,5,5-三甲基-3-乙基己烷(3) 2-叔丁基-4,5-二甲基己烷CH 3CCHCH 3CH 3CH 3CH 2CH 3CH 2CH 2CHCH 2C CH 3CH 3CH 3CH 3C 2H 5CH 3CCH 2CH C(CH 3)3CH 3CHCH 3CH 32,3,3-三甲基戊烷 2,2-二甲基-4-乙基庚烷 2,2,3,5,6-五甲基庚烷(4) 甲基乙基异丙基甲烷(5) 丁基环丙烷(6) 1-丁基-3-甲基环己烷CH CH 3CH 2CH 3CHCH 3CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 32,3-二甲基戊烷1-环丙基丁烷1-甲基-3-丁基环己烷(三) 以C 2与C 3的σ键为旋转轴,试分别画出2,3-二甲基丁烷和2,2,3,3-四甲基丁烷的典型构象式,并指出哪一个为其最稳定的构象式。
解:2,3-二甲基丁烷的典型构象式共有四种:( I )( II )( III )CH 33CH 3CH 33CH 33CH (最稳定构象)( IV )(最不稳定构象)( III )( II )CH 33H 3CH 3H3CH 3CH2,2,3,3-四甲基丁烷的典型构象式共有两种:3H 333H 33CH 333(最稳定构象)( I )( II )(四) 将下列的投影式改为透视式,透视式改为投影式。
有机化学_高等教育出版社_高鸿宾_第四版_课后习题答案

第一章 习 题(一) 用简单的文字解释下列术语:(1) 有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7) 均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9)sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1)C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) C HHH H H。
有机化学高鸿宾第四版答案

第一章(一) 用简单的文字解释下列术语:(1) 有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9) sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1)C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1)HH H H。
《有机化学》(第四版 高鸿宾)答案

``第二章饱和烃习题(P60)(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) 1234567(2)123453-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3)123456(4) 101234567892,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5) (6)1234乙基环丙烷2-环丙基丁烷(7)12345678910(8)123456789CH3 1,7-二甲基-4-异丙基双环[4.4.0]癸烷2-甲基螺[3.5]壬烷(9)1234567(10) (CH3)3CCH25-异丁基螺[2.4]庚烷新戊基(11)H3C (12)CH3CH2CH2CH2CHCH32-甲基环丙基2-己基or (1-甲基)戊基(二) 写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。
(1) 2,3-二甲基-2-乙基丁烷(2) 1,5,5-三甲基-3-乙基己烷(3) 2-叔丁基-4,5-二甲基己烷CH 3CCHCH 3CH 3CH 3CH 2CH 32CH 2CHCH 2C CH 3CH 33CH 32H 5CH 32CH C(CH 3)333CH 32,3,3-三甲基戊烷2,2-二甲基-4-乙基庚烷 2,2,3,5,6-五甲基庚烷(4) 甲基乙基异丙基甲烷(5) 丁基环丙烷(6) 1-丁基-3-甲基环己烷CH CH 3CH 2CH 3CHCH 3CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 32,3-二甲基戊烷 1-环丙基丁烷 1-甲基-3-丁基环己烷(三) 以C 2与C 3的σ键为旋转轴,试分别画出2,3-二甲基丁烷和2,2,3,3-四甲基丁烷的典型构象式,并指出哪一个为其最稳定的构象式。
解:2,3-二甲基丁烷的典型构象式共有四种:( I )( II )( III )CH 33CH 333CH 33CH (最稳定构象)( IV )(最不稳定构象)( III )( II )CH 3CH 3H 3CH 3H3CH 3CH2,2,3,3-四甲基丁烷的典型构象式共有两种:3H 333H 33CH 333(最稳定构象)( I )( II )(四) 将下列的投影式改为透视式,透视式改为投影式。
有机化学高鸿宾第四版答案

第一章(一) 用简单的文字解释下列术语:(1)有机化合物:碳氢化合物及其衍生物。
(2)键能:形成共价鍵时体系所放出的能量。
(3)极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4)官能团:决定有机化合物的主要性质的原子或原子团。
(5)实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6)构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8)异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9)sp2杂化:由1 个s轨道和2个p轨道进行线性组合,形成的3个能量介于s轨道和p轨道之间的、能量完全相同的新的原子轨道。
sp2杂化轨道的形状也不同于s轨道或p轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10)诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11)氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol。
(12)Lewis酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis结构式。
(1) C H3N H2(2) C H3O C H3(3) CH3C OHO(4) C H3C H=C H2(5) C H3C C H(6) CH2O解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis结构式如下:(1)HH H H。
N 。
(2)H H 。
有机化学 第四版 高鸿宾编 高等教育出版社 课后习题答案

(1) 有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7) 均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9)sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12)Lewis 酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1)C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) C HHH H H。
《有机化学》习题答案(高鸿宾第四版)解析
第一章 习 题2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20i) (一) 用简单的文字解释下列术语:(1)有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9) sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
ii) (二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1) C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) C HHH H H。
高鸿宾有机化学(第4版)知识点笔记课后答案
第1章绪论1.1复习笔记一、有机化合物和有机化学1.有机化合物有机化合物是指碳氢化合物及其衍生物。
2.有机化学有机化学是研究有机化合物的组成、结构、性质及其变化规律的科学。
二、有机化合物的特性1.有机化合物的结构有机化合物可通过单键、双键、三键形成链状或环状结构,且异构现象普遍。
2.有机化合物的性质(1)可燃烧;(2)熔点低;(3)大多难溶于水;(4)反应速率一般较小。
三、分子结构和结构式1.分子结构分子结构是指分子组成原子的排列顺序和相互关系。
2.结构式结构式是表示分子结构的化学式,一般有短线式、缩简式和键线式三种。
如表1-1 所示。
表1-1 几种常用的结构式四、共价键1.共价键的形成(1)共价键的定义共价键是指原子间通过电子对共用形成稳定电子构型的键。
(2)共价键的分类①单键:共用一对电子;②双键:共用两对电子;③三键:共用三对电子。
乙烯乙炔(3)共价键的形成理论①价键理论x y zx y z当成键原子具有自旋反平行的未成对电子时,它的原子轨道相互交盖形成共价键。
氢原子 轨道交盖 氢分子图1-1 氢原子的s 轨道交盖形成氢分子②轨道杂化理论以碳原子为例,价电子层电子构型为2s 22p 1 2p 1 2p 0 的碳原子在成键过程中,吸收能量后2s 轨道的一个电予跃迁到空的2p z 轨道,形成2s 12p 1 2p 1 2p 1 (激发态), 外层能量相近的2s 轨道和2p 轨道进行杂化组成能量相等的几个新轨道。
a. 碳原子轨道的sp 3杂化在轨道杂化过程中,2s 轨道和三个2p 轨道进行杂化形成四个能量相等的杂化轨道,如图1-2所示。
原始的原子轨道(基态) 激发态 sp 3杂化轨道图1-2 碳原子的sp3杂化b. 碳原子轨道的sp 2杂化在轨道杂化过程中,2s 轨道和两个2p 轨道进行杂化形成三个能量相等的杂化轨道,如图1-3所示,双键碳原子一般是sp 2杂化。
图1-3 碳原子的sp2杂化c. 碳原子轨道的sp 杂化在轨道杂化过程中,2s 轨道和一个2p 轨道进行杂化形成两个能量相等的杂化轨道,如图1-4所示,三键碳原子一般是sp 杂化。
有机化学第四版答案_高鸿宾主编
(九) 化合物(A)的分子式为 C6H14O,其 1HNMR 谱图如下,试写出其构造式。
CH3 CH3 CH3 CH O CH CH3
ab
第十一章 醛、酮和醌
(一) 写出丙醛与下列各试剂反应时生成产物的构造式。
解:
(1) NaBH4,NaOH 水溶液 (3) LiAlH4 , 然后加 H2O (5) NaHSO3 , 然后加 NaCN (7) OH - , H2O , 然后加热
C H 2 O H S O C l 2
C H 2 C l M g
d r y e t h e r
O
C H 2 M g C l H 2 O / H +
(1 ) N a
C H 2 C H 2 C H 2 O H (2 ) C 2 H 5 B r
C H 2 C H 2 C H 2 O C 2 H 5
(5)
及CH3CH2OH
O
C H 3 H 3CCC H 2 O C H 3
O H
C H 3
C H 3
C H 3
解:H 3 C CC H 2C H 3 O - H 3 C C C H 2O C H 3C H 3 O H H 3 C C C H 2O C H 3
O
O
O H
O
(3)
H 2SO 4,TH F
O
解:
O
H + O H
O H
C H 3
C H 3
解:(1) H 2 CCC H 3H + H 2 CCC H 3
C H 3 C H 3 O H H 2 CCC H 3
O
O H
CH3
CH3
H2C C CH3 -H+ HOCH2 C CH3
有机化学答案(第四版)+高鸿宾主编
第二章饱和烃习题(P60)(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) 1234567(2)123453-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3)123456(4) 101234567892,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5) (6)1234乙基环丙烷2-环丙基丁烷(7)12345678910(8)123456789CH3 1,7-二甲基-4-异丙基双环[4.4.0]癸烷2-甲基螺[3.5]壬烷(9)1234567(10) (CH3)3CCH25-异丁基螺[2.4]庚烷新戊基(11)H3C (12)CH3CH2CH2CH2CHCH32-甲基环丙基2-己基or (1-甲基)戊基(二) 写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。
(1) 2,3-二甲基-2-乙基丁烷(2) 1,5,5-三甲基-3-乙基己烷(3) 2-叔丁基-4,5-二甲基己烷CH 3CCHCH 3CH 3CH 32CH 3CH 2CH 2CHCH 2C CH 3CH 3CH 3CH 3C 2H 5CH 3CCH 2CH C(CH 3)3CH 3CHCH 3CH 32,3,3-三甲基戊烷2,2-二甲基-4-乙基庚烷 2,2,3,5,6-五甲基庚烷(4) 甲基乙基异丙基甲烷(5) 丁基环丙烷(6) 1-丁基-3-甲基环己烷CH CH 3CH 2CH 3CHCH 3CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 32,3-二甲基戊烷1-环丙基丁烷 1-甲基-3-丁基环己烷(三) 以C 2与C 3的σ键为旋转轴,试分别画出2,3-二甲基丁烷和2,2,3,3-四甲基丁烷的典型构象式,并指出哪一个为其最稳定的构象式。
解:2,3-二甲基丁烷的典型构象式共有四种:( I )( II )( III )CH 33CH 333CH 33CH (最稳定构象)( IV )(最不稳定构象)( III )( II )CH 33H 3CH 3H3CH 3CH2,2,3,3-四甲基丁烷的典型构象式共有两种:3H 333H 33CH 333(最稳定构象)( I )( II )(四) 将下列的投影式改为透视式,透视式改为投影式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学高鸿宾第四版答案【篇一:有机化学第四版答案高鸿宾】xt>(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1)24135673-甲基-3-乙基庚烷21(3)43652,5-二甲基-3,4-二乙基己烷 (5)乙基环丙烷1012(7)93876541,7-二甲基-4-异丙基双环[4.4.0]癸烷(2)213452,3-二甲基-3-乙基戊烷8697(4)51014231,1-二甲基-4-异丙基环癸烷1(6)4232-环丙基丁烷651(8)742ch38932-甲基螺[3.5]壬烷1456(9)237(10)(ch3)3cch25-异丁基螺[2.4]庚烷(11)h3c新戊基(12)ch3ch2ch2ch2ch32-甲基环丙基 2-己基 or (1-甲基)戊基(二) 写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。
(1) 2,3-二甲基-2-(2) 1,5,5-三甲基-3-(3) 2-叔丁基-4,5-二乙基丁烷 ch3ch3ch3chch3乙基己烷ch3ch2ch2chch2c2h5ch3cch3甲基己烷c(ch3)3ch3cch2chch3ch3chch32,3,3-三甲基戊烷(4) 甲基乙基异丙基甲烷ch3ch3ch3ch2chchch3ch2ch3ch3庚烷2,2-二甲基-4-乙基庚烷(5) 丁基环丙烷ch2ch2ch2ch32,2,3,5,6-五甲基(6) 1-丁基-3-甲基环己烷ch2ch2ch2ch31-环丙基丁ch32,3-二甲基戊1-甲基-3-丁基烷烷环己烷解:2,3-二甲基丁烷的典型构象式共有四种:ch3( i )(最稳定构象)h333chh3chch3( iii )h3cchhchch3( iii )h3chch33( ii )33( iv )(最不稳定构象)2,2,3,3-四甲基丁烷的典型构象式共有两种:h3h33( i )(最稳定构象)h3h3cchh3h333( ii )(四) 将下列的投影式改为透视式,透视式改为投影式。
cl3clhch3cl(1)h3chch3(2)chlch3hhclcl(3)chchllh3cclhch3h3chhch3brch3brbrch3hbrhbrrbrh3(5) hb(五) 用透视式可以画出三种ch3-cfcl2的交叉式构象:hfclclhclhclfhhfhclclhhh它们是不是ch3-cfcl2的三种不同的构象式?用newman投影式表示并验证所得结论是否正确。
解:它们是ch3-cfcl2的同一种构象——交叉式构象!从下列newman投影式可以看出:c(i)lc(ii)f(ii)l将(i)整体按顺时针方向旋转60o可得到(ii),旋转120o可得到(iii)。
同理,将(ii)整体旋转也可得到(i)、(iii),将(iii)整体旋转也可得到(i)、(ii)。
(六) 试指出下列化合物中,哪些所代表的是相同的化合物而只是构象表示式之不同,哪些是不同的化合物。
ch3cclchch3ch3ch3chlh3)2(1) (2)(3)chchh3lch3hhhhccl(ch3)2ch3(4)chch3cch3clh33(5)ch3h(6)解:⑴、⑵、⑶、⑷、⑸是同一化合物:2,3-二甲基-2-氯丁烷;⑹是另一种化合物:2,2-二甲基-3-氯丁烷。
(七) 如果将船型和椅型均考虑在环己烷的构象中,试问甲基环己烷有几个构象异构体?其中哪一个最稳定?哪一个最不稳定?为什么?解:按照题意,甲基环己烷共有6个构象异构体:ch3ch3hch3h(b)(c)ch3h(a)hch3hch3【篇二:有机化学-高鸿宾-第四版-课后习题答案】(一) 用简单的文字解释下列术语:(1)有机化合物:碳氢化合物及其衍生物。
(2)键能:形成共价鍵时体系所放出的能量。
(3)极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4)官能团:决定有机化合物的主要性质的原子或原子团。
(5)实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6)构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8)异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9) sp2杂化:由1 个s轨道和2个p轨道进行线性组合,形成(11)氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kj/mol。
(12) lewis酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的lewis结构式。
(1)chochhn2 (2) chch3o3(3)ohhch=chhch323(4) c(5) c (6)ch2o解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的lewis结构式如下:(1)h。
hhhnhh(2)h。
hchhh(3)hhhhc。
hh(4) (5)h。
hchh c。
(6)h。
h(三) 试判断下列化合物是否为极性分子。
(1) hbr(2) i2 (3) ccl4是否否 (4) ch2cl2(5) (6)ch3ohch3och是是是(四) 根据键能数据,乙烷分子(cch3)在受热裂解时,哪种键首先断h(414kj/ol)c(347kj/mol)因为鍵能:。
这个过程是一个吸热过程。
(六) 正丁醇(ch3ch2ch2ch2oh)的沸点(117℃)比它的同分异构体乙醚(ch3ch2och2ch3)的沸点(34.5℃)高得多,但两者在水中的溶解度均为8g/100g水,试解释之。
解:正丁醇分子之间可以形成分子间氢键,而乙醚分子之间不能形成氢键,所以正丁醇的的沸点远高于乙醚。
但二者均可水分子形成氢键,所以它们在水中都有一定的溶解度(8g/100g水)。
(七) 矿物油(相对分子质量较大的烃的混合物)能溶于正己烷,但不溶于乙酸或水。
试解释之。
解:矿物油是非极性分子,而水和乙醇都是极性分子。
根据“相似相溶”的原则,非极性的矿物油在极性溶剂中不可能有好的溶解度。
(八) 下列各反应均可看成是酸碱的反应,试注明哪些化合物是酸?哪些化合物是碱? (1) (2) (3)chcooh +32酸碱-chcoo + h3碱酸+-ho +chcoo33碱酸-chcooh + cl3碱酸ho + chn23碱酸ho + chn23碱酸-chnh + oh33 酸碱-chnh + oh33 酸碱(4)(九) 按照不同的碳架和官能团,分别指出下列化合物是属于哪一族、哪一类化合物。
ch3ch3chh3c3o(1) ch3cl (2) choh(3)ch2ch2ch22co33hh33脂肪族卤代烷烃脂肪族羧酸、开链羧酸脂环(族)酮chchcoch3chchhchhnh(4)hc (5)hcchcchcho(6)h芳香(族)醚芳香(族)醛杂环类化合物(吡咯)ch3h(7) ch3环(族)醇nh2 (8) ch3cch 33(9) hhhc2oh脂肪族伯胺脂肪族炔烃、开链炔烃脂(十) 根据官能团区分下列化合物,哪些属于同一类化合物?称为什么化合物?如按碳架分,哪些同属一族?属于什么族?ch2ohcooh(1)oh(2) (5)(8)n(3)coohoh(4)(6)coohcooh(7) oh (9) cooh解:按官能团分:⑴、⑶、⑷、⑻属于醇类化合物;⑵、⑸、⑹、⑺、⑼属于羧酸类化合物。
按碳架分:⑴、⑵属于芳香族;⑷、⑸属于脂环族;⑶、⑹、⑻、⑼属于脂肪族;⑺属于杂环类化合物。
(十一) 一种醇经元素定量分析,得知c=70.4% , h=13.9%,试计算并写出实验式。
解:碳和氢的含量加起来只有84.3%,说明该化合物含氧,即o=15.7%。
.4.9.7n70 n?13 n?15?5.87?6?14?1c12h1o16∴该化合物的实验式为c6h14o。
(十二) 某碳氢化合物元素定量分析的数据为:c=92.1% , h=7.9%;经测定相对分子质量为78。
试写出该化合物的分子式。
0.92?78解:n?5.87?6c120.79?78n?6.16?6h1∴该化合物的分子式为c6h6。
第二章饱和烃习题(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) 烷212346517(2)213453-甲基-3-乙基庚2,3-二甲基-3-乙基戊烷8(3)6453(4)9101726543【篇三:有机化学_高鸿宾_第四版_答案】i) (一) 用简单的文字解释下列术语:(1)(2)(3)(4)(5)(6)(7)有机化合物:碳氢化合物及其衍生物。
键能:形成共价鍵时体系所放出的能量。
极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
官能团:决定有机化合物的主要性质的原子或原子团。
实验式:能够反映有机化合物元素组成的相对比例的化学式。
构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8)异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9) sp2杂化:由1 个s轨道和2个p轨道进行线性组合,形成的3个能量介于s轨道和p轨道递,并且随着碳链增长,诱导效应迅速减弱。
(11)氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kj/mol。
(12) lewis酸:能够接受的电子的分子或离子。
ii) (二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的lewis结构式。
hhhch(1) cn2 (2) c3o3(3)chohhch=chhch(4) c(5) c (6) ch2o 323解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的lewis结构式如下:hh(1) hnh (2)hhhh。
ch (3) hhhh。
ch (5) hc(4) hh (6) c。
h。
hiii) (三) 试判断下列化合物是否为极性分子。
