九年级化学用语大全
初中化学用语(全)
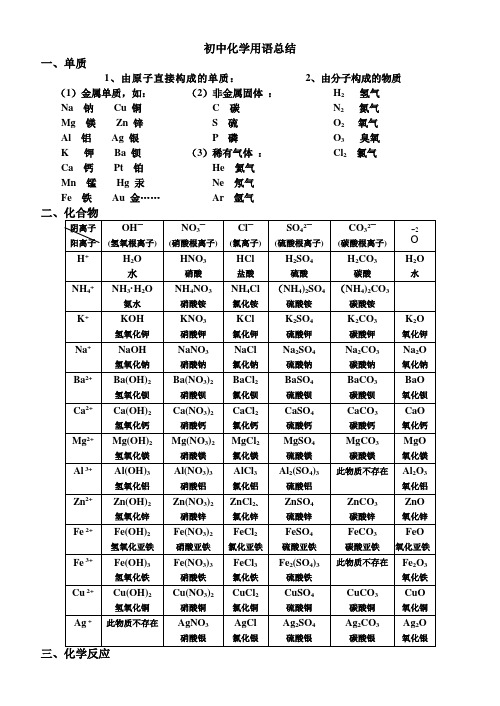
初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+ 8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
(完整版)最完整的九年级化学用语2021

九年级化学用语(包括元素符号、结构示意图、化合价、离子符号、化学式、化学方程式)黔西县思源实验学校:白晋阳一、记住30 种元素的名称和符号。
H 氢Ar 氩He氦K钾Li锂Ca钙Be铍Zn锌B硼Fe铁C碳Sn锡N氮Cu铜O氧Hg汞F氟Ag银Ne氖Au金Na钠I碘Mg镁Ba钡Al铝Mn锰Si硅P磷S硫Cl氯二、原子结构示意图1~20 号元素原子结构示意图氢氦Li 锂铍硼H He Be B碳C氮O氧氟氖N F Ne钠Na镁铝硅磷Mg Al Si P钾K钙Ca硫氯氩S Cl Ar K Ca三、常见元素和根在化合物中的化合价一 价 氯 银 钠 钾 氢 , -1 +1 +1 +1 +1Cl Ag K Na H-2 +2 +2 +2 +2Mg Zn二 价 氧 钙 钡 镁 锌 , O +3 Al -2 Ca Ba +4Si-2铝 三 硅 四 要 记 住 , 碳 酸 硫 酸 二 价 根 , C O 3 -1 OH -3PO 4 SO 4+1N O 3 -1 氢 氧 硝 酸 铵 根 一 , NH 4还 有 三 价 磷 酸 根 。
说明:在初中化学中,具有可变化合价的元素是如下 8 种:C N P S Cl Cu Fe Mn但是它们的化合价不用去记! 在初中化学中,除了以上根的化合价需要记住以外,其它的根的化合价也不用去记。
四、常见离子符号(共 25 个):―(氯离子)、Ag + (银离子 )、 K + (钾离子 ) 、 Na + (钠离子 )、 H + (氢离子 ) ClO 2-(氧离子)、 Al 3+(铝离子 )Ca 2+ (钙离子 )、 Ba 2+ (钡离子 )、 Mg 2+ (镁离子 )、 Zn 2+ (锌离子 ) CO 32-(碳酸根离子 )、 OH -(氢氧根离子 )、 PO 43-( 磷酸根离子 )2- SO 4 (硫酸根离子 ) - + NO 3 (硝酸根离子 )、 NH 4 (铵根离子 )Fe 2+ (亚铁离子 )、 F e 3+ (铁离子 )、、Cu 2+ (铜离子 )、HCO 3-(碳酸氢根离子 )以及 4-(高锰酸根离子 )、 MnO 4 (锰酸根离子 )、 ClO 3 (氯酸根离子 2- - 2- )、SO 3 (亚硫酸根离 MnO 子 )、五、记住下列物质的化学式,且能将它正确分类㈠、单质氢气H 2氮气氯气氧气臭氧氦气N2 Cl 2 O2 O3 He氖气氩气Ne Ar碳硅硫磷碘C Si S P I2钾钙钠镁铝锌K Ca Na Mg Al Zn 铁铜汞银Fe Cu Hg Ag㈡、化合物1、氧化物水HSO3 CO2O 三氧化硫一氧化碳二氧化碳CO 2五氧化二磷过氧化氢P2O 5 H 2O 2二氧化氮NO 2二氧化硫氧化钙SO2CaO氧化亚铁氧化铁FeO Fe2 O3 四氧化三铁Fe3 O4 氧化镁氧化锌二氧化锰MgO ZnO MnO 2氧化汞氧化铝HgO Al 2O 3氧化铜CuO 2、酸碱盐硝酸HNO 硫酸盐酸H 2SO4HCl3碳酸H 2CO 3 硫化氢H 2S氢氧化钠氢氧化钾氢氧化钙NaOH KOH Ca(OH) 2氢氧化镁Mg(OH) 氢氧化铝氢氧化锌Al(OH) Zn(OH)232氢氧化铁Fe(OH) 氢氧化亚铁氢氧化铜Fe(OH) Cu(OH)322氢氧化钡Ba(OH) 氨水NH 3·H 2O2氯化钠氯化铜NaCl CuCl 氯化铝AlCl 32氯化钾氯化亚铁KCl FeCl 2氯化铁FeCl 3氯化银氯化钙AgCl CaCl 氯化镁MgCl22氯化钡BaCl 2氯化锌硫酸铜ZnCl 2 CuSO 4 高锰酸钾KMnO 锰酸钾氯酸钾K 2MnO KClO443碳酸钙CaCO 硝酸钾硝酸钠KNO NaNO333硝酸铁 Fe(NO 3)3 硝酸亚铁 硝酸铝 Fe(NO 3)2 Al(NO 3)3碳酸钠 Na 2CO 3 碳酸钙 碳酸铵 CaCO (NH 4)2CO 33 碳酸氢钠 NaHCO 硫酸铁 硫酸亚铁 Fe 2(SO 4)3 FeSO 43 硝酸银 AgNO 硝酸钡 硝酸铵 Ba(NO 3) 2 NH 4NO 33 硫酸钡 BaSO 43、有机化合物甲烷 CH 乙醇 葡萄糖 C 2H 5OH C 6 H 12O 64 六、记住下列反应的化学方程式㈠、化合反应1、红磷在空气(或氧气)中燃烧: 4P + 5O 2 2P 2O 5点燃 2H 2O点燃2、氢气在空气中燃烧生成水: 2H 2 + O 2 点燃3、硫磺在空气(或氧气)中燃烧:4、镁条在空气(或氧气)中燃烧: S + O 2 SO 2点燃2Mg + O 2 2MgO点燃5、铁丝在氧气中燃烧: 3Fe + 2O 2 Fe 3O 4点燃 6、木炭在空气(或氧气)中完全燃烧: C + O 2 CO 2点燃7、木炭不充分燃烧: 2C + O 2 8、一氧化碳燃烧: 2CO + O 2 2CO点燃 2CO 29、二氧化碳和水反应生成碳酸: CO 2 + H 2O == H 2CO 3高温10、二氧化碳通过灼热的炭层: CO 2 + C 2CO11、生石灰作为干燥剂: CaO + H 2O == Ca(OH)2㈡、分解反应11、高锰酸钾制氧气: 2KMnO 4K 2MnO 4 + MnO 2 + O 2↑△ MnO 22KCl + 3O 2↑12、氯酸钾制氧气: 2KClO 3 △ MnO 213、双氧水制氧气: 2H 2O 2 2H 2O + O 2↑通电 14、电解水: 2H 2O 2H 2↑+ O 2↑H 2O + CO 2↑15、碳酸分解: H 2 CO 3 高温 16、高温煅烧石灰石(工业制取二氧化碳): CaCO 3 CaO +CO 2↑㈢、置换反应17、铜和硝酸银溶液反应: 18、铁和硫酸铜溶液反应: Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2Fe + CuSO 4 == Cu + FeSO 419、锌和硫酸反应制取氢气: Zn + H 2SO 4 == ZnSO 4 + H 2↑20、铝和稀硫酸反应: 2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑高温 21、木炭还原氧化铁: 木炭还原氧化铜: 3C + 2Fe 2O 3 4Fe + 3CO 2↑高温 C + 2CuO 2Cu + CO 2↑高温 木炭还原四氧化三铁: 2C + Fe 3O 4 3Fe +2CO 2↑氢气还原氧化铜: H 2 + CuO Cu + H 2 O高温 ㈣、复分解反应A 、酸 + 碱 → 盐 + 水22、氢氧化钠与盐酸反应: 23、氢氧化钠与硫酸反应: NaOH + HCl == NaCl + H 2O2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O24、氢氧化铝治疗胃酸过多: Al(OH) + 3HCl == AlCl 3 + 3H 2O3 25、氢氧化镁与硫酸反应: Mg(OH) 2 + H 2SO4 == MgSO 4 + 2H 2OB 、酸 + 盐 → 新酸 + 新盐26、盐酸与硝酸银溶液反应: HCl + AgNO 3 == AgCl ↓+ HNO 327、氯化钡溶液与硫酸溶液反应: BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl28、碳酸钠与稀盐酸: Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2碳酸氢钠与稀盐酸: NaHCO 3 + HCl == NaCl+ H 2O + CO 229、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO 3+2HCl = CaCl 2+H 2O+CO 2C 、碱 + 盐 → 另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应: 31、氯化铁溶液和氢氧化钠溶液反应: CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓FeCl 3 +3NaOH==Fe(OH)3↓+3NaClD 、盐 + 盐 → 两种新盐32、硝酸银溶液与氯化钠溶液反应: 33、氯化钡溶液与碳酸钠溶液反应: AgNO 3 + NaCl == AgCl ↓+ NaNO 3BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaClE 、金属氧化物 + 酸 → 盐 + 水34、稀盐酸清洗铁锈: 6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O35、氧化铜与稀硫酸反应: CuO + H 2SO 4== CuSO 4+ H 2O㈤、其他反应类型A 、非金属氧化物 + 碱 → 盐 + 水36、二氧化碳通入澄清石灰水中: CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O37、氢氧化钠在空气中变质: CO 2+ 2NaOH = Na 2CO 3 + H 2O38、氢氧化钠溶液吸收二氧化硫: 39、氢氧化钠溶液吸收三氧化硫: SO 2 + 2NaOH ==Na 2 SO 3+ H 2OSO 3 + 2NaOH ==Na 2 SO 4+ H 2OB 、其它情形40、一氧化碳还原氧化铜: CO + CuO Cu + CO 2高温 41、一氧化碳还原氧化铁: 3CO + Fe 2 O 3 2Fe + 3CO 2↑高温 42、一氧化碳还原四氧化三铁: 4CO + Fe 3O 4 3Fe + 4CO 2↑点燃43、酒精燃烧: 44、甲烷燃烧: C 2H 5OH + 3O 2 2CO 2 + 3H 2 O点燃 CH 4 + 2O 2 CO 2 + 2H 2O。
初三化学中考必记的化学用语(带答案)

初三化学中考必记的化学用语一、元素名称及符号三、化学式四、化合价1.元素化合价:+1价:K、Na、Ag、H ;+2价:Ca、Mg、Ba、Zn、Hg ;+3价:Al ;+4价:Si ;+1、+2价Cu ;+2、+3价Fe ;+2、+4价C;+2、+4、+6价:S;-1价:F、Cl ;-2价:O、S;-3价:N、P2.原子团化合价:(化合价数目与离子所带电荷数目相等,符号相同,但位置顺序相反)名称:铵根氢氧根硝酸根硫酸根碳酸根磷酸根符号:NH4OH NO3SO4CO3PO4化合价:+1 -1 -1 -2 -2 -3离子符号:NH4+OH—NO3—SO42—CO32—PO43—五、金属活动性顺序(由强到弱):元素符号:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au元素名称:钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金六、部分酸、碱、盐的溶解性规律:1、酸:全部溶于水;2、碱:大多数不溶于水,NH3·H2O、KOH、NaOH、Ba(OH)2溶于水,Ca(OH)2微溶;3、盐:a、钾盐、钠盐、铵盐、硝酸盐四类盐都易溶于水;b、盐酸盐(即氯化物)绝大多数溶于水,只有AgCl不溶于水;c、硫酸盐绝大多数溶于水,只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水;d、碳酸盐绝大多数不溶于水,Na2CO3、K2CO3、(NH4)2CO3溶于水,MgCO3微溶于水。
七、物质的俗名、学名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)硫磺、硫:S(4) 生石灰、氧化钙:CaO (5)干冰(固体二氧化碳):CO2 (6)盐酸、氢氯酸:HCl (7)亚硫酸:H2SO3(8)氢硫酸:H2S (9)熟石灰、消石灰、氢氧化钙:Ca(OH)2 (10)苛性钠、火碱、烧碱:NaOH (11)食盐氯化钠:NaCl(12)纯碱、碳酸钠:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3·10H2O(13)碳酸氢钠、酸式碳酸钠:NaHCO3(也叫小苏打)碳铵、碳酸氢铵:NH4HCO3(14)胆矾、蓝矾、硫酸铜晶体:CuSO4·5H2O(五水合硫酸铜)(15)铜绿、孔雀石、碱式碳酸铜:Cu2(OH)2CO3(分解生成三种氧化物的物质)(16)甲醇:CH3OH 有毒、失明、死亡(17)酒精、乙醇:C2H5OH (18) )氨气:NH3(碱性气体)(19)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(20) 氨水、一水合氨:NH3·H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(21)亚硝酸钠:NaNO2(工业用盐、有毒)八、常见物质的颜色及状态1、白色固体:白磷P、P2O5、MgO、CaO、NaOH、Ca(OH)2、KClO3、KCl、NaCl、Na2CO3、NaHCO3、无水CuSO4;CaCO3、BaCO3、Mg(OH)2、AgCl、BaSO4;银白色固体:铁(铁粉为黑色)、铝、镁等多数金属(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4、I2为紫黑色(碘蒸气为紫红色)3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、绿色固体:Cu(OH)2CO3、K2MnO4 蓝色固体:CuSO4·5H2O 淡黄色固体:S5、溶液的颜色:含Cu2+的溶液——蓝色;含Fe2+的溶液——浅绿色;含Fe3+的溶液——黄色,含MnO4—高锰酸根离子的溶液——紫红色;其余溶液一般——无色。
化学常见用语

(一)化学用语1.元素符号:氢H 氦He锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P硫S 氯Cl 氩Ar钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb (氢H)铜Cu 汞Hg 银Ag 铂Pt 金Au2.化学式:气体:氧气O2氢气H2氮气N2氯气Cl2二氧化碳CO2二氧化硫SO2一氧化碳CO 二氧化氮NO2甲烷CH4氨气NH3氯化氢HCl固体:白色:五氧化二磷P2O 5氧化镁MgO 氯酸钾KClO3碳酸钙CaCO3硫酸钡BaSO4氯化银AgCl 生石灰CaO 熟石灰Ca(OH) 2黑色:木炭C 氧化铜CuO 四氧化三铁Fe3O4二氧化锰MnO2蓝色:胆矾CuSO4 . 5H2O 氢氧化铜Cu(OH) 2绿色:碱式碳酸铜Cu2 (OH) 2CO3红褐色:氧化铁(铁锈)Fe2O3氢氧化铁Fe(OH) 3常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3碳酸H2CO3常见的碱:氢氧化钠(烧碱,火碱,苛性钠)NaOH 熟石灰Ca(OH) 2常见的盐:氯化钠NaCl 氯化钡BaCl2硝酸银AgNO3碳酸钠(纯碱)Na2CO3氯化铁FeCl33.离子符号:氢离子H+钠离子Na+镁离子Mg2+氯离子Cl--离子Ag+钙离子Ca2+钡离子Ba2+硫离子S2--硝酸根离子NO3--氢氧根离子OH-- 硫酸根离子SO42--碳酸根离子CO32--4.化学方程式:化合反应:木炭充分燃烧:木炭不完全燃烧:硫的燃烧:磷的燃烧:铁丝燃烧:镁条燃烧:氢气燃烧:一氧化碳燃烧:碳还原二氧化碳:二氧化碳与水反应分解反应:加热氯酸钾:加热高锰酸钾:加热碱式碳酸铜:电解水:煅烧石灰石:氢氧化铁受热分解:碳酸分解:氧化汞受热分解:置换反应:锌和稀硫酸反应,镁和稀硫酸反应:铁和稀盐酸反应:木炭还原氧化铜:氢气还原氧化铜:锌和硫酸铜溶液反应:复分解反应:二氧化碳通入澄清石灰水:实验室制取二氧化碳:碳酸钠与盐酸反应:其他反应类型:甲烷燃烧:一氧化碳还原氧化铜:炼铁的原理:(一)化学用语1.元素符号:氢_______ 氦_______锂Li 铍Be 硼B 碳______ 氮______ 氧_____ 氟F 氖_______钠____镁____铝___ 硅_______ 磷_______ 硫_______ 氯______ 氩_______钾______ 钙______ 钠______ 镁______ 铝______ 锌_______ 铁_______锡Sn 铅Pb (氢_______)铜_______ 汞_______ 银_______ 铂Pt 金Au2.化学式:A.气体:氧气_______ 氢气_______ 氮气_______ 氯气_______ 二氧化碳_______ 二氧化硫_______ 一氧化碳_______ 二氧化氮_______甲烷_______ 氨气_______ 氯化氢_______B.常见物质颜色:____色:五氧化二磷_______ 氧化镁_______ 氯酸钾_______ 碳酸钙_______ 硫酸钡_______ 氯化银_______ 生石灰_______ 熟石灰_______镁_______、铝_______、纯铁_______、水银_______、白磷_______、碳酸钙_______、碳酸钡___________色:木炭_______ 氧化铜_______ 四氧化三铁_______ 二氧化锰_______无色:水、金刚石、许多无色溶液、大多数气体。
初中化学用语汇总

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。
九年级化学的全部化学用语

Байду номын сангаас
氧化物 酸 酸 酸 盐 盐 盐
盐
盐 盐 盐 盐 盐 盐 盐
盐
盐 有机物 有机物
氢氧化钠 氢氧化钙 氢氧化铁 氢氧化铜 硫酸铝 硫酸镁 硫酸亚铁 硫酸铁 硫酸铜 硫酸钠 亚硫酸钠 硫酸锌 硫酸钡 硝酸银 硝酸钡 硝酸铜 硝酸钾 高锰酸钾 锰酸钾
NaOH Ca(OH)2 Fe(OH)3 Cu(OH)2 Al2(SO4)3 MgSO4 FeSO4 Fe2(SO4)3 CuSO4 Na2SO4 Na2SO3 ZnSO4 BaSO4 AgNO3 Ba(NO3)2 Cu(NO3)2 KNO3 KMnO4 K2MnO4
2
12、生石灰溶于水:CaO + H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4 5H2O 14、钠在氯气中燃烧:2Na + Cl2 点燃 2NaCl 分解反应 15、实验室用双氧水制氧气:2H2O2+MnO2===2H2O+ O2↑ 16、加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑ 17、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑ 18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑ 20、加热氯酸钾(有少量的二氧化锰):2KClO3 = 2KCl + 3O2 ↑ 置换反应 21、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 22、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑ 23、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑ 24、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 25、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 26、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 27、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO 28、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ 其他 29、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4 30、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 31、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 32、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2 33、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2 34、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 35、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O 36、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法): CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 37、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
(完整版)初三化学全册必背知识点(精华)

初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
九年级必记化学用语(单元版)

得化学用语者得天下!——中考化学用语约占总分40%九年级必记化学用语(单元版)绪言一、请记忆元素符号(41种):参见《九年级化学导学案》P5A:Ag银108、Al铝27、Ar氩40、Au金197。
B:B硼11、Ba钡137、Be铍9、Br溴80。
C:C碳12、Ca钙40、Cl氯35.5、Co钴60、Cu铜63.5。
F:F氟19、Fe铁56。
H:H氢1、He氦4、Hg汞201。
I:I碘127。
K:K钾39、Kr氪84。
L:Li锂7。
M:Mg镁24、Mn锰55。
N:N氮14、Na钠23、Ne氖20。
O:O氧16。
P:P磷31、Pb铅207、Pt铂195。
R:Rn氡222。
S:S硫32、Sb锑122、Si硅28、Sn锡119。
T:Ti钛48。
U:U铀238。
W:W钨184。
X:Xe氙131。
Z:Zn锌65。
二、请记忆化学符号U1:走进化学世界#第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne 第三周期:钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 第四周期:钾K 钙Ca二、请记忆金属活动性顺序1.石蜡+氧气二氧化碳+水2. 硫酸铜氢氧化铜硫酸铜氢氧化钠+→+2NaOH +CuSO 4=Cu(OH )2↓+Na 2SO 4 (CuSO 4溶液为蓝色,Cu(OH)2为蓝色沉淀)3.二氧化碳水氯化钙盐酸碳酸钙++→+4.水二氧化碳氧化铜碱式碳酸铜加热++−−→− Cu 2(OH )2CO 3Δ2CuO +H 2O +CO 2↑5.二氧化碳氧气碳点燃−−→−+ C+O 2CO 26.水碳酸钙氢氧化钙二氧化碳+→+7.碳酸钠+盐酸→氯化钠+水+二氧化碳 Na 2CO 3+2HCl===2NaCl+H 2O+CO 2↑8.锌+盐酸→氯化锌+氢气9.氢氧化铜→氧化铜+水 Cu(OH)2 CuO+H 2OU2:我们周围的空气一、请记忆化学反应的文字表达式1.汞+氧气→氧化汞;2Hg+O 22HgO2.氧气汞氧化汞加热+−−→− ;↑+2O Hg 2Og H 2△3.五氧化二磷氧气磷点燃−−→−+ ;4P+5O 22P 2O 5 4.二氧化硫氧气硫点燃−−→−+ ;S+ O 2SO 25.四氧化三铁点燃氧气铁−−→−+ ;3Fe+2O 2Fe 3O 46.氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电7.水氧气氢气点燃−−→−+ ;2H 2+O 22H 2O9.氧气水过氧化氢二氧化锰+−−−−→− ;2H 2O 22H 2O+O 2↑ 10.氧气二氧化锰锰酸钾高锰酸钾加热++−−→− ;2KMnO 4K 2MnO 4+MnO 2+O 2↑11.2KClO 32KCl+3O 2↑二、请记忆化合价(包括元素&原子团):参见《九年级化学导学案》P 7 1.元素的化合价氢+1,氧-2,银锂钠钾+l 价, 锌镁钙钡+2价,铝+3,硅+4;只遇金属或是氢,氮磷-3、硫-2,氟氯溴碘总-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学用语
一、元素符号
氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne
钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 锰 Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I 锂 Li 铍 Be 硼 B 铅 Pb 锡 Sn 钛 Ti 溴 Br 钨 W 二、化学式
氧气 O
2氢气 H
2
氮气 N
2
氟气 F
2
氯气 Cl
2
氦气 He
氖气 Ne 氩气 Ar 溴 Br
2碘 I
2
臭氧 O
3
碳 C
硫 S 磷 P 硅 Si 碳60 C
60
铁 Fe 铝 Al 镁 Mg 锌 Zn 铜 Cu 银 Ag 水银 Hg 钠 Na
水 H
2O 过氧化氢 H
2
O
2
二氧化碳 CO
2
一氧化碳 CO 二氧化氮 NO
2
一氧化二氮 N
2O 一氧化氮 NO 二氧化硅 SiO
2
五氧化二磷 P
2
O
5
二氧化硫 SO
2三氧化硫 SO
3
二氧化氯 ClO
2
氧化钠 Na
2
O
氧化镁 MgO 氧化铝 Al
2O
3
氧化钾 K
2
O 氧化钙 CaO
二氧化锰 MnO
2四氧化三铁 Fe
3
O
4
氧化铁 Fe
2
O
3
氧化亚铁 FeO
氧化铜 CuO 氧化锌 ZnO 氧化钡 BaO 氧化汞 HgO
盐酸 HCl 硫酸 H
2SO
4
硝酸 HNO
3
碳酸 H
2
CO
3
磷酸 H
3
PO
4
氨气 NH
3氨水 NH
3
·H
2
O 氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)
2
氢氧化钡 Ba(OH)
2氢氧化镁 Mg(OH)
2
氢氧化铝 Al(OH)
3
氢氧化锌 Zn(OH)
2
氢氧化铁 Fe(OH)
3氢氧化亚铁 Fe(OH)
2
氢氧化铜 Cu(OH)
2
乙酸 CH
3
COOH
甲烷 CH
4乙醇 C
2
H
5
OH 葡萄糖 C
6
H
12
O
6
淀粉 (C
6
H
10
O
5
)n 蔗糖 C
12
H
22
O
11
氯化钾 KCl 氯化钠 NaCl 氯化钡 BaCl
2氯化钙 CaCl
2
氯化镁 MgCl
2
氯化铝 AlCl
3
氯化锌 ZnCl
2
氯化铁 FeCl
3
氯化亚铁 FeCl
2
氯化铜 CuCl
2
氯化银 AgCl 硫酸钾 K
2
SO
4
硫酸钠 Na
2
SO
4
硫酸钡 BaSO
4
硫酸钙 CaSO
4
硫酸镁 MgSO
4
硫酸铝 Al
2
(SO
4
)
3
硫酸锌 ZnSO
4
硫酸铁 Fe
2
(SO
4
)
3
硫酸亚铁 FeSO
4
硫酸铜 CuSO
4
硫酸银 Ag
2
SO
4
硝酸钾 KNO
3
硝酸钠 NaNO
3
硝酸钙 Ca(NO
3
)
2
硝酸钡 Ba(NO
3
)
2
硝酸镁 Mg(NO
3
)
2
硝酸铝 Al(NO
3
)
3
硝酸锌 Zn(NO
3
)
2
硝酸铁 Fe(NO
3
)
3
硝酸亚铁 Fe(NO
3
)
2
硝酸铜 Cu(NO
3
)
2
硝酸银 AgNO
3
高锰酸钾 KMnO
4
锰酸钾 K
2
MnO
4
氯酸钾 KClO
3
碳酸钾 K
2
CO
3
碳酸钠 Na
2
CO
3
碳酸钙 CaCO
3
碳酸钡 BaCO
3
碳酸镁 MgCO
3
碳酸锌 ZnCO
3
碳酸亚铁 FeCO
3
碳酸银 Ag
2
CO
3
氯化铵 NH
4
Cl 硝酸铵 NH
4
NO
3
硫酸铵 (NH
4
)
2
SO
4
碳酸氢铵 NH
4
HCO
3
碳酸铵 (NH
4
)
2
CO
3
磷酸钙 Ca
3
(PO
4
)
2
三、常见的离子符号
氧离子 O2-氟离子 F-硫离子 S2-氯离子 Cl-钠离子 Na+
镁离子 Mg2+铝离子 Al3+钾离子 K+钙离子 Ca2+氢离子 H+
锂离子 Li+铍离子 Be2+铁离子 Fe3+亚铁离子 Fe2+铜离子 Cu2+
2++ 2+--
四、化学方程式
1.红磷在氧气中燃烧
2.硫在氧气中燃烧
3.铁丝在氧气中燃烧
4.加热高锰酸钾
5.过氧化氢溶液与二氧化锰混合6.加热氯酸钾与二氧化锰的混合物7.在氧气中加热汞
8.氧化汞受热分解
9.氢气在氯气中燃烧
10.氢气在氧气中燃烧
11.电解水
12.镁条在氧气中燃烧
13.铝箔在氧气中燃烧
14.铜在空气中加热
15.氢气还原氧化铜
16.木炭在氧气中完全燃烧
17.木炭在氧气中不完全燃烧18.碳还原氧化铜
19.碳还原氧化铁
20.碳还原二氧化碳
21.碳还原水蒸气
22.实验室制取二氧化碳
23.碳酸分解
24.工业上制备二氧化碳
25.二氧化碳与水反应
26.检验二氧化碳的反应
27.一氧化碳燃烧28.一氧化碳还原氧化铜29.一氧化碳还原四氧化三铁30.灭火器的反应原理31.氧化钙与水反应
32.甲烷燃烧
33.乙醇(酒精)燃烧34.实验室制取氢气
35.铝常温下氧化
36.镁与盐酸反应
37.铝与盐酸反应
38.锌与盐酸反应
39.铁与盐酸反应
40.镁与稀硫酸反应
41.铝与稀硫酸反应
42.铁与稀硫酸反应
43.铁与硫酸铜溶液反应44.锌与硫酸铜溶液反应45.铝与硫酸铜溶液反应46.铜与硝酸银溶液反应47.铝与硝酸银溶液反应48.铁与硝酸银溶液反应49.锌与硝酸银溶液反应50.工业上炼铁的反应原理。
