化学大一轮复习人教版新高考专用 五氧化还原反应概念和规律
2024届高考一轮复习-05氧化还原反应的基本概念
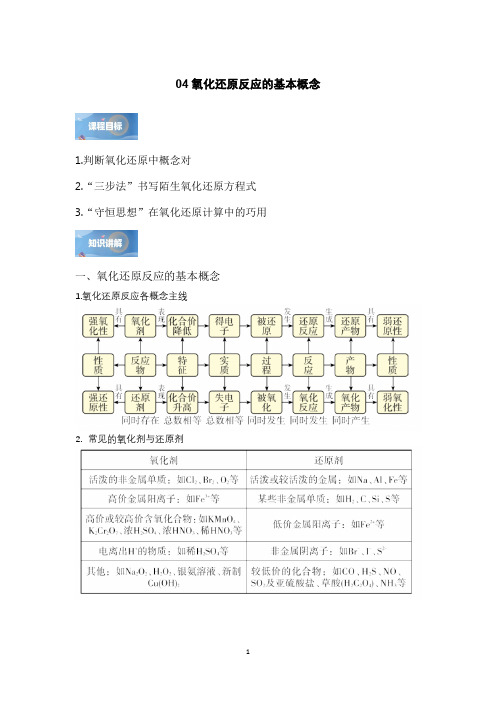
04氧化还原反应的基本概念1.判断氧化还原中概念对2.“三步法”书写陌生氧化还原方程式3.“守恒思想”在氧化还原计算中的巧用一、氧化还原反应的基本概念1.氧化还原反应各概念主线2.常见的氧化剂与还原剂高考真题演练1.(2023·浙江·高考真题)关于反应322222NH OH 4Fe N O O =4Fe 4H H ++++↑+++,下列说法正确的是A .生成21molN O ,转移4mol 电子B .2NH OH 是还原产物C .2NH OH 既是氧化剂又是还原剂D .若设计成原电池,2Fe +为负极产物2.(2022·山东·高考真题)实验室制备4KMnO 过程为:①高温下在熔融强碱性介质中用3KClO 氧化2MnO 制备24K MnO ;②水溶后冷却,调溶液pH 至弱碱性,24K MnO 歧化生成4KMnO 和2MnO ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得4KMnO 。
下列说法正确的是 A .①中用瓷坩埚作反应器 B .①中用NaOH 作强碱性介质 C .②中24K MnO 只体现氧化性D .2MnO 转化为4KMnO 的理论转化率约为66.7%3.(2022·山东·高考真题)古医典富载化学知识,下述之物见其氧化性者为A .金(Au):“虽被火亦未熟"B .石灰(CaO):“以水沃之,即热蒸而解”C .石硫黄(S):“能化……银、铜、铁,奇物”D .石钟乳(3CaCO ):“色黄,以苦酒(醋)洗刷则白”二、氧化还原反应的基本规律(1) 价态表现规律元素处于最高价态时只有氧化性,处于最低价态时只有还原性,处于中间价态时既具有氧化性又具有还原性。
(2) 价态转化规律① 含同种元素的不同价态的物质之间发生氧化还原反应时要遵循“只靠拢不交叉不重叠”的归中反应规律。
② 含同种元素的同一价态的物质发生氧化还原反应时,则遵循着从中间价态分别向高价态与低价态转化的歧化反应规律。
氧化还原反应课件2024届高三化学高考备考一轮复习

前面的讨论中我们看到,从物质的微观 结构出发得到的化合价只能为整数,但氧化 数却可以为整数也可以为分数。
一般来说元素的最高化合价应等于其所 在族数,但是元素的氧化数却可以高于其所 在族数。
如在 CrO5 中 Cr 的氧化数为 + 10。 但是从其结构式
测得该原电池的电动势 E池θ = 0.76 V
由公式
E池θ = φθ+ - φθ-
φ θ(Zn2+ / Zn)=
φθ(H+ / H2)- E池θ
= 0 V- 0.76 V = - 0.76 V
4 其他类型的电极
在金属表面覆盖一层该金属的难溶盐,将其浸 在含有该难溶盐负离子的溶液中,构成电极。
如在银丝的表面涂上一层 AgCl,将其插入盐 酸中,即构成这种电极。
例如氯元素的各种氧化态 HClO4, HClO3,HClO,Cl2 和 Cl-,其氧化数分 别为 7,5,1,0 和 -1。
5.1.2 氧化还原反应方程式的配平
配平原则:
① 电荷守恒:氧化剂得电子数等于 还原剂失电子数。
② 质量守恒:反应前后各元素原子 总数相等。
配平步骤:
①用离子式写出主要反应物和产物(气 体、纯液体、固体和弱电解质则写分子式)。
解: Cr(OH)3(s) Br2 (l) CrO24- Br-
Br2 (l) 2e- = 2Br-
①
Cr(OH)3(s) 8OH- = CrO24- 3OH- 4H2O 3e-
即:Cr(OH)3(s) 5OH- = CrO24- 4H2O 3e- ②
①×3+②×2得:
新高考化学一轮复习氧化还原反应的概念与规律课件(88张)

反应电子转移的方向和数目:_________________________________
__________________________________________________________。
此反应中氧化剂是________,还原剂是________,氧化产物是
________,还原产物是________,MnO2发生________反应,HCl发 生________反应;生成 1 mol Cl2时转移电子数目为________,被氧 化的HCl的物质的量是________mol,盐酸显示的性质是________性
利用氧化还原反应为人类提供 与
化。
有益的服务。 社会责任
第1课时 氧化还原反应的概念与规律
1
2
3
4
环节1 课前自主复习 环节2 高考热点突破 环节3 新情境专项练 课时质量评价
01
环节1 课前自主复习
基础1 氧化还原反应的概念与本质 基础2 氧化还原反应电子转移的表示方法
第1课时 氧化还原反应的概念与规律
[练后梳理]
双线桥法
单线桥法
表示
方法
===还原产物+氧化产物
①箭头指向反应前后有元素化合价 ①箭头从失电子元素的原子指
变化的同种元素的原子,且需注明 向得电子元素的原子。
注意
“得到”或“失去”。
②不标“得到”或“失去”,
事项
②箭头的方向不代表电子转移的方 只标明电子转移的总数。
向,仅表示电子转移前后的变化 ③线桥只出现在反应物中
1
2
3
4
环节1 课前自主复习 环节2 高考热点突破 环节3 新情境专项练 课时质量评价
氧化还原反应的概念与本质 [以练带忆]
2024届高考一轮复习化学课件(通用版):氧化还原反应

的还原性强。
2.氧化性、还原性强弱的比较方法 (1)依据氧化还原反应方程式判断
氧化性:氧化剂 01 __>____氧化产物; 还原性:还原剂 02 __>____还原产物。
(2)依据反应条件及反应的剧烈程度判断 当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越 易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。 如: MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O; 2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O; 氧化性: 03 _K__M__n_O_4_>_M__n_O_2______。
1.深度理解氧化还原反应 (1)氧化还原反应概念间的关系:熟记八个字:“氧、得、降、还, 还、失、升、氧”[氧.化剂、得.电子、化合价降.低、被还.原;还.原剂、失. 电子、化合价升.高、被氧.化]。 (2) 有 单 质 参 加 或 生 成 的 反 应 不 一 定 属 于 氧 化 还 原 反 应 , 如 放电 3O2=====2O3。 (3)某元素由化合态变为游离态时,该元素不一定被还原(被氧化), 因为元素处于化合态时,其化合价可能为正价,也可能为负价。 如:Cu2+→Cu 时,铜元素被还原,Cl-→Cl2 时,氯元素被氧化。
答案
角度三 氧化还原反应中电子转移的表示方法 5.下列化学反应中电子转移方向、数目表示正确的是( )
答案
6 . (1)ClO2 常 用 于 水 的 净 化 , 工业上 可用 Cl2 氧 化 NaClO2 溶 液 制取 ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数 目:
高考化学一轮复习 第一章 物质及其变化 第四讲 氧化还原反应的基本概念和规律

考点二 氧化剂和还原剂
1.氧化剂、还原剂以及相应的产物 (1)常见氧化剂及反应产物 常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。 如:
SO2 NO或NO2 Mn2+ Fe2+或Fe Cr3+
(2)常见还原剂及反应产物 常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低 价金属阳离子、某些非金属单质及其氢化物等。如:
答案
(4)1 4
解析 (2)反应中,NO 的+2 价 N 元素变成 0 价,CO 中+2 价 C 变为+4 价,
转移电子数为 4,用双线桥表示此反应中的电子得失情况为:
;
(3)反应中 CO 失电子,NO 得电子,转移电子数为 4,用单线桥表示此反应中的
电子转移情况为:
;(4)由方程式可知,若反应中消耗了 2
2.为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转 化器,发生的反应为2NO+2CO===N2+2CO2。 (1)碳元素的化合价________(填“升高”或“降低”),被________(填“氧化” 或“还原”),CO是________剂(填“氧化”或“还原”),NO是________剂 (填“氧化”或“还原”),发生________反应(填“氧化”或“还原”)。 答案 (1)升高 氧化 还原 氧化 还原 解析 (1)反应中,CO中+2价C由变为+4价,化合价升高被氧化,则CO为 还原剂,NO为氧化剂,反应中得电子被还原,发生还原反应;
高考化学一轮复习
考点一 物质的分类
第四讲 氧化还原反应的基本概念和规律
导航•课标要求
1.理解氧化还原反应的本质是电子的转移。 2.能利用氧化还原反应等概念对常见反应进行分类和分析说明。 3.能从元素价态的角度,依据氧化还原反应原理,预测物质的化学性质和变化。
2025届高三高考化学一轮复习+第1讲+氧化还原基础知识(课件)

硼氢化钠
负价氢化合物
铝族,价2s22p1
次磷酸
-1
+1
+1
-2
标酸的化合价,可以令其“完全电离”,寻找酸根离子整体的化合价
次磷酸根整体-3
+1
氰酸根整体-1
+2
-3
强还原性
+1
整体-1
-2
-3
+4
强还原性
-2
尿素
整体+2
1个整体-1
+4
+1
-3
强还原性
肼
+1
-2
【思考】1mol肼有多少共价键
铁氰化钾检验亚铁离子标配
还原反应:元素的化合价降低的反应(若为电化学反应,则称为阴极反应)
(3)两剂两产物
氧化剂:得电子的反应物,反应后变为还原产物还原剂:失电子的反应物,反应后变为氧化产物
【一串规律】还原剂,被氧化,得到氧化产物,则化合价升高,失去电子氧化剂,被还原,得到还原产物,则化合价降低,得到电子
例1、判断下列反应是否是氧化还原反应
[记]氟常见化合价-1
-1
+3
-1
+1
-1
+2
正氧化合物过硫Leabharlann 亚铁负价氢化合物-1
氧族元素
+2
二氯化二硫
+1
-1
经验:没有信息或特殊结构,Cl为-1价
-1
+4
类比
-1
+4
三氯甲硅烷
-1
SiH整体+3
+4
-1
【方法】多元素标价,先标确定的,算出总数,再把另一部分看成整体,再分别突破
高考化学一轮复习易错知识点(五) 氧化还原反应概念及规律
高考化学一轮复习易错知识点(五)氧化还原反应概念及规律【易错分析】1.某元素由化合态变为游离态时,该元素一定被还原。
某元素由化合态变为游离态时,该元素不一定被还原,也不一定被氧化。
因为元素处于化合态时,其化合价可能为正,也可能为负。
若元素由负价变为0价,则其被氧化;若元素由正价变为0价,则其被还原。
2.有单质参加或生成的反应一定是氧化还原反应。
有单质参加或生成的反应不一定是氧化还原反应,要看反应前后元素的化合价是否发生改变,如同素异形体之间的转化就是非氧化还原反应。
3.在氧化还原反应中,非金属单质一定只作氧化剂。
在氧化还原反应中,非金属单质不一定只作氧化剂,大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主。
如在反应Cl 2+H 2O=HCl+HClO 中,Cl 2既表现氧化性又表现还原性。
4.物质氧化性或还原性的强弱取决于得失电子数目的多少。
物质氧化性或还原性的强弱取决于其所含元素原子得失电子的难易程度,与得失电子数目的多少无关。
5.所含元素价态越高,化合物的氧化性一定越强。
含有最高价元素的化合物不一定具有强氧化性。
如HClO 4中Cl 元素为+7价(最高价态),HClO 中Cl 元素为+1价,而实际上HClO 4的氧化性没有HClO 的强。
6.在氧化还原反应中,若有一种元素被氧化,则一定有另一种元素被还原。
在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,有许多反应是同一种元素既被氧化又被还原。
如在反应2Na 2O 2+2H 2O=4NaOH+O 2↑中,Na 2O 2中氧元素的化合价既升高又降低。
【错题纠正】例题1、反应MnO 2+4HCl(浓)加热MnCl 2+Cl 2↑+2H 2O 中,氧化产物与还原产物的物质的量之比是( )A .1:2B .1:1C .2:1D .4:1【解析】由反应方程式可知,反应物MnO 2中的Mn 元素的化合价为+4价,生成物MnCl 2中Mn 元素的化合价为+2价,反应物HCl 中Cl 元素的化合价为-1价,生成物Cl 2中Cl 元素的化合价为0价,故MnCl 2是还原产物,Cl 2是氧化产物,由氧化还原反应中得失电子守恒可知,n (Cl 2):n (MnCl 2)=1:1,B 符合题意。
氧化还原反应的基本概念--2024年高考化学一轮复习(拔高)(学生版)
第01讲氧化还原反应的基本概念氧化还原反应基础一、氧化还原反应的基本概念1.定义:凡是有元素化合价升降的化学反应称之为氧化还原反应2.特征:元素的化合价在反应前后发生了变化。
3.本质:发生了电子的转移,包括电子得失、共用电子对的偏移两种情况。
(1)从原子结构来看,钠原子的最外电子层上有1个电子,氯原子的最外电子层上有7个电子。
当Na与Cl2反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+);氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-),这样双方最外电子层都达到了8个电子的稳定结构(如图)。
反应中钠元素的化合价从0价升高到+1价,Na被氧化;氯元素的化合价从0价降低到-1价,Cl2被还原。
在这个反应中,发生了电子的得失,Na发生了氧化反应,Cl2发生了还原反应。
(2)H2与Cl2的反应则与此不同。
氢原子的最外电子层上有1个电子,可获得1个电子而形成2个电子的稳定结构;氯原子的最外电子层上有7个电子,也可获得1个电子而形成8个电子的稳定结构。
在发生反应时,它们都未能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引,使双方最外电子层都达到稳定结构。
由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子。
因此,氢元素的化合价从0价升高到+1价,H2被氧化;氯元素的化合价从0价降低到-1价,C12被还原。
在这个反应中,发生了共用电子对的偏移,H2发生了氧化反应,C12发生了还原反应。
二、两剂两产物(升失氧降的还)1.氧化剂:在氧化还原反应中得到电子(或电子对偏向)的物质,具有氧化性。
2.还原剂:在氧化还原反应中失去电子(或电子对偏离)的物质,具有还原性。
3.氧化产物:还原剂发生氧化反应得到的产物(即化合价升高的生成物)。
4.还原产物:氧化剂发生还原反应得到的产物(即化合价降低的生成物)。
2025年高考化学一轮复习课件(适用于新高考新教材) 第3节 氧化还原反应
第3章第3节 氧化还原反应1.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
2.认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子的转移,知道常见的氧化剂和还原剂。
1.本部分知识在高考中一般与元素化合物、电化学、流程图题相结合进行考查,难度中等。
2.对氧化还原反应概念的复习,首先要抓住概念的本质,建立氧化还原反应的观点,通过分析、推理等方法认识氧化还原反应的特征和实质,建立氧化还原反应计算、配平以及书写陌生方程式的思维模型。
3.能从氧化还原反应的角度,设计探究方案,进行实验探究,加深对物质氧化性、还原性的理解。
内容索引第一环节 必备知识落实第二环节 关键能力形成第三环节 核心素养提升第一环节 必备知识落实1氧化还原反应的相关概念及电子转移的表示方法知识筛查1.氧化还原反应的本质和特征2.相关概念及其关系简单概括为“升失氧、降得还,剂性一致、其他相反”。
3.氧化还原反应中电子转移的表示方法(1)双线桥法。
Cu与稀硝酸的反应中电子转移的方向和数目可表示为:(2)单线桥法。
Cu与稀硝酸的反应中电子转移的方向和数目可表示为:4.氧化还原反应与四种基本反应类型间的关系知识巩固1.判断正误,正确的画“√”,错误的画“×”。
(1)反应2Na 2O 2+2H 2O ══4NaOH+O 2↑与反应Cl 2+H 2O HCl+HClO 均为水做还原剂的氧化还原反应。
( )(2)将KI 和FeCl 3溶液在试管中混合后,加入CCl 4,振荡,静置,下层溶液显紫红色,说明氧化性Fe 3+>I 2。
( )(3)Cl 2+2Br -══2Cl -+Br 2,Zn+Cu 2+══Zn 2++Cu 均为单质被还原的置换反应。
( )(4)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。
( )(5)铜与浓硝酸的反应中电子转移的方向和数目可表示为×√×√√2.(1)用双线桥法标出下列反应的电子转移情况。
新高考化学一轮复习氧化还原反应概念和规律课件(48张)
【题组训练过关】
题组1 守恒规律考查
1.(2021·武汉模拟)已知在碱性溶液中可发生如下反应:2M(OH)3+3ClO-+
4OH-====2M O
n 4
+3Cl-+5H2O。则M O
n 中M的化合价是
4
()
A.+3
B.+4
C.+5
D.+6
【解析】选D。根据氧化还原反应得失电子守恒(化合价升降相等),反应中氯 元素化合价由+1→-1(化学计量数为3),因此M元素的化合价由+3升高到+6(化
2.(2021·柳州质检)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物 质”在40~50℃时反应可生成它。CuH在氯气中能燃烧;与稀盐酸反应能生成 气体;Cu+在酸性条件下发生的反应是2Cu+====Cu2++Cu。根据以上信息,结合 自己所掌握的化学知识,回答下列问题: (1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这 “另一物质”在反应中作__________(填“氧化剂”或“还原剂”)。 (2)写出CuH在氯气中燃烧的化学反应方程式: ____________。 (3)CuH溶解在稀盐酸中生成的气体是__________(填化学式)。 (4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足 量稀硝酸中反应的离子方程式:____________。
学计量数为2),由此判断D正确(另解可以根据电荷守恒快速判断n=2,进而确
定M的化合价为+6)。
2.将一定量铁粉加到一定浓度稀硝酸中,金属恰好完全溶解,反应后溶液
中存在:c(Fe2+)∶c(Fe3+)=3∶2,则参加反应的Fe和HNO3的物质的量之比
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案★解析★附后。
关闭Word文档返回原板块。
核心素养测评五氧化还原反应概念和规律一、选择题(本题包括4小题,每题6分,共24分)1. (2019·佛山模拟)中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700 ℃时反应制造出纳米级金刚石粉末和另一种化合物。
该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。
同学们对此有下列一些“理解”,你认为其中错误的是( )A.这个反应是氧化还原反应B.金刚石属于金属单质C.另一种化合物为NaClD.制造过程中元素种类没有改变【★解析★】选B。
CCl4和金属钠反应生成金刚石(碳单质),碳元素的化合价降低,有元素的化合价变化,属于氧化还原反应,A项正确;金刚石的构成元素为碳,属于非金属单质,B项错误;根据原子守恒,CCl4和金属钠反应得到金刚石(碳单质),另一种化合物包括Na和Cl元素,为NaCl,C项正确;根据元素守恒定律可知制造过程中元素种类没有改变,D项正确。
2.相同物质的量的KClO3分别发生下述反应:①有催化剂MnO2存在时,受热分解得到氧气;②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。
下列关于①和②的说法不正确的是( )A.都属于氧化还原反应B.发生还原反应的元素相同C.发生氧化反应的元素不同D.生成KCl的物质的量相同【★解析★】选D。
有MnO2作催化剂时发生反应:2KClO32KCl+3O2↑,被氧化的元素为O,被还原的元素为Cl;若不用MnO2作催化剂时发生反应:4KClO33KClO4+KCl,被氧化与被还原的元素都是Cl,由两种条件下反应的化学方程式可推知等物质的量的KClO3参加反应时,生成KCl的物质的量不同。
【加固训练】(2020·滁州模拟)制取新型水处理剂ClO2的化学方程式为2KClO 3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O。
下列说法错误的是( )A.KClO3在反应中得到电子B.ClO2是还原产物C.H2C2O4 在反应中被氧化D.1 mol KClO3参加反应有2 mol电子转移【★解析★】选D。
反应中氯元素的化合价由+5降低为+4,则KClO3为氧化剂,在反应中得到电子,A项正确;因KClO3为氧化剂,在反应中被还原,则ClO2是还原产物,B项正确;反应中碳元素的化合价由+3升高到+4,则H2C2O4为还原剂,在反应中被氧化,C项正确;反应中氯元素由+5降低为+4,1 mol KClO3参加反应有1 mol×(5-4)=1 mol 电子转移,D项错误。
3.(双选)(2019·衡水模拟)已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝下列判断不正确的是( )A.化合物KCrO2中铬元素为+3价B.实验①证明Cr2O3是两性氧化物C.实验②证明H2O2既有氧化性又有还原性D.实验③证明氧化性:Cr2<I2【★解析★】选C、D。
化合物KCrO2中,K为+1价,O为-2价,由正负化合价代数和为零知,铬元素为+3价,A正确;由实验①可知,氧化铬与酸、碱反应生成盐和水,证明Cr2O3为两性氧化物,B正确;由实验②可知,铬元素的化合价升高,过氧化氢中氧元素的化合价降低,故H2O2有氧化性,C错误;由实验③中溶液变蓝,可知生成碘单质,K2Cr2O7为氧化剂,I2为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,D 错误。
4.(2020·石家庄模拟)氟化氯(ClF)是一种卤素互化物,能与大多数非金属反应,与硫单质反应为6ClF+S SF 6+3Cl2。
下列说法不正确的是( )A.SF6中S的化合价为+6B.Cl2为还原产物C.氧化剂与还原剂的物质的量比为1∶6D.每生成1 mol SF6,反应转移6 mol电子【★解析★】选C。
根据化合物中正负化合价代数和为0可知SF6中S 的化合价为+6,A项正确;该反应氧化剂、还原剂分别为ClF、S,所以氧化剂与还原剂的物质的量比为6∶1,C项错误;该反应中氯化合价由+1降低为0,所以氯元素被还原,Cl2为还原产物,B项正确;每生成1 mol SF6,反应转移6 mol电子,D项正确。
二、非选择题(本题包括2小题,共26分)5.(12分)(2019·武汉模拟)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一。
(1)三氟化氮可由氨气和氟气反应得到:4NH 3+3F2NF3+3NH4F。
NH3的电子式为______________,反应中氨气显示的化学性质有________,当有17.0 g氨气发生反应时,转移电子的物质的量为________。
(2)在潮湿的空气中,NF3能与水蒸气发生反应,产物为HF、NO和一种酸,则被氧化与被还原的元素的物质的量之比为________,NF3、F2、NO三种气体氧化性由弱到强的顺序为________。
(3)三氟化氮在空气中泄漏时,很容易被发现,依据的现象是______________。
(4)NCl3的结构类似NF3,但NCl3中N元素显-3价,NCl3遇水发生反应,且反应为非氧化还原反应,该反应的化学方程式为__________________。
【★解析★】(1)NH3是共价化合物,结构式为,电子式为H,反应中部分NH3转化为NF3,氮元素化合价升高,NH3体现还原性;反应中部分NH3转化为NH4F,生成了盐,NH3体现碱性。
反应4NH 3+3F2NF3+3NH4F转移6e-,因此当有17.0 g氨气,即1 mol氨气发生反应时,转移电子的物质的量为6 mol÷4=1.5 mol。
(2)NF3与水蒸气的反应中,F元素化合价不变,N元素由+3价降为+2价,则生成的酸中N元素的化合价升高,故该酸为HNO3。
配平该化学方程式为3NF3+5H2O2NO+HNO3+9HF。
NF3HNO3,被氧化,NF3NO,被还原,根据得失电子守恒,则被氧化与被还原的元素的物质的量之比为1∶2;由4NH 3+3F2NF3+3NH4F,可知氧化性:F2>NF3,由3NF3+5H2O2NO+HNO3+9HF,可知氧化性:NF3>NO,则氧化性:F2>NF3>NO。
(3)NF3易与空气中的氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,因此依据的现象是产生红棕色气体,有刺激性气味,产生白雾。
(4)NCl3中N元素显-3价,NCl3遇水发生反应,且反应为非氧化还原反应,所以生成物是次氯酸和氨气,该反应的化学方程式为NCl 3+3H2O NH3+3HClO。
答案:(1)H 还原性、碱性 1.5 mol(2)1∶2 NO<NF3<F2(3)有红棕色气体产生、有刺激性气味、产生白雾(4)NCl 3+3H2O NH3+3HClO6.(14分)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。
AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。
下列叙述不正确的是________(填字母)。
A.亚硝酸盐被还原B.维生素C是还原剂C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂(2)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:__________________。
(3)Fe与过量稀硫酸反应可以制取FeSO4,若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是__________(填字母)。
a.Cl2b.Fec.H2O2d.HNO3(4)FeSO4可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钾(K2FeO4),氧化性比Cl2、O2、ClO2、KMnO4更强,主要反应:2FeSO 4+6Na2O22Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的氧化剂是__________,还原剂是______________。
②简要说明K2FeO4作为水处理剂时所起的作用______________。
【★解析★】(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,铁元素化合价降低,被还原,则维生素C具有还原性,而亚硝酸盐会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中亚硝酸盐为氧化剂,所以维生素C是还原剂。
(3)由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以最佳试剂是双氧水。
(4)该反应中铁元素化合价由+2变为+6、氧元素化合价由-1变为0、-2,①得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以Na2O2是氧化剂,Na2O2、FeSO4是还原剂,②K2FeO4中铁元素的化合价为+6,具有强氧化性,且还原产物铁离子能水解生成氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质。
答案:(1)D(2)N+Cl 2+H2O N+2H++2Cl-(3)c (4)①Na2O2Na2O2、FeSO4②高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降一、选择题(本题包括3小题,每题6分,共18分)1.(2020年山东等级考模拟)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。
马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:下列说法错误的是( )A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2∶1B.若反应①通过原电池来实现,则ClO2是正极产物C.反应②中的H2O2可用NaClO4代替D.反应②条件下,ClO2的氧化性大于 H2O2【★解析★】选C。
A.根据流程图反应①中氧化剂是NaClO3,还原剂是SO2,还原产物是ClO2,氧化产物是NaHSO4。
根据化合价升降相等可得NaClO3和SO2的物质的量之比为2∶1,A项正确;B.由反应①化合价变化情况,再根据原电池正极表面发生还原反应,所以ClO2是正极产物,B项正确;C.据流程图反应②,在ClO2与H2O2的反应中,ClO2转化为NaClO2氯元素的化合价降低,作氧化剂;H2O2只能作还原剂,氧元素的化合价升高,不能用NaClO4代替H2O2,C项错误;D.据流程图反应②ClO2与H2O2反应的变价情况,ClO2作氧化剂,H2O2作还原剂,可以推出ClO2的氧化性大于H2O2,D项正确。
