第六章-烃化反应
烃基化反应和烷基化反应

烃基化反应和烷基化反应烃基化反应和烷基化反应是有机化学中常用的反应类型,它们分别指的是在分子中引入烃基或烷基基团的化学反应。
烃基化反应是指在有机分子中引入烃基(或烯烃基)的化学反应。
这种反应可以通过直接的取代反应或通过碳-碳键断裂和重组来实现。
常见的烃基化反应包括Wurtz反应和Corey-House反应等。
Wurtz反应是一种重要的烃基化反应,它是通过反应两个卤代烃与金属钠或金属钾来实现的。
在反应中,卤代烃首先与金属钠或金属钾发生失去卤根离子(X-)的反应,生成自由基的烷基钠或烯烃基钠。
然后,两个烷基钠或烯烃基钠通过反应生成一个新的碳-碳键,产生所需的烃基化产物。
Wurtz反应在合成有机化合物和精细化工中得到了广泛的应用。
Corey-House反应是另一种重要的烃基化反应。
该反应是通过卤代烷与Grignard试剂反应来引入烃基。
在反应中,卤代烷通过和Grignard试剂反应失去卤根离子,生成烷基或烯烃基中间体。
然后,这些中间体再和电子亲和性较强的电子受体反应,形成烃基化产物。
Corey-House反应常用于精细化工和药物合成领域。
烷基化反应是指在有机分子中引入烷基基团的化学反应。
这种反应通常通过取代反应或通过碳-碳键断裂和重组来实现。
常见的烷基化反应包括自由基取代反应和卤代烃与卡宾反应等。
自由基取代反应是一类常用的烷基化反应。
在这种反应中,通常是通过光解或热解能够产生自由基的化合物来引发反应。
在自由基取代反应中,自由基首先与烷基化底物中的氢原子发生反应,形成碳-碳键和碳-碳键。
这种反应常用于合成药物、染料等有机化合物。
卤代烃与卡宾反应也是一种重要的烷基化反应。
在这种反应中,卤代烃与卡宾中间体反应,生成烷基化产物。
卡宾中间体是一类高度反应性的中间体,它是由碳-氧键断裂或碳-卤键断裂形成的。
卡宾中间体在反应中通常通过与醛、酮等具有亲核性的化合物反应,形成烷基化产物。
卡宾反应在合成有机化合物中具有重要的应用和研究价值。
有机化学第六章烯烃

CH3
CH2CH3
CC
H
H
顺-2-戊烯
H
CH2CH3
CC
CH3
H
反-2-戊烯
Z式:双键碳原子上两个较优基团或原子处于双键同侧。
E式:双键碳原子上两个较优基团或原子处于双键异侧。
(优)CH3 C
H
CH2CH3(优)
CH3
C
C
CH3
(优)CH3CH2
CH(CH3)2(优) C
CH2CH2CH3
(Z)- 3-甲基-2-戊烯 (E)- 3-甲基-4-异丙基-3-庚烯
68% 17%
Br + C6H5CH CHCH3
-Br 环正离子
C6H5CH=CHCH3 Cl2
+ Cl C6H5CH CHCH3 Cl-
*
碳正离子
Cl- Cl
+
C6H5CH CHCH3
离子对
一般情况,加溴通过环正离子中间体 进行。
加氯通过环正离子中间体、碳正离子 或离子对进行。
立体选择性反应(stereoselective reaction)
0.33 0 /10-30 c.m 4oC -138.9oC
反式异构体对称性较高,熔点高于顺式异构体。 顺式异构体极性较强,沸点高于反式异构体。
第五节 化学反应
(一)催化氢化 (二)亲电加成反应 (三)自由基加成反应 (四)硼氢化反应 (五)氧化反应 (六) -氢卤代反应 (七) 聚合反应
(一) 催化氢化
顺式烯烃
H
H
C C Br2
CH3
CH3
H
H
Br
CH3
a Br-
CH3 b
Br
烃化反应技术习题及答案

模块三烃化反应技术习题及答案一、简答题1.常用的烃化剂有哪些?进行甲基化及乙基化时,应选择那些烃化剂?引入较大烃基时应选择那些烃化剂?2.什么叫相转移催化反应?其原理是什么?采用相转移催化技术有什么优点?3.什么是Williamson合成?影响因素有哪些?4.什么是羟乙基化反应?在药物合成中有何意义?5.氮原子上的烃化有何意义?6.什么是F-C反应?7.什么是Blanc反应?有何意义?8.影响相转移催化反应的主要因素有哪些?二、完成下列反应1. CH3ONa + ClCH2COOCH3CH3OH/PH=8-964-66℃,3h2. CONH2 OH3.BrOHHO PhCH2Cl/Me2CO/KI/K2CO34. ClNO2EtOH/NaOH5. ClCH2CH2CH2OHNaOH6. OH247. CH3CHCOOHBr38. O2N ClNO2349. (C2H5)NH +O10. CH2NHCH3+Or.t11.CH33+OAlCl3CH3CCH2COOEt + n BuBr12.习题答案一、简答题1.卤代烃、酯类、环氧乙烷类;常用的加计划及乙基化试剂是硫酸二甲酯和硫酸二乙酯;引入较大烃基时可选择芳磺酸酯烃化剂。
2.使用相转移催化剂(季铵盐或季磷盐)使一种反应物由一相转移到另一相,促使一个可溶于有机溶剂的底物和一个不溶于此溶剂的离子型试剂两者之间发生反应,称为相转移催化反应。
原理是催化剂在两相之间不断来回运输,把反应物从一相转移到另一相(通常以离子对的形式),使原来分别处于两相的反应物能够频繁地碰撞而发生反应。
优点:非均相反应由于反应物处于不同的相中,所以这类反应速度慢、效率低、反应不完全。
解决办法是选用非质子性溶剂,但又存在价格昂贵、不易回收及后处理麻烦。
使用相转移催化剂可节约昂贵的非质子极性溶剂,可用碱金属氢氧化物水溶液代替醇盐、氨基钠、氢化钠及金属钠等,反应快,条件温和,后处理容易还可提高反应的选择性,抑制副反应,提高收率等。
《烃化反应》课件

子效应和空间效应均可影响碳正离子的稳定性。
亲核取代过程是放热反应,其速率主要受亲核试剂的活性影响。在亲核 取代过程中,溶剂效应、温度、压力等因素也会影响反应速率和产物构 型。
烃化反应的影响因素
底物的影响
底物的结构和取代基的性质对烃化反应的影响较 大。在底物分子中,未取代的碳-氢键的数目和取 代基的性质均可影响碳正离子的形成和稳定性。
溶剂的影响
溶剂的极性和酸碱性对烃化反应的影响较大。在 极性溶剂中,反应物的溶解度和反应速率均会增 加。此外,酸碱性溶剂可影响碳正离子的稳定性 ,进而影响反应速率和产物构型。
烃化反应的挑战与机遇
挑战
如何实现绿色低碳发展、提高反 应效率和选择性、降低能耗和资 源消耗等是烃化反应面临的挑战 。
机遇
随着科技的不断进步和社会需求 的增加,烃化反应在化工、医药 、新能源等领域的应用前景广阔 ,具有很大的发展机遇。
烃化反应的前沿研究动态
新催化剂研究
针对烃化反应的催化剂进行创新研究, 开发高效、环保、低成本的催化剂体系
氨基烃化
在氨氮上添加烃基,生成胺类 化合物。
烃化反应的重要性
01 02
在有机合成中的重要性
烃化反应是有机合成中的重要反应之一,可以用于合成高分子材料、药 物、香料等。通过烃化反应,可以改变有机物的官能团和结构,生成新 的化合物。
在工业生产中的重要性
烃化反应在工业生产中具有广泛的应用,如生产塑料、合成橡胶、农药 、染料等。通过烃化反应,可以生产出具有特定性能和用途的化学品。
烃化反应的未来发展方向
绿色低碳
第六章 烃基化反应

用于治疗痤疮和银屑病的药物阿达帕林中间体6-5的合成, 是由硫酸二甲酯与酚在碳酸钾存在下发生甲基化反应完成的。
4. 芳磺酸酯是应用十分广泛的一类用作烃基化剂的酯,其中对甲苯磺酸 酯和苯磺酸酯是最常见的。磺酸负离子为优良的离去基团,因此芳磺酸 酯作为烃基化剂的反应活性很好,在药物合成中需要引入分子量较大的 烃基时显示出其优势。用于治疗慢性乙肝炎的药物阿德福韦酯中间体6-6的合成中,一条优势
4. 环氧乙烷类烃基化剂在烃基化反应中活性高,反应条件温和,且反应 速率快,在药物合成中应用广泛。眼科用药曲伏前列素中间体6-8的合成,通过
选择环氧氯丙烷为烃基化剂,完成酚羟基氧原子上烃基化反应。
第二节 N原子上的烃基化反应
N原子上的烃基化反应,是指向氨或胺的氮原子上引入烃 基的反应。这是制备各种脂肪族和芳香族伯、仲、叔胺的 主要方法。此类反应也属于亲核取代反应。由于氨和胺氮原
• 鉴于胺或氨与卤代烃的直接烃基化反应产物的难控性,因此在药物 合成中的应用受到了极大的限制。选择性地实现N原子上的烷基化在 药物合成中具有重要的应用价值,常见的方法包括下述几种。
1. Delépline反应:利用卤代烃为原料,通过N-烃基化反应制备伯胺的一 种重要方法。首先,六亚甲基四胺与卤代烃反应形成季铵盐,然后利用 六亚甲基四胺易水解的性质,在醇中进行酸性水解即可得到伯醇。由于 环六亚甲基四胺中的氮原子均为叔胺氮,能保证不发生多烃基化反应。 Delépline反应具有反应选择性高、原料便宜、操作简便等优点,但由于 六亚甲基四胺上氮原子的亲核性较弱,只能与具有较高反应活性的卤代 烃(如苄基卤、烯丙基卤等)反应形成季铵盐,因此也限制了其应用范围。
2. 影响反应的主要因素 1) 羟基化合物结构的影响 a) 醇羟基氧含有的孤对电子可作为亲核试剂发生相应的亲核取代反应, 但反应通常是在碱性条件下完成的。弱酸性的醇在碱性条件下,能可逆 地生成相应的烷氧基负离子,通常其显现出比羟基更强的亲核性。 b) 不同结构的醇,羟基的酸性不同。在同种碱存在下,亲核能力也不同。 即使二苯甲醇,在醇钠等碱存在下,也能与氯代烃发生O-烃基化反应。 对空间位阻大的醇羟基氧的羟基化,通常在类似条件下是不能完成的, 特别是当烃基化剂是甲基以外的其他烃基化剂时,这种现象更加突出。
烃化反应

烃化反应 31/60
1、伯胺的制备
1)“过量的氨” 法 加入铵盐,有利于反应的进行
O2N Cl NO2 NH3/AcONH4 O2N NH2 NO2
烃化反应 32/60
2) Gabriel合成法-“邻苯二甲酰亚胺”
O NH O KOH/ EtOH O NK O RX/DMF (SN2) O O N R NH2NH2 HCl/H2O RNH2 + CO2H RNH2 + O NH NH O CO2H
ROH H3C SO2R
H3C
SO2Cl
CH2OH HC OH CH2OH
HCl/Me2CO
CH2OH HC O CH2O
CH2OC18H37 HCl/EtOH C18H37OTs/KOH/Tol HC O 2h CH2O
CH2OC18H37 HC OH CH2OH
烃化反应 10/60
3、环氧乙烷: 碱催化:SN2
R O R'O R O OR' H R C O OR' R'OH OR' H R C + R'O OH
酸催化:SN2---SN1
R O H R O H R O R'OH HO R' R O H
HO R' R OH
_
H R
OR' OH
烃化反应 11/60
实例:
H2SO4 H Ph C CH2 + MeOH O CH3ONa
烃化反应
Alkylation
定义
有机分子中的氢原子被烃基取代的反应 引入方式:取代或加成 反应机理:亲核取代、亲电取代等
烃化反应 2/60
烃化反应

活性:RI>RBr>RCl>RF 成本:RI>RBr>RCl
第一节 氧原子上的烃化反应
一 醇的O-烃化
1 卤代烷为烃化剂:醇在碱的条件下与卤代烷生成醚 影响因素 a RX的影响 RX的影响
ii) 当 X 相 同 时 卤 代 丙 烯 , 卤 苄 > 卤 代 烷 > 卤 芳 烃 A rX
一 醇的O-烃化 3 环氧乙烷类作烃化剂(羟乙基化反应)
实例
H2SO4 PHCHCH2OCH3 ref 5h OH 10% CH3ONa PHCHCH OCH 2 3 ref 5h
OH
第一节 氧原子上的烃化反应
+
PhCHCH2OH OCH3 90%
Ph-CH-CH2 + CH3OH
O
+ PH-CHCH2OH
例
CH2OH CHO CH3 CH O CH3
2
TsOC18H27/KOH Tol
CH2OC18H27 CHO CH3 CH3 CH2O
EtOH/HCl CH2OC18H27
△ CHOH CH2OH
甘油 +丙酮
一 醇的O-烃化 3 环氧乙烷类作烃化剂(羟乙基化反应)
ROH +
R H
第一节 氧原子上的烃化反应
Cl O Et N aO H 非那西丁中间体 NO2
+ E tO H
NO2
当卤代烃为叔卤代烃时,不能在强碱下反应, 易 消 除 HX, 可 在 中 性 或 弱 碱 性 下 反 应 。 CH3 CH3 C
B
CH2
+
C H 3 -C
CH3
第六章苯与芳香烃6-1.用次氯酸叔丁脂(t-BuOCl)对甲苯进行一元氯化
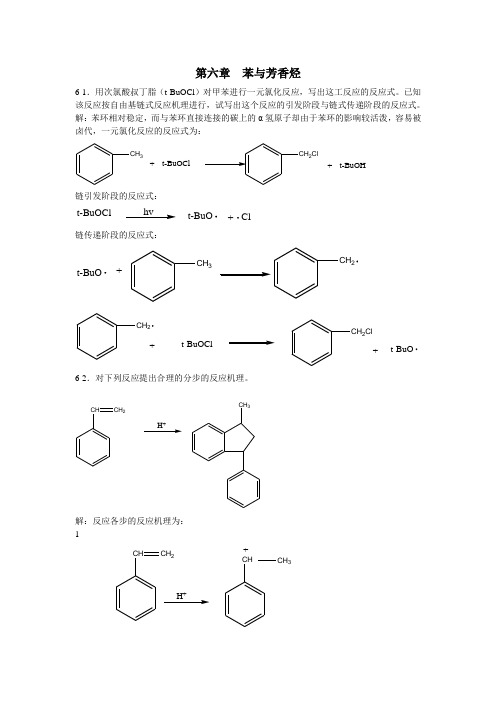
第六章 苯与芳香烃6-1.用次氯酸叔丁脂(t-BuOCl )对甲苯进行一元氯化反应,写出这工反应的反应式。
已知该反应按自由基链式反应机理进行,试写出这个反应的引发阶段与链式传递阶段的反应式。
解:苯环相对稳定,而与苯环直接连接的碳上的α氢原子却由于苯环的影响较活泼,容易被卤代,一元氯化反应的反应式为:CH 3+t-BuOCl2Cl+t-BuOH链引发阶段的反应式:t-BuOClhv+Cl t-BuO链传递阶段的反应式:+CH 3CH 2t-BuOt-BuOCl+CH 2ClCH 2+t-BuO6-2.对下列反应提出合理的分步的反应机理。
H +CH 3CHCH 2解:反应各步的反应机理为: 1CHCH 2H +CHCH 3+2CH3 4CHCH2 CH3CH HCH3 -H+6-3.写出下列反应的机理。
OR ROH R RH3O解:此反应机理如下:OR R H+OH+RROHRR+碳正离子重排OHRR6-4.写出下列反应的机理。
C CH3CH2H3CCH3H3C解,此反应机理如下:1.C CH3CH2H+CCH3CH3+2.32CCH33.H 3CCH 3HCH34.H 3CCH 3H 3C-H +6-5.写出下列反应的机理。
COOHCOOHNO 2HNO 3H 2SO 4,∆解,反应机理如下: 1.HONO 2∆+OH 2NO 2H 2O +22.NO 2+2COOHCOOH3.COOHNO 2COOHNO 2-H +6-6.写出下列反应机理。
CH 3AlCl 3HClCH 3CH 32+解:反应机理为: 1.CH 3H +CH 3H+CH 32.CH 3CH 3CH 3H +CH 3H+CH 3CH 36-7.亚硝基苯在发生亲电取代反应时,亚硝基是第一类定位基或是第二类定位基,他在致活或致钝苯环,简要解释之。
解:亚硝基苯在发生亲电取代反应时,亚硝基是第一类定位基,能使苯环活化,亲电基团主要进攻邻对位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-H2 CH3CH2OH 脱氢 乙醇
-H2O 脱水
CH3 CH NH
NH2 O NH +
+H2 加氢
CH3CH2NH2
NH -H2O/H2 , Ni
NH
橡胶防老剂4010
6.3 O-烷基化(主要用于制备芳醚,烷氧基化不 宜采用,如2-萘乙醚的制备)
H
Ar-H -H+
-H2O 脱水缩合
Ar-C R
Ar-C-Ar R
• 生产实例
(1)DDT滴滴涕(1,1,1-三氯-2,2’-双(对氯苯基)乙烷)
O Cl3C-C-H + 2
三氯乙醛
Cl
浓H 2SO4 o 15-30 C
Cl
H C CCl3
Cl
(2)双酚A(2,2’-双(4-羟基苯基)丙烷)
O CH3-C-CH3 + 2
醇羟基(R-OH)或酚羟基(Ar-OH)上的氢 原子被烷基取代,生成二烷基醚、烷基芳基醚或 二芳基醚的反应叫做O-烷基化反应。 烷化试剂:醇(R-OH)、卤化烷(R-X)、 环氧烷类等。
• 用醇类的O-烷化
ROH + R'OH
ROH + H2SO4
大量浓H 2SO4
δ+
R-O-R' + H2O
R-O-R' + H2SO4H
HCl o 130-150 C HCl H2O,回流7h
NH(CH2CH2CN)
N(CH2CH2CN)2
NH2 + 2CH2=CH-C-OCH3 NHCOCH3
N(CH2CH2COOCH3)2
CH3COOH,100 C 20h
o
NHCOCH3
6.2.6 用醛、酮作烷化剂的N-烷化反应
醇 脱氢 加氢 加成胺化 脱水 羟基胺 醛 烯亚胺 胺 NH3
RNH2 CH2 CH2 O K1 CH2 CH2 O RNHCH2CH2OH K2 RN(CH2CH2OH)2
K1与K2相差不大
(3)酸催化反应。
CH2 CH2 + H+ O NH2 C2H5OH CH2 CH2 O H
开环
+
CH2CH2OH
亲电试剂
NHC2H5 CH2 CH2 O
N
C2 H5 CH2CH2OH
• 用硫酸酯的N-烷化 (1)可在-NH2的N上烷基化而不影响-OH; (2)有多个氨基时,可根据N原子的碱性,选 择性地对一个N烷基化; (3)缺点:毒性大。 • 用芳磺酸酯的N-烷化
6.2.4 用环氧乙烷作烷化剂的N-烷化反应
• 特点
(1)反应活性高,在N上引入CH2CH2OH; (2)连串反应;
6.2.1 用醇类作烷化剂的N-烷化反应
• 反应历程
Ar-NH2 + R+
伯胺
ROH + H+
R+-OH2
R+ + H2O
H Ar-N+-R H
Ar-N-R + H+ H 仲胺 R+
R Ar-N-R + H+
叔胺
R Ar-N+-R H
R
+
R Ar-N+-R R
季铵盐
• 特点 (1)以R+为活性质点的亲电取代反应; (2)使用强酸性催化剂以提供质子; (3)连串反应; (4)受空间效应的影响,以高碳醇对芳胺进 行N-烷化时,只得到一烷苯胺 (5)可逆反应。
CH3 CH3
C=CH2
+ H
+
CH3 CH3
C-CH3
• 重要品种介绍 (1)异丙苯(液相、气相法)
+
液相AlCl3/HCl:
CH2=CH-CH3
CH3 CH CH3
6~7
1
80~100 ℃,0.2~0.3MPa 250-350℃,0.3~1.0MPa
气相H3PO4/SiO2(固)
(2)间异丙基甲苯
K2/K1=1/4
• 实例 N,N-二甲基苯胺
NH2 + 2CH3OH 摩尔比 : 1 3.2
高压液相烷化法 H2SO4
N(CH3)2 ( + 96%
NHCH3 )
0.11 温度:205-215oC 压力:3.0-3.2MPa 时间:5h
(含量0.5%)
6.2.2 用卤烷作烷化剂的N-烷化反应(不可逆) • 烷化剂
NH2
BrCH2CF3 NaOH
NHCH2CF3
• 主要产品:N-乙基-N-苄基苯胺
NHC2H5 + ClCH2
<100 C 水介质
o
C2H5 N CH2 + HCl
6.2.3 用酯作烷化剂的N-烷化反应
O R-O-S-O-R O
硫酸二烷基酯
O Ar-S-OR O
芳磺酸酯
O HO-P-OR OH
磷酸单酯
Ar-NH2 + ROH Ar-NHR + ROH K1 K2 ArNHR + H2O ArNR2 + H2O
NH2 + CH3OH
200 C K1
o
NHCH3
CH3OH K2
N(CH3)2
K2/K1=1000
NH2 + C2H5OH
200 C K1
o
NHC2H5
C2H5OH K2
N(C2H5)2
H Ar R
快
AlCl4
Ar-R + AlCl3 + HCl
R+
AlCl4-
R+ + AlCl4烷基正离子
离子对
• 生产实例(工业上可用铝锭或铝球,不直接 使用无水氯化铝)
Cl CH2Cl +
ZnCl2 o 85-90 C
Cl
CH2
对氯二苯甲烷
医药中间体
Cl 2 + CCl4
AlCl3 10 C,3h
70%
CHCH2CH3
+
30%
异构化
CH3-CH-CH2 H
伯碳正离子
氢转移重排
CH3-CH-CH3
仲碳正离子
6.1.1 用烯烃作烷化剂的C-烷化反应
• 反应历程(连串、可逆、重排等)
CH2=CH + H+ CH2-CH3
. .. . . ..
+ CH2-CH3
慢
H CH2-CH3
快
C2H5
+ H+
-H+
O R-O-S-OH R'OH O
R-O-R'
ROH
R-O-H 质子化 H
-H2O
H+
R'OH
R-O-R' + H2O H
-H
-H+
R-O-R'
+
R+
R'OH
R-O-R' H
CH2OH -H+
-H+
CH2OH2 -H O 2 OH2
-H2O
CH2+
OH
CH2
• 用卤烷的O-烷化
R-OH + R'
过量
OH
酸性催化剂 脱水缩合
HO
CH3 C CH3
双酚A
OH
阳离子交换树脂催化
6.2 N-烷基化
氨基上的氢原子被烷基取代的反应叫做 N-烷基化反应。
烃化试剂:醇、卤代烷、酯、烯烃、醛和酮、 环氧乙烷等。 用途:(1)引入-CH2CH2OH、-CH2CH2CN极性、 非水溶性基团; (2)制备季铵盐型阳离子化合物; (3)其它助剂、医药中间体。
BF3 可以同醇、醚或酚等形成具有催化活性的络合物,副反应少。
H2SO4
:避免副反应发生,浓度很重要;
HF酸:用途广泛;
磷酸或多磷酸:是烯烃烷基化的良好催化剂;
阳离子交换树脂; 分子筛; 烷基铝
4) C-烷化反应的特点
• 连串反应 • 可逆反应
R + H+ H+ AlCl4RH
. . .. . . .
NH2
C4H9 染料中间体
(2)酚类的C-烷化
OH OH + (CH3)3COH
叔丁醇 磷酸催化 二甲苯溶剂 回流
OH OH + H2O C(CH3)3
(3)萘的C-烷化
6.1.4 用醛、酮作烷化剂的C-烷化反应
• 反应历程
H C=O R + H
+
质子化
H C-OH R H
H Ar-H + C-OH R
CH3
3 + CH2=CH-CH3 100oC
CH3
AlCl
CH3
氧化酸解 氨解
CH3 NH2
CH3 CH CH3
OH
(3)十二烷基苯(α -烯烃为烷化剂,得到混合物)
C12H25 + C12H24
AlCl3,HF
(4)酚类的C-烷化
OH + H2C=C(CH3)2
苯酚铝催化剂 o ~200 C,~2MPa
H2C CH2
H3C HC CH2
(5)烯烃和炔烃:CH2=CH2, CH3CH=CH2, R-CH=CH2, CH2=CHCN, CH2=CHCOOCH3, CH≡CH; (6)羰基化合物:HCHO, CH3CHO, C3H7CHO, Ph-CHO, CH3COCH3, O
