高等有机化学 第五章 芳环讲解
09.09有机化学二脂环、芳环
1
CH3
3
螺[2.4]庚烷
2
5-甲基螺[2.4]庚烷
桥环——共用两个C 7 CH2–CH–CH2 1 2 CH2 CH2 8 3 5 4 CH2–CH–CH2 6 共用C称为——桥头碳
编号从一个桥头C开始,先编最长桥,经另 一桥头C,再编次长桥,最后编短桥。
桥环化合物的命名 • • • • 组成环的碳原子总数称为某烷 词头为“双环” 编号:从某一桥头C起,从大环 小环 各“桥”的碳原子数,按由大到小的次序写在 “双环”和“某烷”之间的方括号里,数字用 圆点分开。 • 环上有取代基时,取代基有最小序号(和)。
三、环己烷衍生物的构象 甲基环己烷
CH3 |
CH3
CH3 5% 大基团位于e键稳定 95%
H3C
CH2CH3
CH3
CH2CH3
本章要点
1. 环烃的命名 2.脂环烃的化学性质
3.环己烷及衍生物的构象
本章习题:p109
1,
6(2、3)
回顾4 环烷烃的命名 常规命名 • 以碳环为母体,侧链为取代基 • 母体的名称同直链烷烃,不同在于前加一“环”
多官能团取代苯命名原则
1. 主官能团有最小序号。
2. 多取代时,序号和最小。
OH | OH | CH3 | NO2
|
|
COOH
| CH3
4 - 甲基苯酚
3 – 羟基苯甲酸
2 – 硝基甲苯
OCH3
NO2
p-硝基苯甲醚 (4-硝基苯甲醚)
常见芳基
CH2—
苯基
苄基
phenyl
benzyl
6 − 2 苯的结构
2.多环芳烃
分子中含有两个和两个以上的苯环
《有机化学》(第四版)第五章 芳烃(习题答案)

第五章 芳烃 芳香性思考题P152 习题5.1 写出四甲(基)苯的构造异构体并命名。
解:CH 3CH 3CH 33CH 3CH 3CH 3H 3CCH 3CH 33H 3C1,2,3,5-四甲(基)苯1,2,3,4-四甲(基)苯1,2,4,5-四甲(基)苯P152 习题5.2 命名下列各化合物或基:解:CH 3C 2H 5CH(CH 3)2CH 2CH 2C=C3HH 3C1-甲基-2-乙基-4-异丙基苯1,2-二苯乙烷顺-2-苯基-2-丁烯(E)-2-苯基-2-丁烯CH 3CH 3CHC(CH 3)3(CH 3)3C 2,6-二甲基苯基β-苯乙基2,2,4,4-四甲基-3-苯基戊烷CH 2CH 22-苯乙基P153 习题5.3写出下列各化合物或基的结构式:(1) 异丁苯CH 2CHCH 3CH 3(2) 间甲苯基环戊烷CH 3(3) (E)-1,2-二苯乙烯C=CH PhPhH(4) 顺-5-甲基-1-苯基-2-庚烯HHCH 2CHCH 2CH 3CH 2CH 3(5) 二苯甲基C 6H 5C 6H 5 (6) 3-苯基-2-丙烯基CH 2CH=CH C 6H 5P156 习题5.4 甲苯的沸点比苯高30.5℃,而熔点低~100℃,为什么?解:甲苯的相对分子质量大于苯,分子间色散力大于苯,因比甲苯的沸点也高于苯;但苯分子的对称性好,晶格能大于甲苯,因此苯的熔点高于苯。
P161 习题5.5 写出乙苯与下列试剂作用的反应式(括号内是催化剂):(1) Cl 2(FeCl 3) (2) 混酸 (3) 正丁醇(BF 3) (4) 丙烯(无水AlCl 3) (5) 丙酸酐(CH 3CH 2CO)2O(无水AlCl 3) (6) 丙酰氯CH 3CH 2COCl(无水AlCl 3) 解:(1)CH 3CH 2CH 3CH 2ClClCH 2CH 3Cl FeCl 3+(2) 混酸CH 3CH 2CH 3CH 2NO 2+NO 2CH 2CH 3(3)3323C 2H 5CHCH 2CH 33CH 2CH 3+CHCH 2CH 3CH 2CH 33(4)233+CH(CH 3)2CH 2CH 3CH 2CH 3CH 2CH 3CH(CH 3)2(5)3223+COCH 2CH 3CH 2CH 3CH 2CH 3CH 2CH 3CCH 2CH 3O(6)323CH 2CH 3+COCH 2CH 3CH 2CH 3CH 2CH 3CCH 2CH 3OP161习题5.6 由苯和必要的原料合成下列化合物:(1)解:HO 24+(或环己烯)(2) 叔丁苯解:CCH 3CH 3CH 3+ CH 2CH 3CH 3H 2SO 4(3) CH 2(CH 2)5CH 3解:HCl+2)5CH 3OCH 3(CH 2)5C OCH 2(CH 2)5CH 3(4)CH 2CH 2OOH O解:OOO+3C CH 2CH 2C OH OOP164 习题5.7 试以苯和必要的原料合成正丙苯。
5第五章芳环上的取代反应

H H C H
C C
C C
H C H H
芳环上离域的π电子的作用,易于发生亲电取代反 应,进攻试剂为正离子或偶极及诱导偶极的正的一端, 而离去的原子团不带成键电子对。 只有当芳环上引入了强吸电子基团,才能发生亲核 取代反应。在亲核取代反应中,进攻试剂是负离子或具 有未共用电子对的原子或基团,离去基团以弱碱负离子 或分子的形式离去,其实用价值不如亲电取代反应。
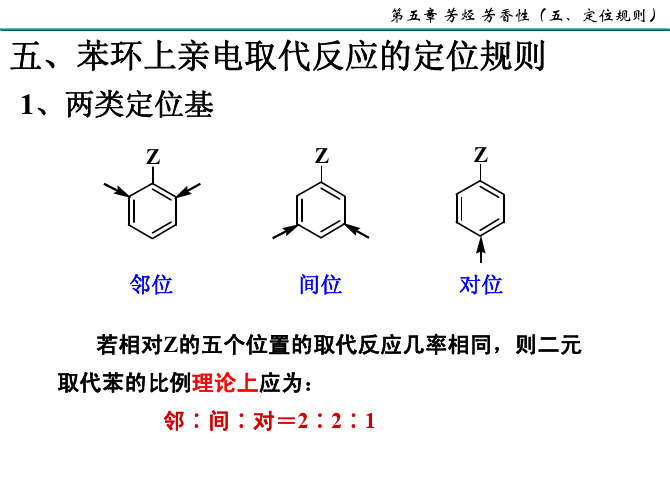
% %p %m o 相 对 速 率 3 7 3 0 1 7 6 6 9 2 2 9
2) 空间效应越大,对位产物越多:
C(CH3)3 H2SO4 C(CH3)3
100%
SO3H
极化效应:
X
X o% p% F 12 88 Cl 30 69 I 32 60
m% 0 1 8
X 具有-I效应,使邻位的电子云密度降低。 F Cl Br I
一. 亲电取代反应
(一) 加成-消除机理
HE
+ E N u
E
σ-络合物 芳正离子
H N O 3
H S O 2 4
N O 2
+ + 2 H S O N O H N O O H S O 2 2 4 3 H 3 4 2
+ N O 2
N O 2 芳正离子生成的 H 一步是决定反应
速率的一步
卤代反应:
e B r r B rF B r + F e B r 3 2 3 B
溴分子在FeBr3的作用下发生极化
R e B r B rB rF R B r + + F e B r B r 3 H
δ
δ
生成芳正离子
R
B r H
R
B r + H
有机化学第五章1讲解
室温 AgCl 立即
AgCl(立即)
加热
AgNO3 AgCl (稍慢) AgCl 稍慢 EtOH
AgCl AgCl
2019/5/10
1.4.2 消除反应
β
α
2019/5/10
2019/5/10
查依采夫规则
2019/5/10
2019/5/10
1.4.3 与金属反应
① 与镁反应
RX + Mg
无水乙醚
④ 与氨作用
卤代烷与氨作用,卤原子被氨基取代生成伯胺
RX + 2 NH3 RNH2 RX RNH2 + NH4X R2NH RX R3N RX R4N X
因为生成的伯胺仍是一个亲核试剂,它可以继 续与卤代烷作用,生成仲胺或叔胺的混合物,故反 应要在过量氨(胺)的存在下进行
2019/5/10
⑤ 与硝酸银作用 (用于鉴别卤代烷烃)
0.194
C—I 218
0.214
故C—X 键比C—H键容易断裂而发生各种化学 反应。
2019/5/10
1.3 卤代烷烃的物理性质
① 沸点:M↑,b.p↑
碳原子数相同的卤代烷:RI>RBr >RCl 支链↑, b.p↓
② 相对密度:一氯代烷<1;一溴代烷和一碘
代烷>1,同系列中,卤代烷的相对密度随 碳原子数的↑而↓ ③ 可燃性:随X原子数目的↑而↓ ④ 不少卤烷带有香味,但卤烷蒸汽有毒,特别 是碘烷,应防止吸入
Corey-House 反应
2019/5/10
反应机理的实验证据:
1.5.1 亲核取代反应历程
以溴甲烷和叔丁基溴水解为例
在80%乙醇 溶液中水解速度: 加入OH- 后: 固定[RX],改变[OH-]: 反应速率方程:
华南理工大学有机化学第5章-2
30%
69%
1%
第五章 芳烃 芳香性(五、定位规则)
(2) 第二类定位基(间位定位基)
对苯环有吸电子作用,使苯环钝化,对后引入基团进入苯环 起着间位定位作用的原子或基团,称为间位定位基。 第二类定位基和定位能力 : -CF3 ―N (CH3)3+ > ―NO2 > ―CN > ―SO3H > ―CHO > -COCH3 > ―COOH > ―COOR > ―CONH2 >―NH3+等. 符合下列条件之一的为间位定位基: 1、与苯环直接相连的原子不饱和的基团或原子(-CX3例外)。 2、与苯环直接相连的原子带有正电荷的基团。 3、对苯环有吸电子性能,使苯环钝化的原子或基团。
+
σ
.... 配合 物 . ..+ ..... I
H E
[
H E
NO2
+
Ib
---Ic
+
H E
]
NO2
NO2
NO2
+
NO2
σ
配合物
....... . .+. H E
Ⅱ
[
+
]
H E
Ⅱa
H E
b
---Ⅱ
H E
H E
Ⅱc
NO2
NO2 H E
NO2 H E
+
NO2
+
σ
配合 物
...... . ...+ ..
NHCOCH3
δ
δ
Cl , Br , I δ 烷基C-Hσ键与苯环存在 σ,π-共轭。
H δ H C H δ
δ
第五章 芳烃 芳香性(五、定位规则)
有机化学第五章芳烃PPT课件

甲苯
乙苯
异丙苯
(2)当苯与烯、炔相连时,习惯上把苯作取代基,不饱和
烃作母体。
-CH=CH2
-C≡CH
苯乙烯(或乙烯第苯1)1页/共114页
苯乙炔
(3) 若烃基的碳链较长或烃链上含有多个苯环时,一般把苯 作取 代基,烃作母体。
CH3 CH3
CH3CH2CH2-CH—CH-CH2
C
2,3-二甲基-1-苯基己烷
的分子,它的真实结构可以用几个经典结构式共同来表示。 这些参与了结构组成的经典结构叫做共振结构式,也叫极
限结构式。
第19页/共114页
+ - ……
O OC
O
O OC
O
OC O O
(二) 共振论的规则 共振结构式的本质是用价键结构式来反映共轭体
系中P电子离域的范围,即用多个合理的价键结构 式来描述电子的瞬间运动状态。
D. 在满足八电子体的共振结构式中,有电荷分离, 负电荷应在电负性较大的原子上。
O
CH3—C—CH2
O-
CH3—C CH2
第24页/共114页
稳定
E. 两个带有相同电荷的原子相隔越近、两个带有相 反电荷的原子 相隔越远,共振式能量高,不稳定, 对杂化体的贡献小
H E
+
+O N
不稳定
O-
三、共振论的优点和缺点 总结:共振论认为共振是一种稳定因素,参与共振 的共振式越多,杂化体越稳定;2)通常以能量最低, 稳定性最高的共振结构为标准,其真实分子即共振 杂化体所降低的能量叫共振能。
芳烃—— 芳香族碳氢化合物
(1)碳氢比高 如:
C : H = 1 : 1 C : H = 10 : 8
沈阳药科大学高等有机化学胡春—— 芳香性

芳香性的定义
1825年法拉第从鲸油裂解产生的气体冷凝液中 发现了苯,接着测定了苯的组成、蒸汽压、熔点、 密度等物理性质,1845年霍夫曼从煤焦油中也提取 出苯这种物质,并发现它非常稳定。1865年德国化 学家凯库勒从苯的分子式C6H6出发,根据苯的一元 取代物只有一种,推断出苯的环状结构式。实验证 明苯类化合物具有特殊的热稳定性,难发生加成和 氧化反应,易发生亲电取代反应,且保持碳环的结 构不变。人们把这种特性称为芳香性。
关于芳香性定义的讨论
(3)从化学性质角度。这是最原始也是最 直观的表现形式,但也是现在用的最少的一 个定义方式,因为化学反应需要涉及许多动 力性质,即与分子的非基态有关,则情况变 得更为复杂。而且在最新制的或理论上推出 的许多芳香化合物,很多都不能进行经典的 芳香族化合物的反应,许多甚至化学性质非 常不稳定。故而,化学性质上的定义已经逐 步被舍弃。
关于芳香性定义的讨论
(4)从分子的磁学形式上比较。这也是现在应用比 较普遍的,被认为最有前景的一个方法。众所周知, 传统芳香性化合物(如苯等)由于π电子的环形离域会 产生抗磁环流,并且可以很方便地从1H NMR 及 13C NMR 谱上得出结论。相似的抗磁环流也被证 明存在于其他芳香化合物中。Schleyer 等人甚至提 出将抗磁系数的上升(diamagnetic susceptibility exaltation)作为唯一可量化的芳香性的标准 。1996 年,Schleyer 又提出将与核无关的化学位移(NICS, nucleus-independent chemical shifts)作为芳香性的 标准。关于NICS 的讨论也正在不断深人中,仍然 有一些问题有待解决。
芳香性的定义
随着量子力学在化学中的应用,进一步从结构上揭开了芳 香性的秘密。在芳香烃分子的芳环上,每个碳原子都以SP2杂 化轨道相互交盖,构成环状平面,处在同一个环平面上的每个 碳原子还剩下一个未杂化的P轨道,这些P轨道轴相互平行,于 是相互间发生交盖重叠,形成“芳香大π键”,所有的π电子 成为环绕整个环平面运动的电子流,完全失去了它们的定域性 。这种芳香大π键又称为非定域键(离域键)。由于π电子离 域的结果,导致体系能量降低,热稳定性增加,键长趋于平均 化,芳环上所有碳碳键都完全相同,键长也完全相等( 0.139nm),它们既不是一般的碳碳单键(0.154nm),也不是 一般的碳碳双键(0.133nm),而是每个碳碳键都具有这种闭 合大π键的特殊性质,在核磁共振光谱上表现出较大的化学位 移(δ值)。目前人们将芳香性跟分子能量较低这个性质联系 起来。人们一直将芳香性化合物所具有特殊的结构稳定性归结 于电子的离域作用,但这种离域作用并不能使共轭多烯有明显 的芳香性。
精品课件!《高等有机化学》_芳环上的亲电和亲核取代反应
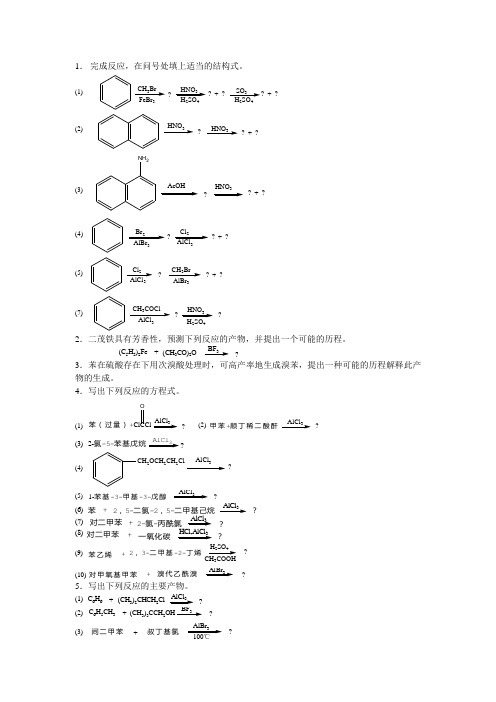
1. 完成反应,在问号处填上适当的结构式。
(1)CH 3Br 3?HNO 324? + ?SO 324HNO 3?? + ?HNO 3(2)NH 2?HNO ? + ?(3)Br 23Cl 23?? + ?(4)(5)Cl 23CH 3Br 3?? + ?(7)CH 3COCl3HNO 324??2.二茂铁具有芳香性,预测下列反应的产物,并提出一个可能的历程。
(C 5H 5)2Fe +(CH 3CO)2OBF 3?3.苯在硫酸存在下用次溴酸处理时,可高产率地生成溴苯,提出一种可能的历程解释此产物的生成。
4.写出下列反应的方程式。
苯(过量)+ClCClOAlCl 3?(1)(2)甲苯+顺丁稀二酸酐AlCl 3?(3) 2-氯-5-苯基戊烷AlCl 3?(4)CH 2OCH 2CH 2ClAlCl ?(5)1-苯基-3-甲基-3-戊醇AlCl 3?(6)苯+2,5-二氯-2,5-二甲基己烷AlCl 3?+AlCl 32-氯-丙酰氯对二甲苯?(7) +HCl,AlCl 3对二甲苯一氧化碳?(8)?+243苯乙烯2,3-二甲基-2-丁烯(9)?+AlBr 3对甲氧基甲苯溴代乙酰溴(10)5.写出下列反应的主要产物。
(1)C 6H 6(CH 3)2CHCH 2Cl AlCl 3?+ (2)C 6H 5CH 3(CH 3)3CCH 2BF 3?+ (3)间二甲苯叔丁基氯AlBr 3?+6.把下列各组化合物按指定性能排序,并解释原因。
酸性:(1)OHCN OHNO2OHNH2OH(2)COOH NO2COOH BrCOOHSO3H(3)COCH2COCH3COCH2COCF3(4)OH OHCH3OHCH3H3CNO2OHNO2O2N碱性:(1)NH2NHCOCH3NH2NO2OONH(2)NH2CH3CH2NH2NH2NO2NO2NH2NO2(3)HNHN H NOO7.完成下列反应。
(1)CH 3+(CH 3)2CHCH 2ClAlCl 3H 2SO 4??(2)??H 2SO 4HNO 324(3)???HNO 324KMnO 4Br 2Fe(4)+??AlCl 3HNO 3H 2SO 4COClO 2N(5)??ClCH 2ClMg PhCH 2Cl乙醚(6)+???H3CCl 2H 2光照(7)+???CH 3CHCHCH 2ClHBrBr 2HO∆NaO(8)+?O 2V 2O 53稀H 2SO 4??(9)????OOONH3OH -Cl 2,NaOHNaNO 2Cu 2Cl 2(10)??°H 3CNH 2NaNO 2,HCl 2(11)?+CH 3ONaCH 3OHClClNO 28.由所给原料合成产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019/6/4
26
• 取代基中与苯环相连接的原子带有孤电子
对。
Z
由于Z有未公用电子对,通过共轭作用可以 把电子部分地转移到环中,使得环中的电子
云密度增大,有利于亲电试剂的进攻,生成
σ络合物后,正电荷可以转到Z上。
2019/6/4
27
上面结论还可以用共轭效应来分析定位问题: Z
Óë Y+ ¿É ÒÔ ÐÎ ³É ÒÔ Ï s Âç ºÏ Îï
2019/6/4
28
2019/6/4
12
13
29
☛ o-,p-比m-多一个Lewis 结构式(12或13), 且12和13对共振体的贡献又最大(除H外的 每一个原子都是8隅体),因为o-和p-比m中间体要稳定得多。
☛ 因此这样的Z是邻位、对位定位基。 ☛ 结论:在与环相连的原子上有未公用电子
对的基团是致活基团,且是邻、对位定位基。
2019/6/4
34
这是因为: ① 量子力学计算σ络合物的正电荷在各个C点
上的分布如下:
HH
0.25
0.25
0.1
0.1
0.3
2019/6/4
35
② 邻位有位阻效应,特别是对于大的基团这 个效应更加明显。如:
Br HNO3
Br +
Br NO2
NO2
90% 以上
2019/6/4
36
(3)Orientation in Benzene Rings with More than One Substituent
L
slowly
Y
L
L
Y
Y
1
L Y
fast 2
Y + L+ 3
2019/6/4
9
反应过程生成芳离子中间体,这一正离子可 以写1的共振杂化体形式,也可以用2的离域 式来描述。2称做σ络合物。
对于进攻试剂是偶极离子,中间体按下式 生成:
2019/6/4
10
L
δ+ δ-
+Y Z
L Y + Z-
生成的正离子非常活泼,它可以失去L或 失去Y,变成稳定的芳香结构。若失Y,则 变回原来的原料,实际上未发生反应;若 失去X,发生了Y对X的取代反应。关于此 正离子机理有以下的证据:
Me
H Me
H Me SbF6-
Me
σ络合物
2019/6/4
13
关于σ络合物的生成步骤,有人认为首先 生成π络合物,然后在转换σ络合物。
+ Y+
Y+
p Âç ºÏ Îï Ò² ³Æ ´« ºÉ Âç ºÏ Îï
H +Y
s Âç ºÏ Îï
2019/6/4
Y + H+
²ú Îï
14
已经发现了稳定的π络合物溶液:
第五章 芳环上的取代反应
2019/6/4
1
HC HC
C
H
H C
CH C
H
2019/6/4
2
脂肪族碳上的取代反应大多数是亲核的。
芳香环上的取代反应,则相反。
因为芳环上电子云密度大,它吸引正离子 或偶极分子的正端。
因此进攻试剂是带正电的,而离去基也是 不带走电子对的正离子,即离去基是酸。
以两个基团为例,分以下几种情况讨论
① 两个基团互相加强的,很好预测:
CH3
COOH
CH3 Cl
2019/6/4
37
② 彼此相反,预言困难: 两个基团的定位能大致相等。
NHCOCH3 OCH3
ËÄ Ö ²ú Îï ´ó Ö Ïà µÈ
2019/6/4
38
强活化基 + 较弱活化基(or 钝化基)前 者是控制产物。 间位定位基和o-,p-定位基成间位关系时, 主要进入间位基的邻位(简称邻位效应) 原因尚不太清楚。
fm=
kPhZ/2 × kPhH/6
m
异构体 100
fp= kkPPhhHZ//16×
p 异构体
100
当 f > 1 时,该位置的活泼性比苯大,否
则比苯小。
2019/6/4
46
例如: ☛ 在硝酸与乙酸酐的体系中甲苯的硝化速 度是苯进行硝化反应的23倍。 取代产物的百分比为:
邻
对
间
63%
34%
3%
2019/6/4
21
ZH
邻位
Y
+
3
Z
¶Ô λ
+
YH
6
Z
+
¼ä λ
H
Y
9
2019/6/4
ZH +Y
4
Z
+
YH 7 Z
H +Y 10
ZH Y
+
5
Z
+
YH 8 Z
+
H Y 11
ZH +Y
Z
+
YH
Z
+
H
Y
22
• 若Z是+I基团,中间的电荷可以分配到Z 上去,因此它使得环上的正电荷减少,中 间稳定性增大,即Z是致活基团。
脂肪族亲电取代反应中的离去基是弱碱。
2019/6/4
3
芳环上离域的π电子的作用,易于发生 亲电取代反应,只有当芳环上引入了强吸 电子基团,才能发生亲核取代反应。
2019/6/4
4
芳环 亲电取代反应
2019/6/4
5
1. Mechanism
(1)反应机理
芳香族亲电取代反应,大多数以1种机理 进行,这种机理称为芳正离子机理,在 这个机理中,反应分2步进行:
2019/6/4
17
但是当环上以经有一个取代基Z (e.g. CH3)。
Z
那么就产生了两个问题:
2019/6/4
18
① 此化合物是比苯活泼,还是比苯不活泼? 若是比苯活泼,则Z使苯环活化,若不活 泼则Z使苯环钝化。
② 新进入的基团,可以进入Z的o-,p-,m-, 究竟哪一种为主?这个问题取决于Z的性 质。
邻位σ络合物的Lewis结构式4,和对位σ 络合物的Lewis结构式8的带正电荷原子 直接与Z相连结论:+I基团是致活基团, 且是邻对位定位基。
2019/6/4
23
间位σ络合物则没有这种情况,因此邻o-、 p-对σ络合物比m- 位稳定,因此主要生成o-, p- 取代产物。 结论:+I基团是致活基团,是邻对位定位 基。
CH3 e.g
2019/6/4
41
(2)杂环化合物
2019/6/4
42
N
N
☛ 比苯环的活性差
☛ 喹啉反应一般发生在苯环,而不是吡啶 环,反应比苯苯慢,比吡啶快。
2019/6/4
43
(5)取代基的定量关系
取代基效应与化学活性之间存在一定的 定量关系。 ① 分速度因数与选择性
从定量关系上考虑邻、对、间位取代 难易程度。
2019/6/4
24
• 如果芳环相连的原子为不带孤电子对的I基团。它使整个苯环的电子云密度降低, 形成σ络合物后,Z的-I效应使得环上的正 电荷更加集中,不稳定,反应速度减慢, Z是致钝基团。
2019/6/4
25
o-和p-中间体都有一个正则式其带正电 荷核与Z相邻,而m-则没有,因此生成 m-中间体比o-对- 更稳定,因此取代主要 发生在间位上。 结论:不带孤电子对的-I基团,使苯环钝 化,且是间位定位基。
2019/6/4
11
① 同位素效应,若按SE1机理,则有同位素 效应,即KD小于KH。但实际上,大多数情 况下,没有同位素效应,说明反应速度决 定步骤不是C—H的断裂。
② 正离子中间体的分离,下面中间体已经分 离出来了:
2019/6/4
12
H
Me
Me
SO2(liquid)
+ HF + SbF5
-78℃
2019/6/4
53
3. Some Examples of Reaction.
(1)Nitrogen Electrophiles • 硝化反应
通式
Ar H HNO3 / H2SO4 Ar NO2
ρ 表示了取代基对反应速率的影响。
2019/6/4
52
σ>0, 取代基为吸电子基团; σ< 0, 取代基为供电子基团。
当ρ> 0时, 吸电子基团加速反应; 当ρ <0时,供电子基团加速反应; 当ρ= 0时,取代基对反应影响不大。
根据σ值,可以预测取代基性质; 根据ρ值,可以预测反应机理。
2019/6/4
44
分速度因数 (f) = (6) (k取代)(z产物的百分比) y (k苯)
y-取代位置的数目
通过每一个位置取代苯的活性与苯比较, 把总的速率乘以邻位、间位或对位产物的百 分比,再除以苯的取代速率的结果。
2019/6/4
45
fo=
kPhZ/2 kPhH/6
×
o
异构体 100
2019/6/4
32
• 卤素。卤素的诱导效应和共轭效应相反, 前者使苯环致钝,后者致活,总效应是钝 化。但是卤素是邻对位定位基,这是因为 生成中间体后,C效应是起主导作用的。
2019/6/4
33
(2)Ortho/Pare Ratio
在前面的讨论中,已经提到邻对位定位基, 现在的问题是:若取代基是邻对位定位基, 那么o,p的活性是否相等呢?如果是相等, 那么 o/p=2,但事实上o/p <2。为什么?
